Kastračně rezistentní karcinom prostaty představuje poslední fázi tohoto onemocnění. Většina studií s novými preparáty systémové léčby směřuje do této oblasti. Kombinace hormonální léčby, nových antiandrogenů a PARP inhibitorů slibuje průlom v léčbě stadia karcinomu prostaty s nejhorší prognózou. Olaparib je v současnosti jediným PARP inhibitorem schváleným pro léčbu pokročilého karcinomu prostaty.
Primární léčbou metastatického karcinomu prostaty (KP) je farmakologická nebo chirurgická (nyní již minimálně využívaná) kastrace. Podle doporučení Evropské urologické asociace (EAU) by však u všech mužů, u kterých je to možné, měla být kastrační léčba doplněna o hormonální preparáty nové generace (androgen receptor pathway inhibitors – ARPI), abecedně abirateron, apalutamid, enzalutamid nebo darolutamid. Pokud selže tato kombinovaná léčba, nastává stadium kastračně rezistentního KP (castration-resistant prostate cancer – CRPC) a nejčastěji přichází ke slovu chemoterapie docetaxelem. Ta je však zatížena řadou nežádoucích účinků, včetně změn v krevním obraze (hlavně neutropenie), periferní neuropatie nebo změn v trofice kůže a nehtů. Kromě již desítky let známé hormonální závislosti KP se v poslední době do popředí zájmu dostávají také genetické aspekty tohoto onemocnění.
Klinické parametry a prognóza hereditárního karcinomu prostaty
Pouze malá část mužů s KP má čistě dědičnou formu, podle EAU Guidelines definovanou jako výskyt nádoru u tří mužů v jedné rodině, u tří za sebou následujících generací nebo u dvou a více mužů s diagnózou KP před 55 lety věku. Hereditární KP (hKP) je spojen s časnějším výskytem nádoru (cca o 6–7 let dříve) ve srovnání s případy bez dědičného podkladu, nicméně zdá se, že agresivita nebo klinický průběh nemoci se neliší. V analýze rozsáhlé databáze z USA odpovídalo parametrům hKP celkem 2,18 % nádorů ze všech zjištěných případů. Relativní riziko pro diagnózu jakéhokoliv KP dosáhlo hodnoty 2,30, pro časný výskyt KP 3,93, pro letální karcinom 2,21 a pro 2,32 pro klinicky signifikantní KP. Ve švédské populační studii v případě otce nebo dvou bratrů s KP měl další muž v rodině v přímé linii 11,4% pravděpodobnost diagnózy KP vysokého rizika ve věku 65 let. Pro srovnání riziko v běžné populaci činilo 1,4 %. Riziko jakéhokoli KP pak v případě daného muže dosáhlo 43,9 vs. 4,8 %.
Genetické aspekty karcinomu prostaty
Genomové studie identifikovaly více než 100 lokusů náchylnosti ke vzniku (agresivního) KP. Kohortové studie klinických souborů běžně hlásí přibližně 15–17 % případů se zjištěnými zárodečnými mutacemi bez ohledu na stadium onemocnění. Ve studii s muži s KP ve všech stadiích, kteří podstoupili multigenové testování ve Spojených státech, bylo zjištěno, že 15,6 % z nich má patogenní varianty v nejméně jednom z analyzovaných genů. Jednalo se o geny BRCA1, BRCA2, HOXB13, MLH1, MSH2, PMS2, MSH6, EPCAM, ATM, CHEK2, NBN, a TP53. Nejčastěji se jednalo o mutace BRCA2 (4,5 %), CHEK2 (2,2 %), ATM (1,8 %) a BRCA1 (1,1 %). Navíc 10,9 % mužů mělo i zárodečné mutace v genech podílejících se na opravě DNA (DNA damage repair – DDR). V jiné studii u pacientů s metastatickým CRPC, screenovaných pro DDR mutace v celkem 107 genech, dosáhl podíl nositelů těchto mutací 16,2 %. Opět v jiné neselektované populaci pacientů s metastatickým KP byla incidence zárodečných mutací v DDR genech zjištěna u 11,8 % mužů. Právě tyto geny se úzce týkají nových preparátů, tj. inhibitorů poly-adenosindifosfát-ribózo-polymerázy (PARP), o jejichž zástupci – olaparibu – pojednáváme v tomto článku.
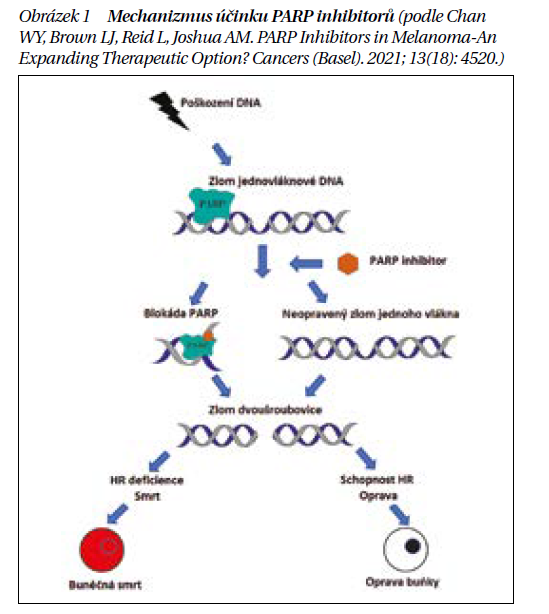
Mechanizmus účinku PARP inhibitorů
Účinek PARP inhibitorů představuje složitý mechanizmus, který zahrnuje zablokování opravy poruch na úrovni jednovláknové deoxyribonukleové kyseliny (DNA). V případě poškození DNA, respektive jejího jednoho vlákna, nastupuje k opravě PARP. Pokud ji zablokujeme, dochází ke zlomu ve dvoušroubovici DNA a úmrtí buňky. Nicméně toto nastane pouze, pokud je v organizmu přítomný defektní gen, který neumožňuje opravu zlomů dvoušroubovice pomocí homologní rekombinace (homologous recombination repair – HRR) (obrázek 1). Inhibitory PARP tedy cílí na pacienty, kteří mají tento defektní fenotyp a u nichž nedochází k opravám zlomů DNA podle uvedeného schématu.
Olaparib
Iindikace a délka léčby, dávkování
Podle souhrnu údajů o přípravku je v současnosti v České republice olaparib schválen pro řadu diagnóz (karcinomy vaječníku, prsu nebo pankreatu), stran KP se jedná o:
- monoterapii k léčbě dospělých pacientů s germinální a/nebo somatickou mutací BRCA1/2 u metastatického CRPC, u kterých došlo k progresi po předchozí léčbě zahrnující nový hormonální přípravek (tj. abirateron, apalutamid, darolutamid nebo enzalutamid),
- kombinaci s abirateronem a prednisonem nebo prednisolonem k léčbě dospělých pacientů s metastatickým CRPC, u nichž není klinicky indikována chemoterapie.
Jedná se o tabletovou p. o. léčbu. V monoterapii se olaparib podává v dávce 2 tablety 150 mg p. o. 2× denně, což odpovídá celkové denní dávce 600 mg. Jsou dostupné i tablety 100 mg pro případ nutnosti redukovat dávku. Jestliže se olaparib používá v kombinaci s abirateronem k léčbě pacientů s metastatickým CRPC, je dávka abirateronu 1 000 mg p. o. 1× denně. Abirateron má být podáván s prednisonem nebo prednisolonem v dávce 5 mg p. o. 2×denně.
V obou indikacích se doporučuje pokračovat v léčbě až do progrese základního onemocnění nebo do nepřijatelné toxicity. U pacientů, kteří nejsou chirurgicky kastrovaní, má během léčby pokračovat léková kastrace analogem hormonu uvolňujícího luteinizační hormon (LHRH).
Klinická data
Olaparib byl pro léčbu KP uveden na trh na základě dvou úspěšných studií fáze III, které se věnovaly pacientům s CRPC. Otevřené randomizované studie PROfound se zúčastnilo celkem 387 mužů s CRPC progredujícím po jedné linii nové hormonální léčby (zde abirateron nebo enzalutamid). U všech mužů musela být potvrzena mutace alespoň v jednom z předem definovaných genů, které se účastní HRR.
Podle typu mutace pak vznikly dvě kohorty pacientů, kohorta A (245 mužů) měla nejméně jednu mutaci v genech BRCA1, BRCA2 nebo ATM, kohorta B (142 mužů) pak měla alteraci v dalších 12 genech. Pacienti byly randomizováni v poměru 2 : 1 k podání olaparibu nebo enzalutamidu/abirateronu (kontrolní skupina). Primární cíl představovalo přežití bez radiografické progrese (radiographic progression-free survival – rPFS) podle zaslepeného centrálního hodnocení. V kohortě A bylo toto přežití významně delší ve větvi s olaparibem (medián 7,4 vs. 3,6 měsíce; poměr rizik [hazard ratio – HR] pro progresi nebo úmrtí 0,34; 95% interval spolehlivosti [confidence interval – CI] 0,25–0,47; p < 0,001). Olaparib tak snížil riziko progrese nebo úmrtí o 66 % proti ARPI.
Významný přínos byl také pozorován s ohledem na potvrzenou objektivní radiologickou odpověď a čas do zhoršení bolestivých symptomů. Střední doba celkového přežití byla také významně delší ve větvi s olaparibem (18,5 vs. 15,1 měsíce), 81 % pacientů progredujících v kontrolní skupině následně přestoupilo k podání olaparibu.
Významný přínos olaparibu byl také patrný v celé populaci (kohorta A + B). Anémie (46 %) a nauzea (41 %) představovaly hlavní nežádoucí účinky (NÚ) ve skupině léčené olaparibem. Na základě výsledků studie PROfound tedy olaparib získal indikaci pro léčbu metastatického CRPC v progresi po předchozí léčbě některým z nových hormonálních preparátů. Nevíme ale, jak by dopadlo srovnání olaparibu například s docetaxelem. Pravděpodobně lépe než s ARPI, naopak totiž víme, že účinnost jednoho hormonálního preparátu po druhém je velmi nízká. Nicméně olaparib představuje elegantní variantu perorální, a hlavně personalizované léčby u pacientů, kteří by jinak k chemoterapii stejně byli indikováni.
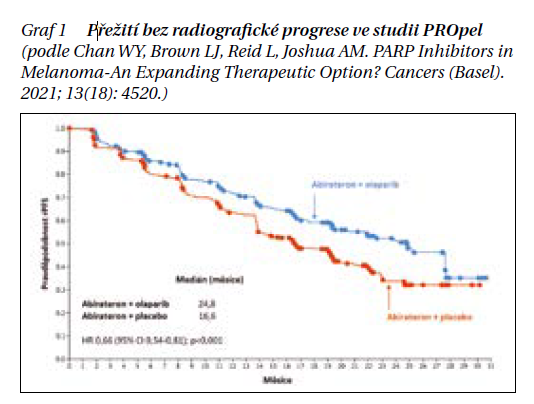
Ve studii PROpel bylo celkem 796 mužů s metastatickým CRPC bez předchozí léčby v tomto stadiu randomizováno do intervenční větve k podání olaparibu s abirateronem a prednisonem (dávkování viz výše) nebo kontrolní větve s placebem a abirateronem s prednisonem. Jednalo se tedy o první linii systémové léčby CRPC, bylo však možné podat docetaxel v hormonálně senzitivním stadiu.
Na rozdíl od předchozí studie mezi vstupní kritéria nepatřila pozitivita mutace v HRR genech. Genetický status byl však v rámci studie vyšetřen a stal se také podkladem pro velmi důležitou subanalýzu. Celkem 28,4 % mužů mělo pozitivní alespoň jednu mutaci (HRR pozitivní skupina), 69,3 % tvořilo tzv. HRR negativní skupinu, u 2,3 % nebyl HRR status znám. Primární cíl opět představoval rPFS (zde ale hodnocený přímo na jednotlivých centrech) nebo úmrtí bez patrné progrese. Skupina s olaparibem měla významně delší rPFS proti kontrolní skupině (medián 24,8 vs. 16,6 měsíce; HR 0,66; 95% CI 0,54–0,81; p < 0,001) (graf 1). Intervence olaparibem dosáhla lepších výsledků také ve všech podskupinách. Zcela zásadní informaci přináší subanalýza podskupin podle HRR statusu. Abirateron s olaparibem byl lepší bez ohledu na přítomnost genových mutací, v případě HRR pozitivity došlo ke snížení rizika progrese nebo úmrtí o významných 50 % (HR 0,50; 95% CI 0,34–0,73), u HRR negativní skupiny o 24 % (HR 0,76; 95% CI 0,60–0,97). Nejčastěji se z NÚ ve větvi s olaparibem a abirateronem objevily anémie, únava a nauzea. Ve srovnání s předchozí studií PROfound se nevyskytly žádné nové NÚ.
Závěr
Metastatický CRPC získává s PARP inhibitory další linii léčby a olaparib představuje první preparát tzv. personalizované terapie KP. Ačkoliv je indikace podání olaparibu zatím postavena na přítomnosti mutací genů pro specifickou opravu DNA, kombinace s abirateronem ve studii PROpel prokázala, že léčba PARP inhibitory může být účinná i u pacientů bez těchto genetických změn. Ve stadiu klinických zkoušek je v současnosti řada dalších preparátů, které pro zjednodušení uvádíme v tabulce 1.
doc. MUDr. Otakar Čapoun, Ph.D., FEBU
Urologická klinika 1. LF UK a VFN v Praze
