Zavedení inhibitorů kontrolních bodů imunitní reakce zcela zásadně pozměnilo léčbu solidních nádorů. „Znovuobrození“ imunoterapie patří mezi největší události poslední doby. Imunoterapie se stala nepostradatelnou modalitou onkologické léčby s indikací napříč celým spektrem solidních nádorů. U pokročilých nebo metastazujících dlaždicobuněčných karcinomů oblasti hlavy a krku byla prokázána účinnost imunoterapie v klinických studiích. Přesná (precizní) imunoterapie je zatím iluzorní. Imunoterapie je sice účinná napříč solidními nádory, ale hrdlo účinnosti je poměrně úzké a dlouhotrvající léčebné odpovědi lze zatím dosáhnout u 20–30 % léčených pacientů. Limitací této inovované terapeutické modality je chybění prediktivních biomarkerů a imunomarkerů.
Nádory hlavy a krku zahrnují především karcinomy vycházející z epitelu horních dýchacích a polykacích cest. Jedná se dlaždicobuněčné karcinomy s různým stupněm diferenciace. Jsou v celosvětovém měřítku šestým nejčastěji se vyskytujícím nádorovým onemocněním zahrnujícím 6 % všech nádorových onemocnění a podílí se na 1–2 % všech nádorových úmrtí. Muži mají 2–5× vyšší riziko vzniku tohoto onemocnění než ženy. Riziko stoupá s věkem v době diagnózy – po 60. a častěji 70. roce života.
Lokalizace zhoubných nádorů hlavy a krku:
- karcinom ústní dutiny (včetně sliznice rtu);
- karcinom orofaryngu;
- karcinom hypofaryngu;
- karcinom nazofaryngu;
- karcinom laryngu;
karcinomy paranzálalních dutin;- karcinomy neznámé primární lokalizace (okultní karcinomy).
Karcinomy HPV pozitivní
Nově se významně oddělují od skupiny skvamózních karcinomů hlavy a krku karcinomy HPV (human papilloma virus) pozitivní, jejichž incidence výrazně narůstá. HPV pozitivita je v této lokalitě spojena s lepší prognózou. Nicméně zatím není prediktivním faktorem pro léčbu. Při analýze klinických studií (viz dále) se ukazuje, že kombinace pembrolizumabu a chemoterapie může být účinější u HPV pozitivních karcinomů než monoimunoterapie pembrolizumabem. Vznik HPV negativních dlaždicobuněčných karcinomů souvisí s kouřením a alkoholem, zatímco HPV pozitivní úzce souvisí se sexuálním chováním. Jsou lokalizovány především ve orofaryngu a objevující se více u nekuřáků a u mladší věkové skupiny.
HPV pozitivní nádorové onemocnění je charakterizováno často méně rozsáhlým primárním ložiskem, ale často i postižením spádových lymfatických uzlin. Zastoupení HPV pozitivních karcinomů (HPV+) stoupá. HPV typ 16 (HPV16) se vyskytuje u více než 90 % HPV+ v orofaryngu. Doba mezi první HPV infekcí a rozvojem nádoru se odhaduje na déle než jednu dekádu. Karcinomy nazofaryngu a paranazálních dutin mohou být asociovány s výskytem virové infekce Epsteina–Barrové. Pro odlišné biologické chování včetně zhoubných nádorů slinných žláz nejsou tyto lokalizace předmětem tohoto sdělení.
Současný standard léčby
Současný standard léčby u lokoregionálně pokročilých onemocnění spočívá v primárním chirurgickém výkonu následovaném chemoradioterapií nebo definitivní chemoradioterapií. I přes multimodalitní léčbu až 50 % lokálně pokročilých onemocnění recidivuje buď lokoregionálně, nebo se objeví metastatická diseminace.
Léčba nemocných s lokálně recidivujícím nebo metastazujícím onemocněním bez předchozí systémové léčby závisí na typu iniciální léčby lokoregionalního onemocnění, výkonnostním stavu (performance status – PS), komorbiditách a stupni exprese PD-L1 (CPS) a dalších prognostických faktorech. V době relapsu je nejsilnější prediktivní faktor pro výsledek léčby PS. Základní systémové modality jsou chemoterapie, imunoterapie ICI (inhibitory kontrolních bodů imunitní reakce (pembrolizumab, nivolumab) a terčová léčba (cetuximab).
Systémová léčba
Pro indikaci imunoterapie v léčbě rekurentních a metastazujících dlaždicobuněčných karcinomů oblasti hlavy a krku je nutná imunopredikce stanovením exprese PD-L1. Jedná se o ne zcela dokonalý marker, ale zatím nejlepší, který vimunopredikci nelze vynechat. Pravděpodobnost léčebné odpovědi se zvyšuje s narůstající expresí PD-L1, ale i u některých PD-L1 negativnich solidních nádorů lze navodit léčebnou odpověď. Nutnost standardizace postupu testování a hodnocení výsledků exprese PD-L1 u všech aktuálně relevantních indikaci je klinickou urgencí.
Aktuálně jsou používány tři různé principy hodnocení:
- TPS(tumor proportion score) – hodnotí se procento pozitivních nádorových elementů;
- CPS(combined positive score) – způsob výpočtu je dán počtem všech pozitivních buněk (nádorových, lymfocytů, makrofágů) děleným počtem všech vitálnách nádorových buněk (PD-L1 pozitivnách i negativnách) a násobeným 100; maximální skóre je definováno jako 100, vyšší CPS se neuvádí;
- IC(immune cells) – hodnotí se procento plochy nádoru infiltrované PD-L1 pozitivními zánětlivými elementy.
Zásadní klinickou nevýhodou je, že tyto skórovací metody nejsou přímo vzájemně porovnatelné.
Historicky byla základem systémové léčby monochemoterapie nebo polychemoterapie. Při monoterapii byl nízký počet objektivních léčebných odpovědí v rozmezí 15–35 %. V randomizovaných klinických studiích byl v kombinacích na bázi platiny (cisplatina/5-FU) vs. monochemoterapie (cisplatina, 5-FU, methotrexát) zaznamenán větší počet ORR při kombinaci, ale bez ovlivnění doby přežití a současném nárůstu toxicity. V první klinické randomizované studii fáze se zařazením terčové anti-EGFR léčby fáze (EXTREME) bylo prokázáno, že kombinace cetuximabu s cisplatinou/5-FU nebo karboplatinou/5-FU zvyšuje počet objektivních léčebných odpovědí (36 vs. 20 %, P < 0,001) a medián doby přežití ve srovnání se standardním dubletem platinový derivát/5-FU i (10,1 vs. 7,4 měsíce, P = 0,04). V randomizované studii nebyl prokázán rozdíl mezi kombinací cisplatina/5-FU a cisplatina/paklitaxel.
Imunoterapie
Zavedení inhibitorů kontrolních bodů imunitní reakce zásadně pozměnilo léčbu solidních nádorů. „Znovuobrození“ imunoterapie patří mezi zásadní události poslední doby. ICI se staly nepostradatelnou modalitou onkologické léčby. Jedná se o inovativní terapeutickou modalitu s odlišnými mechanizmy účinku oproti chemoterapii a cílené terčové léčbě s odlišným profilem nežádoucích účinků vyžadující odlišný management.
Imunoterapie jako znovuobrozená modalita
První zmínky o „imunoterapii“ v onkologii lze datovat na konec 19. století, kdy chirurg William Coley jako první popsal, že inokulace bakteriálního substrátu získaného z míst zánětu přímo do nádoru (sarkom) vede ke zmenšení nádorové masy. Účinnost tohoto postupu byla klinicky marginální a ve své době postrádala vysvětlení mechanizmu účinku. Receptor programované buněčné smrti PD-1 byl poprvé zmíněn v časných devadesátých letech minulého století v rámci studia jeho exprese při indukci apoptózy u T buněčných hybridomů.
Revoluční klinický význam imunoterapie check point inhibitory potvrdilo udělení Nobelovy ceny za medicínu a fyziologii v roce 2018 Jamesu P. Allisonovi za „rozluštění“ úlohy cytotoxického T lymfocytárního antigenu 4 (cytotoxic T-lymphocyte associated protein CTLA-4) a Tasuku Honjovi za popis receptoru a ligandu programované buněčné smrti. Na rozdíl od chemoterapie a terčové léčby check point inhibitory nepůsobí přímo cytotoxicky na nádorové buňky, ale léčba vede k obnovení nádorem paralyzované imunity hostitele nemoci.
Ověřování účinnosti imunoterapie ICI v klinických studiích
Imunoterapie umožňuje dosáhnout dlouhodobého léčebného efektu při příznivém profilu nežádoucích účinků. U pokročilých nebo metastazující dlaždicobuněčných karcinomů oblasti hlavy a krku byla prokázána účinnost imunoterapie ICI v klinických studiích.
Jak již bylo uvedeno, před érou imunoterapie byla základním režimem první linie kombinace chemoterapie na bázi platiny v kombinaci s protilátkou proti receptoru pro epidermální růstový faktor EGFR EXTREM režim. V klinické studii TPEXTREM (TPEx) bylo prokázáno, že substituce 5-fluorouracilu docetaxelem zlepšuje bezpečnostní profil při zachování účinnosti.
Účinnost pembrolizumabu, anti-PD-1 protilátky v první linii léčby recidivujících nebo metastazujících SCCHN, byla hodnocena v klinické studii KEYNOTE-048. Nemocní byli randomizováni mezi monoterapií pembrolizumabem, kombinací pembrolizumabu s platinovým derivátem/5-FU, nebo EXTREME režim. V celkové populaci bylo prokázáno prodloužení doby přežití v rameni s chemoimunoterapií (pembrolizumab/platinový drivát/5-F) ve srovnání s ramenem EXTREME (medián OS 13 vs. 10,7 měsíce, HR 0,77, 95% CI 0,63–0,93, P = 0,003). Nebyly zaznamenány rozdíly v PFS. U nemocných s PD-L1 kombinovaným pozitivním skóre (CPS) ≥ 20 nebo ≥ 1 byl medián celkové doby přežití delší u pacientů léčených monoterapií pembrolizumabem ve srovnání s léčbou EXTREME režimem (medián 14,9 vs. 10,7 měsíce, HR 0,61, 95% CI 0,45–0,83, P < 0,001) pro CPS ≥ 20; medián 12,3 vs. 10,3 měsíce, HR 0,78, 95% CI 0,64–0,96, P = 0,009, pro CPS ≥ 1). Medián trvání léčebných odpovědí byl delší při monoimunoterapii pembrolizumabem nebo kombinací pembrolizumabu s chemoterapií ve srovnání s pacienty léčenými EXTREME režimem. Při kombinaci pembrolizumab/platina/5-FU se objevily projevy toxicity stupně 3–5 u 85 % a 55 % pacientů při monoterapii pembrolizumabem. OS benefit pembrolizumabu s nebo bez chemoterapie (platina/5-FU) perzistoval při čtyřletém období sledování.
ICI je proto preferovanou modalitou v první léčebné linii pro všechny pacienty s recidivujícím neresekabilním nebo metastazujícícm onemocněním bez možnosti chirurgické nebo radioterapeutické intervence. Pembrolizumab monoterapie (pro pacienty s CPS ≥ 1) nebo kombinací pembrolizumab/platina/5-FU jsou preferovanou volbou první linie na bázi výsledků studie KEYNOTE-048. Kombinovaný režim je nejvíce využitelný u pacientů PS 0 nebo při rozsáhlém postižení a rychlé progresi onemocnění.
Studie Keynote 048 prokázala efekt imunoterapie v léčbě metastatického onemocnění a vedla k úhradě pembrolizumabu v monoterapii nebo v kombinaci s chemoterapií založenou na platině a fluorouracilu (5-FU) v první linii léčby metastazujícího nebo neresekovatelného recidivujícího dlaždicobunéčného karcinomu hlavy a krku u dospělých pacientů s PS (podle ECOG) 0–1 a prokázané exprese PD-L1 s CPS ≥ 1. Maximální délka léčby je 24 měsíců.
V případě CPS ≤ 1 či kontraindikace imunoterapie je léčebnou alternativou režim studie EXTREME (kombinace cisplatina nebo karboplatina/5-FU/cetuximab), jehož použití vede k prodloužení celkového přežití proti samotné chemoterapii (medián OS 10,1 vs. 7,4 měsíce). Alternativou je uvedený režim TPEx (cisplatina + docetaxel + cetuximab), který má srovnatelnou účinnost s režimem EXTREME při lepší compliance a nižší toxicitě. Použití režimu s cetuximabem je v ČR hrazeno pouze u nádorů dutiny ústní. Pokud došlo k progresi nádoru během nebo do 6 měsíců po chemoterapii s platinovým derivátem pro metastatický/rekurentní skvamózní karcinom nebo po kombinované léčbě s platinovým derivátem (např. chemoradioterapii), je možné indikovat monoterapii nivolumabem.
Podkladem jsou výsledky randomizované studie fáze III CheckMate 141 prokazující účinnost nivolumabu ve 2. linii. V ČR není nivolumab hrazen po předchozí léčbě režimem s cetuximabem. V klinických studiích byl podáván nivolumab v kombinaci a nepodařilo se prokázat prodloužení přežití jako u jiných nádorových typů, jako jsou maligní melanomy, nemalobuněčné plicní karcinomy a renální karcinomy (viz dále). V klinické studii fáze III CheckMate 651, porovnávající kombinaci nivolumab plus ipilimumab s režimem EXTREME, se nepodařilo prokázat zlepšení celkové doby přežití (OS) v celé randomizované populaci. Rozdíly ve prospěch kombinované imunoterapie byly zaznamenány při CPS 20 a výše. V randomizované studii fáze II CheckMate 714 byla porovnávána monoterapie nivolumabem s kombinací nivolumab + ipilimumab v první linii léčby recidivujícího nebo metastazujícího onemocnění. V této klinické studii se nepodařilo prokázat, že přidání anti-CTLA-4 inhibice zvyšuje efekt imunoterapie v léčbě nádorů hlavy a krku. Obdobné negativní výsledky zaznamenala klinická studie KESTREL porovnávající durvalumab ± tremelimumab se standardním režimem bez zařazení imunterapie (schéma 1).
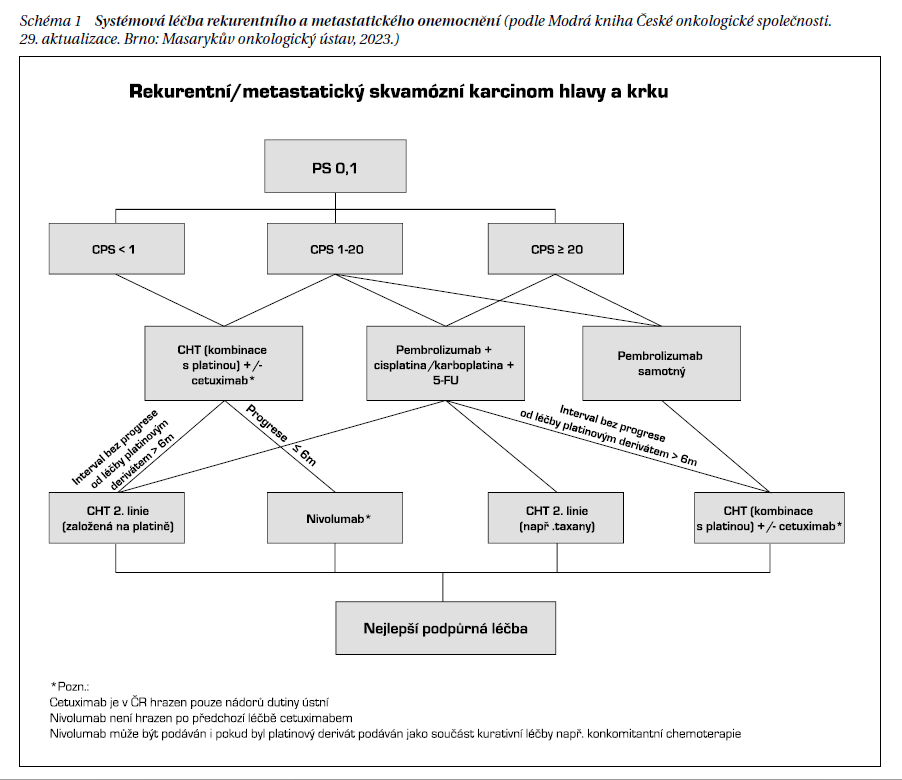
Při volbě režimu paliativní chemoterapie (monoterapie, kombinovaný režim) je nutné přihlédnout k celkovému stavu pacienta, vedlejším onemocněním, terapeutickému cíli i preferenci pacienta. Přínos chemoterapie pouze ve smyslu prodloužení života je obecně velmi sporný. Při analýze výsledků byl pozorován zajímavý fenomém týkající se nárustu chemosenzitivity po předléčení imunoterapií. Rozdíly mezi jednotlivými režimy jsou v pravděpodobnosti odpovědi, ale i toxicitě.
Závěr
Přesná (precizní) imunoterapie je zatím iluzorní. Imunoterapie je sice účinná napříč solidními nádory, ale hrdlo účinnosti je poměrně úzké a dlouhotrvající léčebné odpovědi lze zatím dosáhnout u 20–30 % léčených pacientů. Širší hrdlo účinnosti je u nejvíce imunogenních nádorů, jako jsou maligní melanomy, renální a plicní karcinomy. Limitací této inovované terapeutické modality je absence prediktivních biomarkerů a imunomarkerů. Cílem je zúžení indikačního hrdla, zvýšení účinnosti a eliminace rizik nežádoucích projevů. Imunoterapie check point inhibitory působí bez ohledu na lokalizaci a typ tkáně. V některých indikacích je možné imunoterapii považovat za nádorově agnostickou, lokalizačně agnostickou a histologicky agnostickou léčbu. Kontroverzní otázky imunoterapie (primární, sekundární rezistence, hyperprogrese, hypertoxicita, doba podávání, reindukce) musí být též urgentně řešeny. Aplikace precizní medicíny vyžaduje změnu klinického myšlení – nejedná se o výběr nejlepší léčebné modality, ale o výběr (optimální) léčby pro každého nemocného. Imunoterapie checkpoint inhibitory se stala klíčovou součástí standardních algoritmů léčby pacientů v pokročilých stadiích onemocnění. Imunoterapie přestává být pouze léčbou paliativní. Ve vybraných indikacích bude léčbou s „kurativním“ záměrem. V dohledné době lze očekávat posun k léčbě méně pokročilých stadií v neoadjuvantní a adjuvantní indikaci.
Literatura u autora.
prof. MUDr. Luboš Petruželka, CSc.
Onkologická klinika 1. LF UK a VFN v Praze
Ústřední vojenská nemocnice Praha
