Léčba bronchogenního karcinomu zaznamenala v posledních letech výrazný pokrok. U nemalobuněčného karcinomu plic je to díky rozšiřujícím se možnostem cílené léčby a imunoonkoterapii. Tyto léčebné modality se nyní uplatňují i v léčbě časných, resekabilních nádorů ve snaze zabránit recidivám i po radikální operaci. Také v léčbě malobuněčného karcinomu plic je u extenzivního stadia standardem léčby imunoterapie + chemoterapie.
Řada studií fáze II a III již prokázala účinnost inhibitorů kontrolního bodu imunitní reakce (immune checkpoint inhibitorts – ICI) v neoadjuvantním či adjuvantním podání. V neadjuvantním podání jsou ukazateli účinnosti přežití bez příhody (event-free survival – EFS). To je definováno jako doba od randomizace do příhody, jako je recidiva nádoru, progrese vylučující definitivní operaci nebo úmrtí. Dalším ukazatelem účinnosti je kompletní patologická odpověď (pCR), definovaná jako absence životaschopného nádoru v resekátu, případně významná patologická odpověď (major patological response – MPR), definovaná jako reziduální životaschopný nádor ≤ 10 % v resekátu primárního nádoru po neoadjuvantní léčbě. V adjuvanci je pak ukazatelem účinnosti přežití bez nemoci (DFS) definované jako doba, po kterou je pacient živ a nemá známky choroby po předchozí radikální operaci.
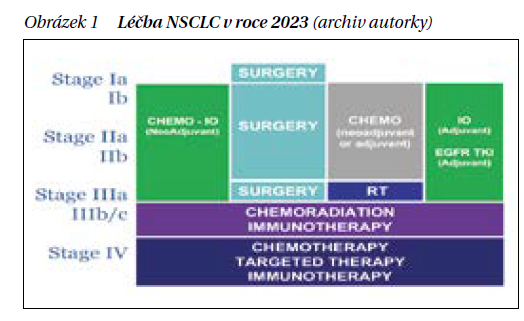
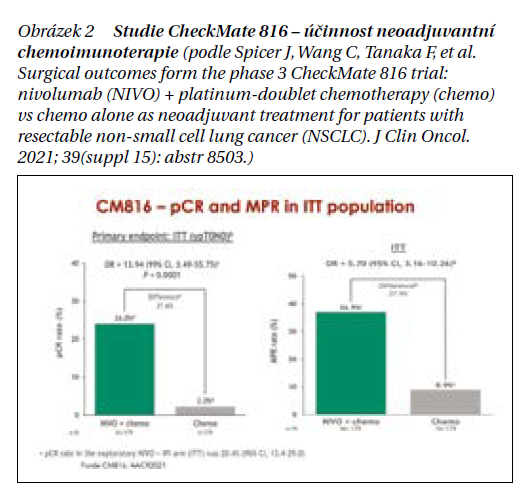
Léčba časných, operabilních stadií nemalobuněčného karcinomu plic Přehled léčby NSCL v roce 2023 je uveden na obrázku 1. Studie fáze III CheckMate 816 prokázala účinnost neadjuvantního podání 3 cyklů nivolumabu + chemoterapie vs. chemoterapie u resekovatelného nemalobuněčného karcinomu plic (NSCLC) ve stadiu IB (≥ 4 cm) – IIIA (AJCC verze 7), ECOG PS ≤ 1 a bez prokázaných aberací EGFR/ALK. Definitivní operace by měla být provedena do 6 týdnů od ukončení neadjuvantní léčby, četnost chirurgických zákroků byla 83 % u NIVO + chemoterapie (n = 149) oproti 75 % u chemoterapie (n = 135). Lobektomie byla provedena u 77 vs. 61 % pacientů a pneumonektomie u 17 vs. 25 %. Medián EFS byl 31,6 měsíce (95% CI 30,2–nedosaženo) ve větvi NIVO + chemoterapie a 20,8 měsíce (95% CI 14,0–26,7) u těch, kteří dostávali samotnou chemoterapii. HR 0,63 (97,38% CI 0,43–0,91; p = 0,0052). Míra pCR byla 24 % (95% CI 18,0–31,0) v rameni s NIVO + chemoterapií a 2,2 % (95% CI 0,6–5,6) v rameni se samotnou chemoterapií (obrázek 2). Kromě toho nivolumab + chemoterapie vedly ke 43% snížení rizika úmrtí oproti samotné chemoterapii (HR 0,57; 99,67% CI, 0,30–1,07). Na základě těchto výsledků v květnu 2023 EMA (European Medicines Agency) schválila nivolumab v kombinaci s chemoterapií na bázi platiny pro neoadjuvantní léčbu pacientů s resekabilním NSCLC s vysokým rizikem recidivy s expresí PD-L1 nádorových buněk ≥1 %. Jedná se o první léčebný režim založený na neoadjuvantní imunoterapii schválený pro pacienty v Evropské unii. V ČR je tato léčba dostupná díky Bridging Program firmy BMS.
Ve studii fázi III KEYNOTE-671 dostávali pacienti s resekovatelným NSCLC stadia II, IIIA a IIIB (T3–4N2) (AJCC verze 8) 4 cykly neadjuvantní chemoterapie na bázi cisplatiny + pembrolizumabu/placeba následované adjuvantním pembrolizumabem/placebem po dobu až 13 cyklů. Aktualizovaná analýza prezentovaná na loňském ESMO ukázala statisticky zlepšené celkové přežití (OS) v rameni s pembrolizumabem (HR 0,72, medián nedosažen oproti 52,4 měsíce v rameni s placebem, 36měsíční míra OS byla 71,3 oproti 64,0 %). Jedná se o první klinickou studii s perioperační chemoimunoterapií u NSCLC prokazující celkový přínos přežití. Na základě těchto výsledků byla tato léčba 16. 10. 2023 schválena FDA (Food and Drug Administration).
Další studie fáze III prokazující účinnost perioperační chemoimunioterapie jsou např. AEGEAN s durvalumabem, CheckMate77T s nivolumabem.
Studie fáze III IMpower010 porovnávala atezolizumab (atezo) s nejlepší podpůrnou péčí (BSC) po adjuvantní chemoterapii u pacientů s resekovaným NSCLC stadia IB (T ≥ 4 cm) až IIIA (AJCC verze 7). Po 36 měsících bylo DFS 60,0 % s adjuvantním atezo vs. 48,2 %. Medián DFS nebyl dosažen (95% CI 36,1–ne) v rameni s atezo oproti 35,3 měsíce (95% CI 29,0–ne) v rameni BSC (HR 0,66, 95% CI 0,50–0,88, P = 0,0004). Výrazný prospěch z adjuvantního atezo oproti BSC měli pacienti s expresí PD-L1 ≥ 50 % (HR 0,43, 95% CI 0,27–0,65). Rovněž předběžná analýza OS prezentovaná na WCLC 2022 s mediánem sledování 45 měsíců (HR 0,42, 95% CI 0,23–0,78) ukázala prospěch z adjuvantní imunoterapie. EMA schválila atezolizumab jako adjuvantní léčbu po kompletní resekci a chemoterapii na bázi platiny pro dospělé s NSCLC s vysokým rizikem recidivy, jejichž nádory exprimují PD-L1 ≥ 50 % a kteří nemají EGFR mutovaný nebo ALK pozitivní NSCLC v červnu 2022. Od 1. 3. 2023 je tato léčba hrazena také z veřejného zdravotního pojištění v České republice.
Účinnost pembrolizumabu v adjuvantní léčbě po resekci a chemoterapii na bázi platiny u NSCLC stadia IB (T2a ≥ 4 cm) až IIIA byla hodnocena ve studii fáze III PEARLS/KEYNOTE-091. U pacientů, kteří dostávali adjuvantní chemoterapii, byl medián DFS 58,7 měsíce v rameni s pembrolizumabem (95% CI 39,2–nedosaženo) a 34,9 měsíce v rameni s placebem (95% CI 28,6–nedosaženo) (HR 0,73, 95% CI 0,60–0,89). V lednu 2023 schválila FDA pembrolizumab pro adjuvantní léčbu po resekci a chemoterapii na bázi platiny u NSCLC stadia IB–IIIA.
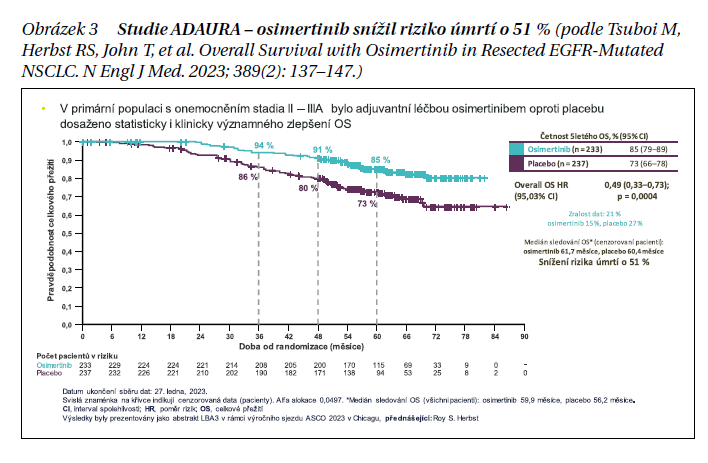
Účinnost cílené adjuvantní léčby osimertinibem při prokázané EGFR mutaci (delece exonu 19 a mutace exonu 21 L858R) prokázala studie ADAURA. Podání osimertinibu po dobu 3 let po operaci významně zlepšilo OS ve srovnání s placebem na základě střední doby sledování asi 5 let. Mezi pacienty s onemocněním stadia II–IIIA snížil osimertinib riziko úmrtí o 51 % (HR 0,49, 95,03% CI [0,33, 0,73]; P < 0,001), přičemž 85 % pacientů v rameni s osimertinibem přežilo 5 let ve srovnání se 73 % pacientů v rameni s placebem (obrázek 3).Podobný, statisticky signifikantní (p < 0,0001) rozdíl v OS prokázala studie ADAURA i u celého souboru pacientů, tedy se stadii onemocnění IB–IIIA. Adjuvantní osimertinib je v současné době jediným inhibitorem tyrosinkinázy EGFR [TKI], který ve studii fáze III převádí statisticky významný a praxi měnící přínos DFS do významného přínosu OS, čímž podporuje osimertinib jako standard léčby těchto pacientů. V České republice je tato léčba hrazena z veřejného zdravotního pojištění od ledna 2023.
Léčba lokálně pokročilého NSCLC Standardem léčby lokálně pokročilého, inoperabilního NSCLC stadia III, které neprogreduje po souběžné chemoradioterapii na bázi platiny, je na základě studie fáze III PACIFIC imunoterapie durvalumabem, který je podáván po dobu 12 měsíců. Míra 60měsíční OS v podskupině pacientů s expresí PD-L1 ≥ 1 %, tedy kritérium odpovídající schválené indikaci EMA, byla 50,1 % v rameni s durvalumabem a 36,9 % v rameni s placebem. Odpovídající mediány OS u této skupiny pacientů činily 63,1 měsíce a 29,6 měsíce. I v České republice je tato léčba hrazena z veřejného zdravotního pojištění.
Léčba metastatického NSCLC
Při rozhodnutí o léčebném postupu je nezbytné mimo morfologické diagnózy také molekulárněgenetické vyšetření, které umožňuje precizní a personalizovanou léčbu především neskvamózního NSCLC na základě zjištěných genetických změn. Tyto změny jsou pak prediktory účinnosti cílené léčby.
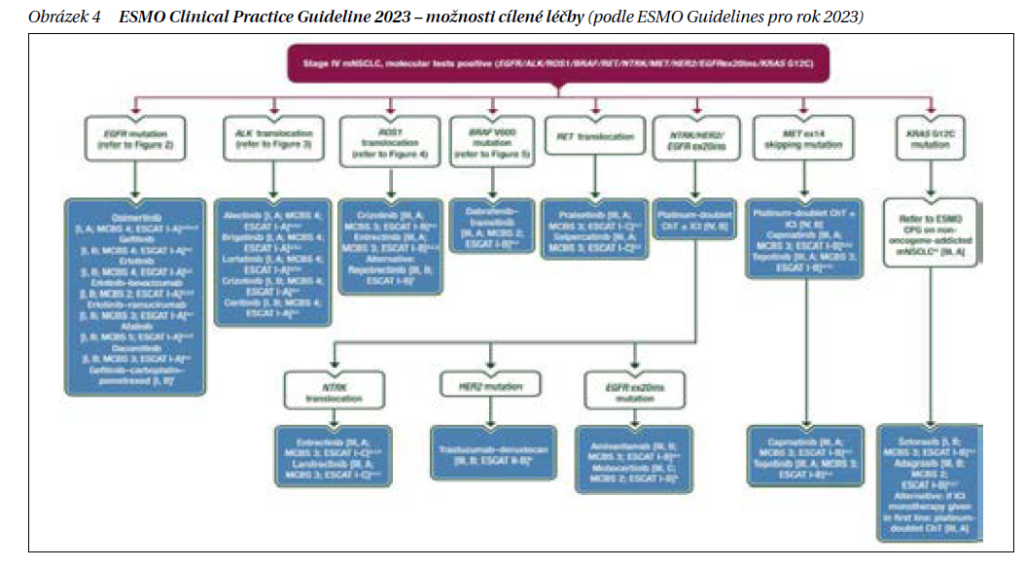
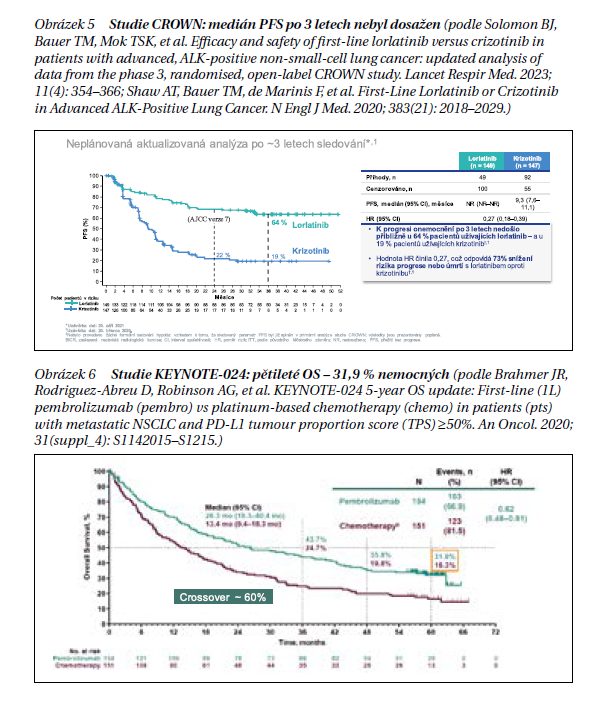
Nepodkročitelným minimem je vyšetření EGFR mutací, přestavby genu ALK a ROS1, aby mohla být co nejdříve zahájena léčba. Možnosti cílené léčby se neustále rozšiřují (obrázek 4) a k detekci příslušných genetických aberací se proto doporučuje vyšetření NGS (next generation sequencing – sekvenování nové generace). I přes počáteční dobrou léčebnou odpověď na cílenou léčbu po čase z důvodu vzniklé rezistence dochází k progresi onemocnění. Jsou proto do klinické praxe zaváděny léky vyšších generací, jako je osimertinib při prokázené EGFR mutaci, alektinib při fúzi genu ALK, entrektinib při fúzi genu ROS1. Nejnověji je k léčbě 1. linie schválen EMA ALK inhibitor 3. generace lorlatinib na základě výsledků studie CROWN. Medián přežití bez progrese (PFS) po 3 letech sledování nebyl dosažen u lorlatinibu a byl 9,3 měsíců (7,6–11,1) u krizotinibu (HR 0,27 [95% CI 0,18–0,39]). Tříleté přežití bez progrese bylo 64 % (95% CI 55–71) ve skupině s lorlatinibem a 19 % (12–27) ve skupině krizotinibu. U pacientů s výchozími mozkovými metastázami (n = 37 lorlatinib; n = 39 krizotinib) bylo HR pro čas do intrakraniální progrese u lorlatinibu oproti krizotinibu 0,10 (95% CI 0,04–0,27); u pacientů bez výchozích mozkových metastáz (n = 112 lorlatinib; n = 108 krizotinib) bylo HR 0,02 (95% CI 0,002–0,14). U pacientů bez mozkových metastáz měl intrakraniální progresi jeden (1 %) ve skupině s lorlatinibem a 25 (23 %) ve skupině s krizotinibem.
Trastuzumab deruxtekan (T-DXd) je první konjugát protilátka-lék (ADC) schválený v říjnu 2023 agenturou EMA pro léčbu dospělých pacientů s pokročilým NSCLC, jejichž nádory mají aktivační mutaci HER2 (ERBB2) a jejichž stav vyžaduje systémovou léčbu po chemoterapii na bázi platiny s imunoterapií, nebo bez ní na základě výsledků studie DESTINY-Lung02.
V případě, že léčebně ovlivnitelné genetické aberace nejsou prokázány, je standardem léčby imunoterapie. V monoterapii v 1. linii léčby u pacientů s vysokou expresí PD-L1 TPS ≥ 50 % prokázal svoji účinnost pembrolizumab (obrázek 5, 6) a atezolizumab. Jako další v této indikaci byl FDA i EMA schválen na základě výsledků studie EMPOWER-Lung 01 cemiplimab, další protilátka proti PD-1, a to nejen pro léčbu metastatického NSCLC, ale také lokálně pokročilého NSCLC nevhodného pro chirurgickou resekci nebo definitivní chemoradiaci.
U pacientů s expresí PD-L1 0–49 % je standardem léčby kombinace imunoterapie a chemoterapie. Jako první svoji účinnost prokázala kombinace pembrolizumabu s chemoterapií podle histologického typu (neskvamózní – karbo/cisplatina + pemetrexed, skvamózní – karboplatina + paklitaxel/nabpaklitaxel). Dále pak u neskvamózní histologie kombinace atezololizumab + karboplatina + paklitaxel + bevacizumab nebo atezolizumab + karboplatina + nabpaklitaxel. Nejnověji pak byla schválena kombinace imunoterapie nivolumab + ipilimumab (protilátek anti-PD-1 a anti-CTL-A4) a chemoterapie podle histologie na základě výsledků studie fáze III CheckMate 9LA.
Léčba extenzivního stadia SCLC
Jako první účinnost imunoterapie, anti-PD-L1 protilátky atezolizumabu,v 1. linii léčby ES-SCLC prokázala studie fáze III IMpower 133, jejíž výsledky byly publikovány již v roce 2018. Porovnávala účinnost kombinované léčby atezolizumab + etopozid + karboplatina vs. etopozid + karboplatina + placebo. Medián OS byl v rameni s atezolizumabem 12,3 vs. 10,3 měsíce, HR 0,70 (95% Cl 0,54–0,91; p = 0,0069). Medián PFS byl 5,2 vs. 4,3 měsíce, HR 0,77 (95% CI 0,62–0,96; p = 0,017).
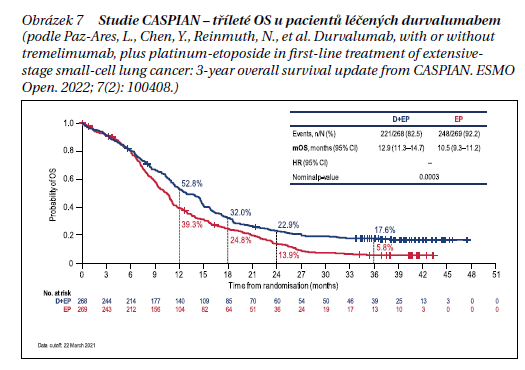
Standardem léčby ES-SCLC je již také další anti-PD-L1 protilátka, durvalumab, jejíž účinnost v 1. linii léčby byla hodnocena ve studii fáze III CASPIAN. Po cca 3 letech sledování pacientů (DCO 27. března 2021; medián sledování 39,4 měsíce) kombinace durvalumabu s chemoterapií nadále vykazovala zlepšení OS oproti samotné chemoterapii: HR = 0,71 (95% CI 0,60–0,86; p = 0,0003). Medián OS činil 12,9 vs. 10,5 měsíce; četnost OS ve 24 měsících 22,9 vs. 13,9 % a 17,6 vs. 5,8 % ve 36 měsících v rameni s durvalumabem + chemoterapií vs. samotná chemoterapie (obrázek 7).
Závěr
Pokrok v léčbě karcinomu plic během poslední dekády je výrazný. Z řady studií máme již data pětiletého přežití u pacientů s NSCLC, a můžeme tak mnohdy mluvit o chronickém průběhu onemocnění.Nejaktuálnějším tématem je multidisciplinární přístup k léčbě časných, operabilních stadií, kde perioperační chemoimunoterapie podle výsledků studií může vést k poklesu rizika recidivy onemocnění. Rozšiřují se možnosti cílené léčby a vzhledem k tomu, že u této léčby musíme počítat se vznikem rezistence, je patrná snaha o její překonání zaváděním léků vyšších generací do klinické praxe a rovněž cílit léčbu na prokázané mechanizmy rezistence.
MUDr. Leona Koubková
Pneumologická klinika 2. LF UK a FN v Motole
