Maligní melanom patří mezi zhoubné kožní nádory s největší úmrtností. Většina pacientů má stanovenu diagnózu ve fázi lokalizovaného stadia, které bývá velice úspěšně léčeno chirurgicky. Pokročilý melanom (metastazující neresekovatelný) je fáze onemocnění, kdy nádorové buňky unikají z imunologického dohledu, chirurgická léčba je neúčinná a ve většině případů i neproveditelná. V minulosti v léčbě pokročilého melanomu dominovala chemoterapie s nevalným efektem (dakarbazin, 5-flurouracil, vinka alkaloidy aj.). Revoluci v tomto odvětví způsobila imunoterapie, cílená léčba a kombinace těchto léčebných modalit.
Každým rokem vzrůstá incidence primárního kožního melanomu, který patří mezi hlavní příčinu úmrtí na zhoubná nádorová kožní onemocnění (obrázek 1). Progrese onemocnění je dána vysokou mutační náloží tumoru a závisí na imunitním systému daného jedince, zda je schopen rozpoznat a zlikvidovat růst a metastazování. Problémem v léčbě maligního melanomu je jeho heterogenita, a proto je nutné vedle histologických a imunohistochemických charakteristik nádorových buněk rozšířit panel vyšetření i na molekulárněgenetické.
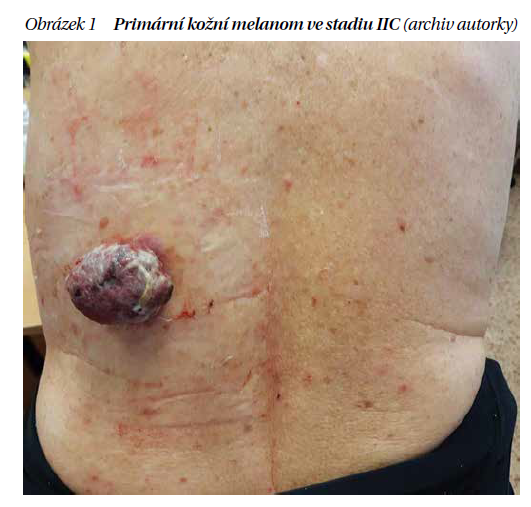
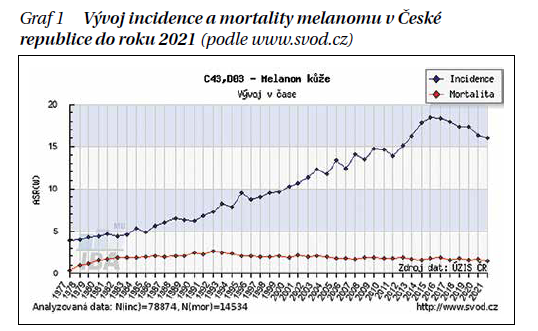
Zařazení pacienta do klinického stadia nám pomáhá ke stanovení prognózy pacienta. Vycházíme z tloušťky nádoru podle Breslowa, ulcerace primárního tumoru, z postižení lymfatických uzlin a z přítomnosti vzdálených metastáz (TNM klasifikace). Prognóza se rapidně zhoršuje s tloušťkou nádoru a při metastazování. Pětileté přežití u pacientů s maligním melanomem do 1 mm tloušťky je více než 95 %, zato ve stadiu IIIC je to 40 %. Celosvětově i v ČR přibývá melanomů ve stadiu 0–IA, těch je okolo 70 % případů. Tento pozitivní trend je dán primární prevencí a zpřesněním diagnostiky na úrovni klinické i histopatologické. Počet úmrtí na maligní melanom se nezvyšuje, ale bohužel se také výrazně nesnižuje (graf 1).
Chirurgická léčba
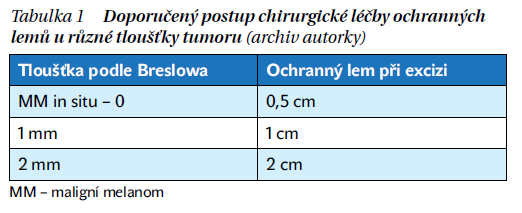
Základním standardem léčby je chirurgické odstranění primárního ložiska s dostatečným ochranným lemem (tabulka 1). Hranice indikace operace sentinelové uzliny je stanovena na tloušťku tumoru větší než 0,8 mm, a dokonce je doporučováno zvážit indikaci i u tenčích melanomů než 0,8 mm s ulcerací.
Lymfadenektomieje dalším chirurgickým zákrokem, který je indikován při šíření nádoru lymfogenně. Elektivní lymfadenektomie byla v minulosti indikována u pacientů s pozitivní sentinelovou uzlinou, ale v randomizovaných kontrolovaných studiích se zjistilo, že tento zákrok není statisticky významným krokem zlepšujícím celkové přežití pacienta. Nové trendy tedy zpřesňují diagnostiku sentinelové uzliny, zaměřují se na popis velikosti, množství a uložení mikrometastáz v sentinelové uzlině a podle toho rozčleňují dále tuto skupinu pacientů na ty, kteří by z elektivní lymfadenektomie profitovali.
Terapeutická lymfadenektomie se provádí v případě klinické evidence lymfogenního metastazování, tzn. cytologickým nebo histologickým potvrzením metastáz, a u pacientů s klinicky jasnými příznaky metastáz v lymfatických uzlinách (klinické vyšetření a USG nebo CT, MR, PET). O adjuvantní radioterapii po lymfadenektomii se uvažuje v případě, že je kontraindikována systémová adjuvantní terapie nebo jsou postiženy více než 3 uzliny, došlo k perforaci pouzdra anebo když metastázy v uzlinách jsou větší než 3 cm. Použití radioterapie v léčbě maligního melanomu se ubírá směrem paliativním. Není totiž jednoznačně potvrzen pozitivní vliv pooperační adjuvantní radioterapie na celkové přežití pacienta.
Systémová léčba
Revoluci v léčbě metastazujícího a neresekovatelného maligního melanomu způsobilo zavedení tzv. cílené léčby BRAF/MEK inhibitory a léčby inhibitory kontrolních bodů imunitní reakce, a to inhibitory anti-PD-1 (programmed cell death protein-1) a CTLA-4 (cytotoxic T lymphocyte-associated antigen-4).
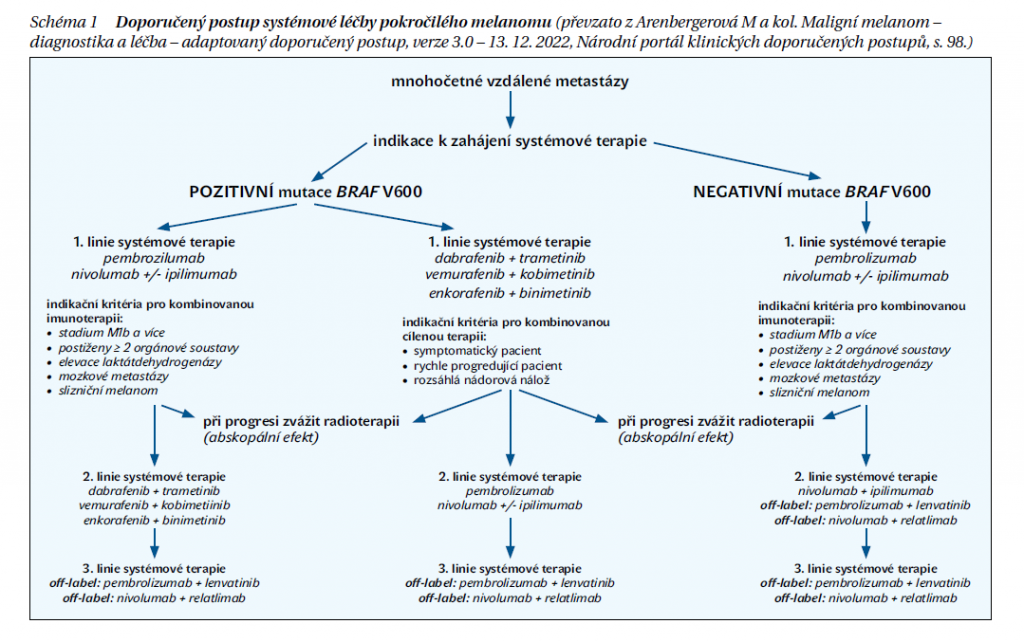
Tato dvě základní ramena systémové léčby mají svá indikační kritéria, v případě cílené léčby je to zjištění mutace genu BRAF v kodonu 600, která se vyskytuje cca u 50 % kožních melanomů. Naproti tomu význam vyšetření PD-L1 (ligand membránového proteinu programované buněčné smrti) u pacientů indikovaných k imunoterapii např. anti-PD-L1 je nejednoznačný a jako prediktivní biomarker se v klinických studiích nepotvrdil, proto se rutinně u maligního melanomu nevyšetřuje. Schéma 1 shrnuje současné doporučené postupy systémové léčby pokročilého melanomu.
Cílem adjuvantní systémové léčby je prodloužit celkovou dobu přežití pacienta. Dalším ukazatelem úspěšnosti léčby je přežití bez relapsu onemocnění. Adjuvantní systémová léčba je indikována u pacientů ve stadiu onemocnění IIIA–IIID (lokoregionální lymfatické metastázy) a ve IV. stadiu (vzdálené metastázy) po chirurgickém odstranění. Nově lze zvažovat léčbu převážně inhibitory PD-L1 u vysoce rizikových pacientů ve stadiu IIB a IIC.
Imunoterapie
Anti-PD-1 imunoterapie
Pembrolizumab a nivolumab jsou humanizované monoklonální protilátky zacílené proti inhibičnímu koreceptoru PD-1. Aktivita inhibičního koreceptoru PD-1 je hlavním faktorem imunologické rezistence v nádorovém mikroprostředí.
Obě látky jsou schváleny pro adjuvantní léčbu melanomu a léčbu pokročilého neresekovatelného nebo metastazujícího melanomu, pembrolizumab v dávkách 200 mg à 3 týdny nebo 400 mg à 6 týdnů i. v. Nivolumab se v monoterapii užívá intravenózně v dávce 240 mg à 2 týdny nebo 480 mg à 4 týdny. V kombinaci s ipilimumabem je doporučováno dávkování nivolumabu 1 mg/kg těl. hm. následováno ipilimumabem 3 mg/kg těl. hm. à 3 týdny ve 4 sériích a poté pokračováno nivolumabem v monoterapii.
Efekt léčby pembrolizumabem byl prokázán v různých multicentrických randomizovaných studiích (Keynote – 001, Keynote – 006, Keynote – 002). Výsledky konečného hodnocení ukázaly, že pembrolizumab ve srovnání s ipilimumabem významně zlepšil přežití bez progrese (PFS), celkovou dobu přežití (OS) a zvýšil četnost objektivních odpovědí na léčbu (ORR). Odpověď na léčbu byla dlouhodobá, u cca 70 % respondérů delší než 16 měsíců.
Účinnost pembrolizumabu v adjuvantní terapii byla prokázána ve studii Keynote – 54, kde hlavním ukazatelem byla doba přežití bez relapsu (recurrence-free survival – RFS) a byl zaznamenán signifikantní rozdíl ve skupině léčených pembrolizumabem oproti placebu. Další studie pacientů ve stadiu IIB–IIC stále probíhají.
Nivolumab byl testován v různých multicentrických studiích, např. CHECKMATE-066. Studie prokázala statisticky významný rozdíl v celkové době přežívání pacientů i lepší bezpečnost léčby nivolumabem oproti dakarbazinu. V režimu adjuvantní terapie byla sledována účinnost léčby nivolumabem proti ipilimumabu (CHECKMATE-238), kde byl signifikantní rozdíl v době přežití bez relapsu ve prospěch nivolumabu.
Toxicita anti-PD-1 imunoterapie
Svou povahou účinku mohou anti-PD-1 způsobit rozvoj imunitní odpovědi, tzv. s imunitou souvisejících nežádoucích účinků (irAE-immune-related adverse events). Z nežádoucích účinků anti-PD-1 byly nejvíce zaznamenány únavový syndrom (28 %) a hyperglykemie (45 %). Nejčastější s imunitou spojené nežádoucí účinky jsou kožní, gastrointestinální, endokrinní, jaterní a plicní. Jako nežádoucí reakce tíže 3–4 byla popsána kolitida, pneumonitida, zvýšení ALT, AST, zvýšení lipázy, hypotyreóza, hypertyreóza a hypofyzitida. Na rozdíl od chemoterapie nemá imunoterapie hematotoxický efekt.
Anti-CTLA-4 imunoterapie
Ipilimumab je plně humánní monoklonální protilátka namířená proti inhibičnímu koreceptoru CTLA-4, který je exprimován na povrchu T buněk. Zablokováním tohoto receptoru se ovlivní funkce regulačních a efektorových T lymfocytů ve smyslu aktivace a růstu, a to hlavně cytotoxických T lymfocytů. Tím dojde ke zvýšení klinicky významné protinádorové imunity.
Je prokázán jeho účinek v dávce 3 mg/kg těl. hm. à 3 týdny, celkem ve 4 sériích v různých randomizovaných studiích. Stěžejní studií fáze III byla MDX010-20 se 676 pacienty s minimálně jednou předcházející systémovou léčbou se 3 rameny studie. Primárním cílem hodnocení byla celková doba přežití. Léčba ipilimumabem v monoterapii byla nejúčinnější. Relativní počty pacientů přežívajících 2 a 3 roky byly nejvyšší ve skupině pacientů léčených ipilimumabem samotným (25 % / 25 %).
Ipilimumab byl studován i jako adjuvantní imunoterapie v monoterapii proti placebu. Ten byl podáván v dávce 10 mg/kg těl. hm. à 3 týdny ve 4 sériích a poté à 3 měsíce po dobu 3 let. Doba přežití bez relapsu (RFS) byla signifikantně vyšší u ipilimumabu (snížení rizika relapsu o 24 %). Stejně tak došlo ke snížení rizika vzniku vzdálených metastáz o 24 % (DMFS) a rizika úmrtí o 28 %, ale 52 % pacientů studii přerušilo kvůli nežádoucím účinkům.
Toxicita anti-CTLA-4 imunoterapie
Co se týče nežádoucích účinků, 41 % pacientů trpělo únavovým syndromem, následoval průjem v 32 % a pruritus v 31 % případů. V porovnání toxicity anti-PD-1 a anti-CTLA-4 je spektrum nežádoucích účinků podobné, ale frekvence a závažnost byly pozorovány výrazně vyšší u ipilimumabu.
Kombinovaná imunoterapie
Dalším krokem studia účinnosti imunoterapie bylo zkoumání duální blokády imunitních kontrolních bodů. Studie fáze III – CA209-067 – zjistila větší účinnost léčby ipilimumabem s nivolumabem oproti monoterapii nivolumabem nebo monoterapii ipilimumabem u dosud neléčených pacientů s a bez mutace BRAF V600. Hlavním cílem bylo zkoumat dobu přežití bez progrese onemocnění (PFS). U kombinované léčby bylo PFS 11,5 měsíce, u ipilimumabu samotného 2,9 měsíce a u samotného nivolumabu 6,9 měsíce. Medián celkového přežití (OS) u kombinace dosahoval 72,1 měsíce, u monoterapie nivolumabem 36,9 měsíce a u monoterapie ipilimumabem 19,9 měsíce. Nežádoucí účinky st. 3–4 byly pozorovány u 16,3 % ve skupině pacientů léčených nivolumabem, 55 % u kombinované léčby a 27,3 % u monoterapie ipilimumabem.
Cílená léčba
Serin/treonin kináza BRAF je nepostradatelnou součástí hlavní signální cesty MAPK (mitogen-activated protein kinase) s následnou aktivací ERK signální cesty. Mutace BRAF genu způsobuje konstitutivní expresi a aktivitu BRAF kinázy, ta je odpovědná za aktivaci MEK kinázy, což má za následek setrvalou aktivitu hlavní proliferační signální dráhy MAPK. Úskalím léčby BRAF inhibitory se ukázal relativně rychlý rozvoj rezistence, vedoucí k relapsu onemocnění. Tento problém se alespoň částečně vyřešil kombinovanou léčbou s MEK inhibitory. V současné době jsou k léčbě pokročilého inoperabilního nebo metastazujícího melanomu s mutovaným BRAF V600 doporučeny kombinace cílené léčby BRAF a MEK inhibitory. Metaanalýza 16 randomizovaných studií s BRAF a/nebo MEK inhibitory potvrdila lepší efekt cílené léčby v kombinaci než v monoterapii, a to v celkové době přežití a v přežití bez progrese onemocnění.
Dabrafenib + trametinib
Kombinace dabrafenib 150 mg 2× denně a trametinib 2 mg 1× denně je indikována k léčbě pokročilého melanomu, ale i k adjuvantní léčbě melanomu s BRAF mutací. Dvě největší studie (COMBI-d a COMBI-v) prokázaly účinnost kombinace proti monoterapii dabrafenibem i proti monoterapii vemurafenibem, a to v celkové době přežití i době bez progrese onemocnění. V adjuvantní terapii kombinací ve studii COMBI-AD proti placebo u pacientů ve stadiu III byl statisticky významný rozdíl mezi oběma skupinami v době přežití bez relapsu onemocnění. Nežádoucí účinky byly pozorovány v 55 %, únavový syndrom v 51 % a nauzea v 45 % případů.
Vemurafenib + kobimetinib
Kombinace vemurafenibu 960 mg 2× denně p. o. a kobinetimibu 60 mg 1× denně p. o. proti monoterapii vemurafenibem byla porovnávána ve studii fáze III coBRIM. Zde bylo dosaženo 5letého přežití bez relapsu (RFS) u 14 % a celkového přežití (OS) u 31 % u kombinované léčby oproti 10 % (RFS) a 26 % (OS) u monoterapie.
Enkorafenib + binimetinib
Kombinace enkorafenibu 450 mg 1× denně p. o. a binimetinibu 45 mg 2× denně byla úspěšně testována ve studii Columbus u pacientů s metastazujícím a s BRAF mutovaným neresekovatelným maligním melanomem. Byl zaznamenán statisticky významný rozdíl v RFS i OS u kombinace oproti monoterapii ekorafenibem a monoterapii vemurafenibem. Nežádoucí účinky byly únava, nauzea diarea, artralgie, zvýšení hladiny kreatinkinázy, bolesti hlavy, zácpa, astenie a pyrexie. Celkem 12–14 % pacientů ukončilo terapii pro nežádoucí účinky léčby.
Sekvenční léčba
Sekvenční léčba kombinace imunoterapie s cílenou léčbou pro pacienty s BRAF mutovaným melanomem je logický směr dalšího zefektivnění systémové léčby. Vzhledem k tomu, že je možný vznik rezistence na obě ramena systémové léčby, je testována ve studiích fáze III (DREAMseq) kombinace ipilimumab + nivolumab po předchozí léčbě kombinací dabranefib + trametinib a opačně u pacientů s pokročilým melanomem s BRAF mutací. Další studie fáze II ImmunoCobiVem zkoumá efekt atezolizumabu proti vemurafenibu + kobimetinibu po 3měsíční předchozí léčbě vemurafenibem + kobimetinibem. Probíhá též další studie fáze II se sekvenční léčbou ipilimumabem s nivolumabem po léčbě enkorafenibem s binimetinibem a opačně (enkorafenibem + binmetibnibem po ipilimumabu s nivolumabem).
Nová experimentální léčba
Vývoj vakcín (talimogene laherparepvec: T-VEC) a použití cytokinů (darleukin, bempegaldesleukin), inhibitorů různých růstových faktorů (bevacizumab, pexidartinib, emactuzumab, epacadostat) nebo použití agonistů Toll-like receptorů jsou v různé fázi výzkumů, některé už v kombinaci s imunoterapií i v klinických studiích fáze III s různými výsledky.
Závěr
Současná úroveň znalostí patogeneze maligního melanomu dává dobrý základ vývoje selektivní a efektivní systémové léčby, a to především u pacientů s metastazujícím neresekovatelným melanomem. Specifika maligního melanomu tkví ve vysoké mutační náloži a ve schopnosti nádorových buněk ovlivnit svoje mikroprostředí natolik, že nádor uniká z imunologického dohledu organizmu a má velký potenciál metastazování (nádorová imunoeditace). Za poslední desetiletí se léčba a přežití pacienta s pokročilým melanomem dramaticky zlepšila, a to díky nové systémové léčbě cílené BRAF a MEK inhibitory a inhibitory kontrolních bodů imunitní reakce (PD-1, CTLA-4) a jejich kombinaci. Vývoj nových léků a vakcín jde stále dopředu a jejich zavedení do denní praxe je podmíněno rozsáhlými klinickými studiemi zaměřujícími se na efektivnost a bezpečnost. Nový směr se rýsuje v použití systémové léčby v režimu adjuvantním a neoadjuvantním a dále v kombinaci a sekvenční terapii léků různých modalit. Stále však platí, že včasná diagnostika a chirurgická léčba primárního kožního tumoru jsou neúčinnější prevencí a léčbou předcházející rozvoji pokročilého melanomu.
MUDr. Barbora Divišová, Ph.D.
Dermatovenerologická klinika LF UK a FN Plzeň
