Jednou z možností, jak zlepšit léčebné výsledky pacientů s metastatickým kastračně rezistentním karcinomem prostaty (mCRPC), je zavedení nových skupin léků do léčebného algoritmu onemocnění. Řadíme sem i takzvané PARP [poly(ADP-ribóza)polymeráza] inhibitory. Mechanizmus terapie PARP inhibitory spočívá v inhibici enzymů, které opravují poškozenou DNA. Mutace v genech opravujících DNA se vyskytují u karcinomu prostaty v 11–33 %, nejčastěji je zastoupena mutace v genu BRCA2 (5,3 %). Nejvíce dat u pacientů s mCRPC máme k dispozici s PARP inhibitorem olaparibem a talazoparibem.
Systémová léčba metastatického kastračně rezistentního karcinomu prostaty (mCRPC) se postupně vyvíjela od roku 2004 se zavedením docetaxelu do klinické praxe. Většina pacientů je v dnešní době léčena v první linií mCRPC pomocí léků cílených na androgenní receptor (androgen receptor targeted agents – ARTA) abirateronem nebo enzalutamidem. Důvodem je časnější diagnostika mCRPC, kdy většina pacientů je ve stadiu asymptomatickém či mírně symptomatickém. I přes dosažení léčebné odpovědi postupně dochází k progresi onemocnění a celkové přežití (OS) pacientů je limitováno přibližně 3 roky. Hledají se proto další možnosti, jak zlepšit léčebné výsledky pacientů s mCRPC. K léčebným posunům patří v současnosti právě zavedení PARP inhibitorů.
Olaparib
Olaparib je účinným inhibitorem skupiny enzymů PARP1-3. Prokázal účinek u řady maligních onemocnění v rámci preklinických studií. Může být indikován jednak jako monoterapie, jednak i v kombinaci s jinou onkologickou léčbou. První indikací v ČR bylo jeho užití u pacientek s karcinomem ovaria či prsů. Většinou je vyžadováno stanovení germinální či somatické BRCA1 nebo 2 mutace. Další diagnózou, kde byl účinek olaparibu zkoumán, je i karcinom prostaty. U této diagnózy je aktuálně v ČR olaparib indikován jako monoterapie k léčbě mCRPC pacientů s germinální a/nebo somatickou mutací BRCA1/2, u kterých došlo k progresi po předchozí léčbě zahrnující nový hormonální léčivý přípravek a nově také jako kombinace s abirateronem a prednisonem nebo prednisolonem k léčbě dospělých pacientů s mCRPC, u nichž není klinicky indikována chemoterapie, a to bez ohledu na status biomarkerů.
V roce 2020 byla publikována klinická studie 3. fáze PROfound, která hodnotila účinek olaparibu u pacientů s mCRPC po předchozí terapii ARTA. Nemocní museli mít genetickou alteraci genů podílejících se přímo nebo nepřímo na DNA opravě pomocí homologní rekombinace. Patřila sem alterace genů BRCA1, BRCA2 nebo ATM (kohorta A – 245 pacientů) nebo změny v dalších genech (kohorta B – 142 pacientů). Pacienti byli randomizováni v poměru 2 : 1 k podání olaparibu (300 mg 2×) nebo ARTA (abirateron 1 000 mg/den + prednison 5 mg 2× denně nebo enzalutamid 160 mg/den). Primárním cílem bylo zhodnocení přežití bez známek progrese pomocí zobrazovacích vyšetření (ibPFS) v kohortě pacientů A. Podání olaparibu významně prodloužilo v kohortě A ibPFS (7,4 vs. 3,6 měsíce; HR 0,34, 95% CI 0,25–0,47, obrázek 1), jakož i významně prodloužilo OS (18,5 vs. 15,1 měsíce; HR 0,64, 95% CI 0,43–0,97). Podobně podání olaparibu mělo významný vliv i v rámci hodnocení dalších cílů klinické studie jako vyšší počet celkové léčebné odpovědi či prodloužení doby do objevení bolesti. Medián ibPFS či OS byly významně prodlouženy u pacientů léčených olaparibem i v rámci celé populace (kohorta A + B). V rámci podskupinové analýzy byl prokázán benefit olaparibu na snížení rizika smrti či progrese bez ohledu na věk, lokalizaci metastatického postižení, předchozí podání chemoterapie, vstupní hodnoty PSA.
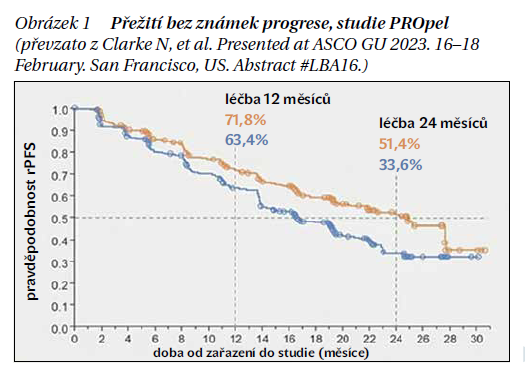
Největší přínos olaparibu v kohortě A byl prokázán u pacientů s BRCA2 mutací (celkem se jednalo o 80 pacientů – 49 % léčených olaparibem v kohortě A). U pacientů léčených olaparibem se vyskytla toxicita stupně 3–4 u 51 % pacientů s 21% výskytem anémie. Mezi další projevy léčby olaparibem patřila nevolnost, zvracení, průjem, únava a jiné. U 11 pacientů byla popsána plicní embolie. Kritika studie se může týkat skutečnosti, že u pacientů v kontrolním ramenu může existovat zkřížená rezistence na další linii ARTA.
Preklinické modely potvrdily protinádorový účinek kombinace PARP inhibitorů s ARTA. Možným důvodem je pozitivní koregulace signalizace pomocí AR nebo inhibice transkripce genů podílejících se na homologní rekombinaci či vliv non-genetických mechanizmů na zvýšení senzitivity k PARP inhibitorům.
V roce 2022 byly publikovány výsledky klinické studie 3. fáze PROpel, která hodnotila kombinaci olaparib + abirateron vs. abirateron + placebo u pacientů léčených první linií mCRPC. Celkem bylo hodnoceno 796 pacientů v poměru 1 : 1, dávkování olaparibu bylo standardní, podobně jako ve studii PROfound. Podstatným rozdílem oproti studii PROfound ovšem bylo, že do studie PROpel byli zařazováni i pacienti bez mutací v genech zapojených do homologní rekombinace (např. BRCA1/2). Studie PROpel tak byla první studie fáze 3, která dokázala vliv PAPR inhibitoru + ARTA u celkové populace. Primárním cílem klinické studie bylo stanovení ibPFS. Do klinické studie byli zahrnuti nemocní převážně vyššího Gleasonova skóre (GS 8–10 u dvou třetin nemocných), nemocní mohli být předléčeni docetaxelem například v případě hormonálně senzitivního onemocnění. Prevalence mutace BRCA1 byla u 2,3 % a BRCA2 u 9,5 % pacientů léčených olaparibem. Kombinace olaparibu a abirateronu významně prodloužila medián ibPFS jak při vyhodnocení investigátory (24,4 vs. 16,6 měsíce; HR 0,66, 95% CI 0,54–0,81), tak při zpracování nezávislými hodnotiteli (27,6 vs. 16,4 měsíce; HR 0,61, 95% CI 0,49–0,74). Benefit byl prokázán u všech definovaných skupin v rámci regresní analýzy. Data pro analýzu OS byla v době prvního čtení nezralá (zralost dat 28,6 %; HR, 0,86; 95% CI, 0,66–1,12; P = 0,29). Nicméně následující čtení dat prezentované na kongresu ASCO GU 2023 ukázalo medián celkového přežití v rameni olaparib + abirateron 42,1 měsíce oproti 34,7 měsíce v rameni placebo + abirateron (HR, 0,81; 95% CI, 0,67–1,00). Léčba kombinací byla dobře tolerovaná, nejčastějšími nežádoucími účinky byly anémie (15,1 % pacientů stupně 3–4), dále únava či nevolnost. Výskyt plicní embolie byl u 6,5 % nemocných léčených kombinací olaparib + abirateron.
Talazoparib
Talazoparib je inhibitor enzymů PARP 1 a 2. Aktuálně v ČR je talazoparib indikován jako monoterapie k léčbě dospělých pacientů se zárodečnými mutacemi BRCA1/2, kteří mají HER2 negativní lokálně pokročilý nebo metastazující karcinom prsu. Účinek monoterapie talazoparibu u pacientů s mCRPC hodnotila klinická studie 2. fáze TALAPRO-1. Zahrnutí pacienti měli detekované alterace v genech podílejících se na homologní rekombinaci DNA. Talazoparib byl podáván v dávce 1 mg/den (0,75 mg/den v případě horších ledvinných funkcí). Při mediánu sledování 16,4 měsíce byla zjištěna celková léčebná odpověď (primární cíl) u 29,8 % pacientů. Mezi nejčastější toxicitu stupně 3–4 patřila anémie (31 %).
Klinická studie 3. fáze TALAPRO-2 hodnotí kombinaci talazoparibu + enzalutamidu u pacientů první linie mCRPC v porovnání s enzalutamidem. Letos na ASCO GU 2023 byla prezentována první analýza této klinické studie. Kombinace významně prodloužila rPFS (nedosaženo vs. 21,9 m; HR 0,63, 95% CI 0,51–0,78), významnější vliv byl u pacientů s alterací v genech podílejících se na homologní rekombinaci DNA (27,9 vs. 16,4 m; HR 0,46, 95% CI 0,3–0,7). Kombinace také prokázala vysoké procento dosažení léčebné odpovědi (61,7 %), z toho 37,5 % kompletních. Mezi nejčastější nežádoucí účinek stupně 3–4 patřila anémie. Data na vliv prodloužené OS zatím nejsou zralá.
Závěr
Léčba mCRPC dosáhla významných pokroků za poslední roky. U pacientů se významně etablovala ARTA terapie, která představuje nejčastější používanou léčbu u těchto pacientů. Dosud se tato léčba indikuje jako monoterapie. Její výhodou je dobrá tolerance, nicméně časem u většiny pacientů dojde k progresi onemocnění. Možností, jak zlepšit účinnost, je kombinace ARTA terapie s novými postupy – inhibitory PARP. Klinické studie toto jasně potvrdily. Důležitým poselstvím je i účinnost u pacientů bez známek mutace v enzymech podílejících se na opravě DNA a relativně bezpečná snášenlivost kombinace. Výhodou kombinace je navíc možnost perorálního podávání. Nadále však nemáme k dispozici jasně v klinické praxi využitelný prediktor jak ARTA, tak i terapie pomocí PARP inhibitorů. Výsledky dalších studií budou potřebné.
Aktuálně je v ČR indikace léku olaparib u karcinomnu prostaty jednak v monoterapii k léčbě dospělých pacientů s germinální a/nebo somatickou mutací BRCA1/2 metastazujícího kastračně rezistentního karcinomu prostaty (mCRPC), u kterých došlo k progresi po předchozí léčbě zahrnující nový hormonální léčivý přípravek, jednak v kombinaci s abirateronem a prednisonem nebo prednisolonem k léčbě dospělých pacientů s mCRPC, u nichž není klinicky indikována chemoterapie.
MUDr. Igor Richter, Ph.D.
Onkologické oddělení, Krajská nemocnice Liberec, a.s.
Onkologická klinika 1. LF UK a FTN Praha
Fakulta zdravotnických studií, Technická univerzita Liberec
doc. MUDr. Josef Dvořák, Ph.D.
Onkologická klinika 1. LF UK a FTN Praha
MUDr. Vladimír Šámal, Ph.D.
Urologické oddělení, Krajská nemocnice Liberec, a.s.
MUDr. Sofya Al-Samsam
Onkologické oddělení, Krajská nemocnice Liberec, a.s.
MUDr. Jiří Bartoš, MBA
Onkologické oddělení, Krajská nemocnice Liberec, a.s.
