Léčba difuzního velkobuněčného B-lymfomu (DLBCL) doznala za poslední dekády značného rozvoje a spektrum terapeutických možností se neustále rozšiřuje. Díky novým znalostem o molekulární patogenezi DLBCL se objevují inovativní léčebné modality, které jsou zaměřeny na rekurentní genetické změny v jednotlivých podtypech DLBCL. Nadále však převažuje přístup založený na cílení univerzálních B-buněčných antigenů.
Incidence lymfomů v České republice má dlouhodobě mírně rostoucí trend s přibližně 1 500 nově diagnostikovanými případy ročně. Větší část tvoří non-hodgkinské lymfomy (NHL), z nichž je na prvním místě difuzní velkobuněčný B-lymfom (DLBCL, 40 % případů B-buněčných NHL). Jedná se o léčitelné onemocnění s 60–70% pravděpodobností úzdravy v první linii léčby pomocí režimu kombinujícího monoklonální protilátku anti-CD20 rituximab a chemoterapeutický režim CHOP (tj. R-CHOP). Tento režim zůstával léčbou volby v posledních 20 letech.
Jak v současnosti léčíme agresivní lymfomy?
Nová data ukazují, že výměna vinkristinu za konjugát monoklonální protilátky a léčiva polatuzumab vedotin (režim Pola-R-CHP, viz níže) signifikantně prodlužuje dobu do progrese, a tento režim tak byl recentně schválen v terapii 1. linie DLBCL. Zbývajících 30–40 % nemocných na terapii dobře nezareaguje nebo dojde k relapsu lymfomu (relabující/refrakterní – R/R), což vede k jejich zkrácenému přežívání.
Ve 2. linii jsou pacienti léčeni tzv. záchrannými (salvage) indukčními chemoimunoterapeutickými režimy, které jsou většinou založeny na platinovém chemoterapeutiku – cisplatině (R-ESHAP, R-DHAP) nebo karboplatině (R-ICE). V rámci následné konsolidace jsou nemocní indikováni k vysokodávkované chemoterapii (přípravný režim BEAM) a autologní transplantaci kostní dřeně (auto-SCT). Nicméně polovina pacientů s R/R DLBCL není ke konsolidaci auto-SCT indikována vzhledem k vyššímu věku, komorbiditám či dalším faktorům. Z pacientů, kteří jsou k auto-SCT indikováni, jich polovina ke konsolidaci nedospěje pro nedostatečnou odpověď na záchranný indukční režim. U části nemocných navíc dojde k relapsu lymfomu i po auto-SCT. Alternativně je ve 2. linii schválena imunoterapie pomocí CAR (chimérický antigenní receptor) T-cell, aktuálně je však vyhrazena zejména pacientům s primárně progredujícím či časně relabujícím, a tedy prognosticky nepříznivým DLBCL. Efektivita a bezpečnostní profil této léčby jsou diskutovány níže. Výběr chemoterapeutických režimů třetí a další léčebné linie se v klinické praxi značně liší a pacienti mají vesměs špatnou prognózu.
Diagnostická kritéria
Diagnóza je založena na histopatologickém vyšetření (morfologickém a imunohistochemickém). Recentně vydaná 5. verze WHO klasifikace zavádí do praxe několik nových podjednotek v rámci diagnózy DLBCL a tuto skupinu mírně reorganizuje na základě nových znalostí o patogenezi lymfoproliferativních chorob. Další navrhovaná klasifikace Evropské asociace pro hematopatologii vydaná v roce 2022 sdílí mnoho podobností s novou WHO klasifikací vydanou v podobné době. Mezi těmito klasifikacemi ale také existuje několik rozdílů.
DLBCL je heterogenní onemocnění. Původní klasifikace DLBCL vycházející z genového expresního profilování podle tzv. buňky původu lymfomu rozlišuje podskupinu vycházející z buněk germinálního centra (GC) a non-GC, která se dále dělí na podtyp ABC („activated B-cell“) a neklasifikovatelných DLBCL. ABC je považován za prognosticky méně příznivý podtyp. K rozlišení těchto podskupin v praxi pomáhá algoritmus podle Hansové založený na imunohistochemické analýze. Nedávno byly publikovány dvě studie zabývající se molekulární klasifikací DLBCL pomocí mutační analýzy. Tyto analýzy rozlišují několik molekulárních podtypů/clusterů DLBCL. Každá z těchto skupin nese určitý soubor rekurentních genetických změn, které by mohly být do budoucna cílem moderní terapie. Nová data také ukazují, že tyto entity se mezi sebou liší nejen v molekulární patogenezi a přítomnosti rekurentních genetických změn, ale také v přežití pacientů při podání režimu R-CHOP.
Léčebné přístupy
Inovativní léčebné možnosti používané v terapii R/R DLBCL zahrnují dva odlišné přístupy – jednak přístup založený na znalosti výše uvedené molekulární patogeneze daného podtypu DLBCL, jednak přístup tzv. agnostický k těmto znalostem (schéma 1). V prvním případě se jedná o léky cílící na konkrétní genetické změny v buňce. Sem řadíme skupinu inhibitorů BTK (ibrutinib, akalabrutinib, zanubrutinib), proteazomů (bortezomib, ixazomib), BCL-2 (venetoklax), XPO-1 (selinexor) nebo EZH2 (tazemetostat). Druhý přístup, který je v současné době využíván častěji, testuje léčiva namířená proti univerzálním B-buněčným povrchovým antigenům (CD19, CD20, CD79b, ROR1, PD-L1), a je tedy potenciálně použitelný pro neselektovanou kohortu pacientů s DLBCL. Mezi tento „agnostický“ model řadíme nejen klasickou chemoterapii a radioterapii, ale také nové monoklonální protilátky (tafasitamab), skupinu konjugátů monoklonálních protilátek a léčiva („antibody-drug conjugates“), imunomodulační léky (lenalidomid) a také imunoterapii založenou na pacientových vlastních T-lymfocytech (checkpoint inhibitory, CAR T-cell terapie a bispecifické protilátky). Zatímco v první linii léčby v současnosti probíhají stále častěji studie založené na molekulární typizaci DLBCL, u pacientů s R/R DLBCL nadále převažuje přístup v léčbě „agnostický“.
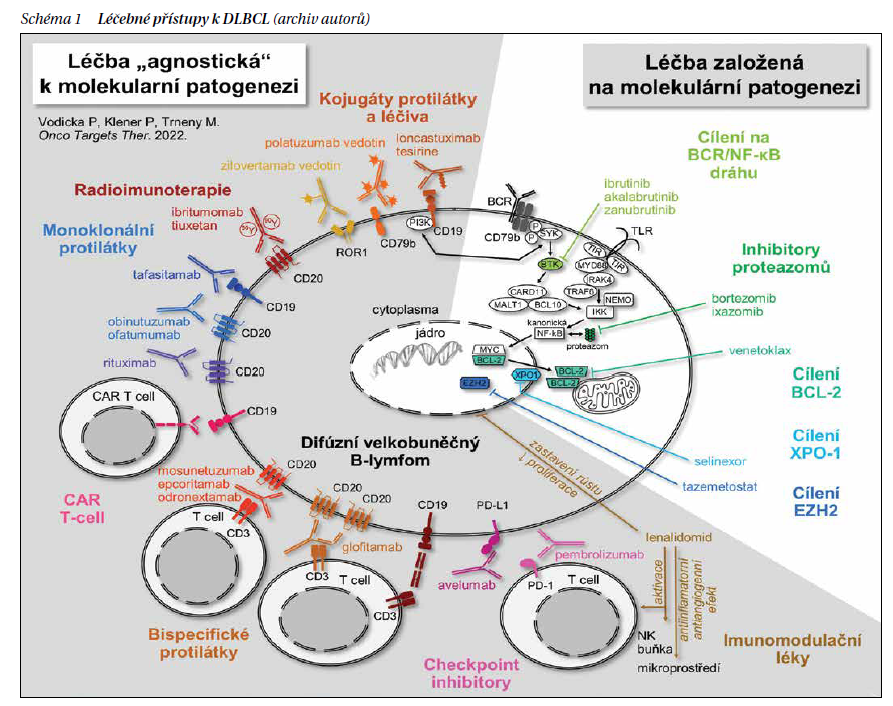
Konjugáty protilátky a léčiva
Mezi konjugáty protilátky a léčiva testovaná u pacientů s DLBCL patří polatuzumab vedotin, zilovertamab vedotin a lonkastuximab tesirin. Polatuzumab vedotin je konjugát monoklonální protilátky anti-CD79b a mikrotubulárního inhibitoru monomethyl auristatinu E. Povrchový antigen CD79b patří mezi součást B-buněčného receptoru, který je exprimován na povrchu většiny B-buněčných NHL. Po navázání polatuzumabu vedotinu na tento antigen dochází k internalizaci komplexu antigen-léčivo. Následně je od tohoto komplexu odděleno cytostatikum auristatin E a přes inhibici mikrotubulů dochází k apoptóze lymfomové buňky. Mechanizmus účinku cytostatika je podobný vinkristinu (součást režimu R-CHOP), ale vzhledem k vazbě na monoklonální protilátku je jistou výhodou polatuzumabu vedotinu přesnější doručení chemoterapeutika do lymfomových buněk.
Polatuzumab vedotin byl testován u pacientů s R/R DLBCL. Díky svému příznivému bezpečnostnímu profilu (mezi nežádoucí účinky patří zejména polyneuropatie) a efektivitě v kombinaci s bendamustinem a rituximabem (Pola-BR) byl tento léčebný režim schválen k léčbě u pacientů s R/R DLBCL v rámci paliativní terapie po minimálně dvou liniích předchozí léčby. Bezpečnost a efektivita režimu Pola-BR byly následně potvrzeny i v reálném světě (včetně České republiky s mírně kratší dobou celkového přežití 5,3–9,0 měsíce) v porovnání s registrační studií. Pro nemocné s R/R DLBCL, pro které není vhodná léčba platinovou chemoterapií a auto-SCT, je v současnosti k dispozici úhrada terapie režimem Pola-BR již ve 2. linii v rámci statusu VILP („vysoce inovativní léčivý přípravek“).
V 1. linii léčby DLBCL byl polatuzumab vedotin testován výměnou za vinkristin v režimu R-CHOP (tj. Pola-R-CHP) u pacientů mezi 18–80 lety v rámci studie fáze III POLARIX. Pacienti zařazení do studie měli balancované vstupní charakteristiky. Tato studie splnila svůj primární cíl – pacienti léčení v experimentálním rameni Pola-R-CHP měli signifikantně prodloužené PFS o 6,5 % v porovnání s kontrolní skupinou léčenou současným standardem R-CHOP (PFS ve 2 letech 77 vs. 70 %), což představuje snížení rizika relapsu o 27 % (hazard ratio 0,73). Profil toxicity experimentální terapie se nelišil od kontrolní kohorty. Přestože nedošlo ke zlepšení celkového přežití pacientů (OS ve 2 letech 89 % v obou kohortách) ani odpovědi na terapii (kompletní remise 78 vs. 74 %), menší počet pacientů vyžadoval následnou terapii. Pola-R-CHP tak má ambici stát se novým standardem v terapii 1. linie DLBCL, otázkou však zůstává nákladová efektivita tohoto léčebného režimu.
Lonkastuximab tesirin je konjugát monoklonální protilátky anti-CD19 a cytostatika pyrrolobenzodiazepinu. Na základě výsledků studie fáze II LOTIS-2 byla tato molekula s relativně dobrým bezpečnostním profilem schválena v monoterapii pacientů s R/R DLBCL. Kombinace lonkastuximab tesirinu s ibrutinibem je nyní zkoušena v klinické praxi (studie LOTIS-3) s vysokou celkovou odpovědí na terapii (57 %) a nízkou incidencí nežádoucích účinků.
Aktivace imunitního systému
Do skupiny léčebných přístupů, které angažují pacientovy vlastní T-lymfocyty, patří imunomodulační léky, immune-checkpoint inhibitory, bispecifické protilátky a CAR T-cell terapie. V léčbě DLBCL došlo v poslední době k největšímu rozvoji dvou posledně jmenovaných skupin.
Bispecifické protilátky
Bispecifické protilátky jsou monoklonální konstrukty, které mají na rozdíl od klasických monoklonálních protilátek, jako je rituximab nebo obinutuzumab, dvě vazebná místa – k navázání lymfomové buňky (CD19, CD20) a T-lymfocytu (CD3). Existuje již několik generací bispecifických protilátek testovaných v klinických studiích u pacientů s DLBCL. Bispecifická protilátka 1. generace blinatumomab je úspěšně používána v léčbě akutní lymfoblastické leukemie, v léčbě R/R DLBCL se však neuplatnila.
Současný koncept směřuje k využití protilátek s inaktivovaným Fc fragmentem, což těmto konstruktům umožňuje delší poločas eliminace a modifikuje jejich účinnost. Příkladem je bispecifická protilátka glofitamab se dvěma vazebnými místy (CD20 a CD3). Tato protilátka byla zkoušena u intenzivně předléčených pacientů s R/R DLBCL s velmi dobrými výsledky (dosažení kompletní remise ve 30 %). Glofitamab je nyní testován ve studiích u pacientů v několika liniích léčby a předpokládá se brzká registrace pro pacienty po selhání dvou předchozích linií léčby. Mezi ostatní protilátky s perspektivními výsledky u pacientů s DLBCL patří mosunetuzumab (schválený v terapii R/R folikulárního lymfomu) a odronextamab. Také tyto bispecifické protilátky jsou nyní zkoušeny v několika klinických studiích v České republice v monoterapii či v kombinaci s chemoterapií nebo cílenými léky (polatuzumab vedotin, lenalidomid apod.). Dosud nejnadějnější výsledky stran efektivity a bezpečnosti přináší terapie bispecifickou protilátkou epcoritamab, jejíž nespornou výhodou je mimo jiné možnost podkožního podání.
CAR T-cell terapie
CAR T-cell terapie je založena na genetické modifikaci pacientových vlastních T-lymfocytů a jejich „vyškolení“ v boji proti lymfomovým buňkám. Výrobní proces začíná separací pacientových T-lymfocytů a jejich následné in vitro úpravě, kdy je do buněk nejčastěji virovým vektorem vpraven gen kódující CAR. Tato úprava dodává modifikovaným T-lymfocytům specificitu proti cílovému antigenu na povrchu nádorových buněk (nejčastěji CD19) a zároveň také ovlivňuje jejich aktivaci a proliferační schopnost. V léčbě DLBCL jsou používány tři CAR T-cell produkty, které se liší výrobním procesem a také efektivitou: axikabtagen ciloleucel (axi-cel), lisokabtagen maraleucel (liso-cel, schválen tč. pouze v USA) a tisagenlekleucel (tisa-cel). Léčba pomocí těchto konstruktů byla schválena na základě registračních studií. Ty prokázaly přibližně u poloviny pacientů s R/R DLBCL dosažení trvalé remise onemocnění a prodloužení přežití ve srovnání s historickými daty. Zároveň se bezpečnostní profil terapie ukázal jako uspokojivý (mezi nejčastější nežádoucí účinky patří syndrom z uvolnění cytokinů a neurotoxicita).
Nedávno publikované randomizované studie testovaly účinnost CAR T-cell produktů ve 2. linii u pacientů s primárně progredujícím nebo časně relabujícím DLBCL do 12 měsíců od ukončení terapie, tedy u pacientů s prognosticky nepříznivým onemocněním. Primárním cílem všech tří studií byl event-free survival (EFS, tj. přežití od randomizace do události – úmrtí, změna terapie, nedosažení odpovědi či progrese). Dvě ze tří studií prokázaly signifikantně vyšší efektivitu CAR T-cell v porovnání se současným léčebným standardem – záchrannou chemoterapií platinovým režimem s následnou konsolidací pomocí vysokodávkované chemoterapie a auto-SCT. Jednalo se o studii ZUMA-7 testující axi-cel (medián EFS 8,3 vs. 2,0 měsíce) a TRANSFORM zkoušející liso-cel (medián EFS 10,1 vs. 2,3 měsíce). Studie BELINDA s produktem tisa-cel neprokázala signifikantní rozdíl v EFS u nemocných s DLBCL ve 2. linii terapie (medián EFS 3 měsíce pro obě kohorty). Důvody, proč studie BELINDA jako jediná nesplnila stanovený primární cíl EFS, nejsou zcela jasné. V této studii bylo povoleno podání přemosťující terapie v období přípravy CAR T-cell, což mohlo vést k náboru agresivnějších relapsů vyžadujících terapii akutně. Delší čas přípravy buněčného produktu, nižší účinnost tisa-cel a také jiná definice primárního cíle EFS jsou dalšími možnými příčinami selhání této studie. Výše uvedené studie prokázaly, že pacienti s časným relapsem DLBCL, a tedy i horší prognózou, profitují z CAR T-cell ve druhé linii léčby v porovnání se současným standardem záchranné terapie, přestože nedošlo ke zlepšení celkového přežití pacientů.
V současné době je léčba pomocí CAR T-cell schválena a zavedena do klinické praxe pro nemocné po selhání dvou a více linií léčby. Největším posunem je v současnosti schválení této inovativní terapie i ve 2. linii u pacientů s primárně progredujícím či časně relabujícím DLBCL.
Nevýhodou CAR T-cell terapie je jistě délka přípravy produktu, která se pohybuje mezi 30 a 60 dny. To nezřídka vyžaduje použití přemosťující terapie během výroby produktu. Jistou nadějí v tomto směru je testování nového typu CAR T-cell produktu se zkrácenou výrobní dobou a možností podání přibližně do 1 týdne od sběru. Mezi další nevýhody CAR T-cell terapie patří nutná přítomnost viabilních T-lymfocytů v čase separace a také finanční náklady léčby. Také existuje minimum dat o efektivitě léčebných modalit po selhání CAR T-cell terapie. Naproti tomu bispecifické protilátky mohou být použity tzv. off-the-shelf, jejich dodání pacientovi je tedy jednodušší a rychlejší. Nicméně určitou nevýhodou je nutnost delší infuzní doby a také závislost na pacientových funkčních T-lymfocytech v době infuze. Obdobně jako u CAR T-cell bylo dosud publikováno minimum informací o možnostech léčby po selhání terapie bispecifickou protilátkou a léčba těchto nemocných nyní patří mezi největší výzvy na poli klinického výzkumu DLBCL.
Imunomodulační léky
Imunomodulační přípravek lenalidomid, používaný mimo jiné v terapii plazmocytárního myelomu a folikulárního lymfomu, byl testován u pacientů s R/R DLBCL v kombinaci s rituximabem („R2“ režim). Tento „chemo-free“ režim může být alternativou u nemocných, kteří nejsou schopni tolerovat intenzivnější chemoterapii. V první linii léčby byl lenalidomid testován s režimem R-CHOP v randomizované studii ROBUST u ABC podtypu DLBCL. V této studii nebyl prokázán benefit přidání lenalidomidu ke standardní chemoterapii. Z kombinace R-CHOP + lenalidomid však mohou profitovat pacienti s lymfomem s přestavbou genu MYC (lenalidomid je down-regulátorem exprese genu MYC), jak bylo prokázáno ve fázi II studie HOVON. Zajímavé výsledky přinesla studie SMART Start, která testovala chemo-free režim lenalidomid + ibrutinib + rituximab u pacientů s non-GC DLBCL. Tito pacienti byli léčeni dvěma cykly výše uvedené kombinace, následované režimem CHOP či EPOCH s vynikajícími výsledky (PFS 93 % v 1 roce). Tento režim otevřel diskuzi o potenciálním zavedení režimů obsahujících pouze cílenou terapii do klinické praxe.
Synergický protinádorový efekt byl pozorován při kombinování lenalidomidu s protilátkou tafasitamab. Tafasitamab je humanizovaná anti-CD19 protilátka vykazující zvýšenou aktivitu na protilátkách závislé buněčné toxicity a fagocytózy. Tato molekula byla testována v rámci studie fáze II L-MIND v kombinaci s lenalidomidem u pacientů s R/R DLBCL neindikovaných k auto-SCT. Kombinace tafasitamab a lenalidomid vedla k trvalým odpovědím na terapii s tolerabilním profilem toxicity. Následná studie fáze Ib First-MIND zkoušela kombinaci tafasitamab + lenalidomid + R-CHOP u pacientů s nově diagnostikovaným DLBCL bez zvýšeného záchytu toxicity v porovnání s režimem R-CHOP. V současnosti probíhající studie fáze III Front-MIND nabírá pacienty s de novo DLBCL a vyšším rizikem podle IPI k testování efektivity této perspektivní kombinace léčiv.
Závěr
Léčba DLBCL doznala za posledních 50 let značného vývoje a z původně smrtelné nemoci se stalo onemocnění vyléčitelné u většiny pacientů. Mezi hlavní milníky patřilo přidání rituximabu do léčebného schématu u pacientů s DLBCL na přelomu tisíciletí. Od té doby zůstal režim R-CHOP až do uvedení režimu Pola-R-CHP nepřemožen. Dalším důležitým krokem ke zlepšení prognózy nemocných s DLBCL bylo uvedení konsolidace pomocí vysokodávkované chemoterapie a auto-SCT ve 2. linii léčby po indukci platinovým chemoterapeutickým režimem. Nicméně až v poslední dekádě se objevují inovativní léčebné přístupy, které výrazně rozšířily terapeutické spektrum pro pacienty s R/R DLBCL, a tím zlepšily jejich přežití. Tyto léčebné modality, které zahrnují konjugáty protilátky a léčiva, CAR T-cell terapii a bispecifické protilátky, se postupem času posouvají do časnějších linií léčby, jak bylo recentně ukázáno na užití CAR T-cell terapie ve 2. linii. Současné diagnostické metody dále identifikují skupiny high-risk lymfomů s rekurentními genetickými změnami, které mohou být cílem moderní terapie namířené proti konkrétní genetické změně, a vést tak k prodloužení přežití těchto nemocných. Tento přístup založený na znalostech molekulární patogeneze daného typu DLBCL je však zatím zkoušen v rámci klinických studií především v 1. linii a jeho vliv na terapii pacientů v relapsu není velký. Pacienti, kteří nezareagují dobře na léčbu 1. linie, tak nadále profitují zejména z přístupů cílících na univerzální markery B-buněčné řady.
MUDr. Prokop Vodička
prof. MUDr. Marek Trněný, CSc.
I. interní klinika – hematologie, 1. LF UK a VFN v Praze
