Přímá perorální antikoagulancia, zavedená do klinické praxe v první dekádě 21. století, přinesla velký pokrok v antikoagulační léčbě. Přesto je tato léková skupina spojena s četnými výzvami a limitacemi. Proto se intenzivně hledají nové možnosti antikoagulace. V pokročilé fázi je vývoj inhibitorů faktoru XI a faktoru XIa.
Vzhledem k tomu, že se riziko tromboembolických onemocnění zvyšuje s věkem, stále roste i počet antikoagulovaných pacientů. Rozlišujeme krátkodobou až střednědobou antikoagulaci parenterálními antikoagulancii (nízkomolekulární hepariny – LMWH, nefrakcionovaný heparin – UFH a fondaparinux) a dlouhodobou perorální antikoagulaci přímými perorálními antikoagulancii (DOAC) a antagonisty vitaminu K (VKA) – v České republice warfarin. Za posledních deset let, tj. od zavedení inhibitoru trombinu (DTI) dabigatranu a tří inhibitorů faktoru Xa – rivaroxabanu, apixabanu a edoxabanu – se počet předepisovaných perorálních antikoagulancií násobně zvýšil. V roce 2022 patřily apixaban a rivaroxaban mezi nejčastěji předepisované léčivé přípravky vůbec.
Přehled užívaných antikoagulancií
DOAC přinesla jednoznačně velký pokrok v antikoagulaci. Na jedné straně díky jejich dostupnosti mnoho dříve neléčených pacientů s fibrilací síní (FS) dostává adekvátní profylaxi cévní mozkové příhody (CMP), na druhé straně intenzivní klinický výzkum v posledních letech přinesl důležité poznatky o antikoagulaci u zvláštních skupin pacientů, jako jsou pacienti s chronickým onemocněním ledvin, a ve specifických klinických situacích, například při léčbě antikoagulovaných pacientů s FS s akutním koronárním syndromem.
Ve dvou hlavních oblastech použití perorálních antikoagulancií, a to v profylaxi a terapii CMP a v sekundární profylaxi žilního tromboembolizmu (VTE), stále častěji DOAC v souladu s aktuálními guidelines nahrazují antagonisty vitaminu K (VKA). Od roku 2021 jsou rivaroxaban a dabigatran schváleny také pro terapii VTE u dětí. Kromě toho jsou k dispozici specifická antidota v podobě idarucizumabu (2015) pro dabigatran a andexanetu alfa (2019) pro rivaroxaban a apixaban, nikoli však pro edoxaban. V řadě indikací, jako např. antikoagulace u pacientů s mechanickými srdečními chlopněmi nebo antifosfolipidovým syndromem, však jsou VKA stále nenahraditelná.
Parenterálním antikoagulanciím zatím DOAC příliš nekonkurují, což se však pravděpodobně též postupně změní. Pro léčbu VTE jsou apixaban a rivaroxaban schváleny k podávání od prvního dne, a nahrazují tak iniciální antikoagulaci hepariny nebo fondaparinuxem. Navíc trombóza spojená s nádorem (cancer–associated thrombosis –CAT) může být nyní léčena orálními inhibitory faktoru Xa namísto nízkomolekulárních heparinů, pokud není vysoké riziko gastrointestinálního nebo urogenitálního krvácení, dále nejsou-li závažné lékové interakce a také nejsou-li poruchy vstřebávání v gastrointestinálním traktu. Kromě toho se spotřeba LMWH snižuje v důsledku klesajícího užívání VKA, protože bridging LMWH po vysazení VKA není již užíván tak často. Hepariny nicméně zůstávají nepostradatelné například v intenzivní péči, v těhotenství a při kojení a v kardiovaskulární chirurgii, v nedávné době též při léčbě COVID-19.
Vzhledem k nepředvídatelným rizikům (např. africká prasečí chřipka) a podobným dopadům na zdroje heparinu a extrémnímu nárůstu cen základní suroviny však v současné době vyvstává otázka zabezpečení dodávek. Kromě toho tlak na náklady činí heparin z obchodního hlediska stále méně atraktivním. Nelze opominout značná rizika spojená s kontaminovanými hepariny.
Problematika bezpečnosti antikoagulancií
Antikoagulační léčba je v zásadě balancováním mezi tromboembolií a krvácením a vyžaduje velkou opatrnost. Zásadní je výběr nejvhodnějšího antikoagulancia pro daného nemocného a také správné dávkování, které se stalo výzvou vzhledem k rozmanitosti standardních dávkovacích a redukčních režimů DOAC. Navíc polovina pacientů s VTE je starších 70 let a 61 % pacientů s VTE je dokonce starších 75 let. Většina antikoagulovaných pacientů má tedy zhoršenou funkci ledvin, multimorbiditu, polymedikaci a častější indikace k chirurgické intervenci. To zvyšuje riziko nežádoucích účinků léků, chyb v medikaci a nedodržování léčebného režimu.
Krvácení při antikoagulační léčbě je nejčastějším nežádoucím účinkem vedoucím k hospitalizaci. Příčinou jsou často lékové chyby a interakce. Ty jsou převážně farmakodynamické, nikoli farmakokinetické povahy, tj. nelze je identifikovat prostou monitorací (jako např. vyšetření INR při terapii VKA), a postihují všechna antikoagulancia stejně.
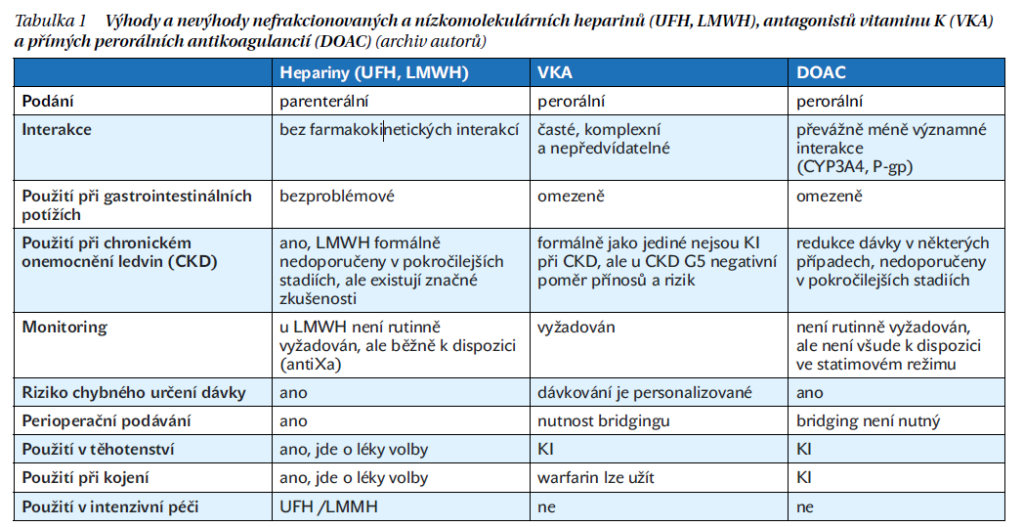
Díky dostupnosti DOAC, heparinů a VKA máme k dispozici široké portfolio antikoagulancií, která se vzájemně liší svými výhodami a nevýhodami (tabulka 1). Všechna však zvyšují riziko krvácení. Platí to i pro DOAC, přestože u pacientů s VTE v profylaxi snížily počet hemoragických CMP a intrakraniálních krvácení na polovinu ve srovnání s VKA a významně snížily riziko závažného krvácení při léčbě VTE.
Antikoagulancia bez zvýšeného rizika krvácení by byla žádoucí zejména u pacientů, kteří již mají zvýšený sklon ke krvácení. Patří k nim nejen pacienti s krvácením a gastrointestinálními vředy v anamnéze, ale také osoby s chronickým onemocněním ledvin (CKD), pacienti s nádory, dále křehcí a starší lidé, kteří vykazují rovněž zvýšené riziko tromboembolie. V úvahu je třeba vzít také pacienty užívající komedikaci, která zvyšuje riziko krvácení. Obavy z krvácení často vedou k poddávkování nebo rezignaci na antikoagulační léčbu.
Dostupnost účinné a bezpečné antikoagulace u CKD je důležitá, protože 65 % pacientů s FS má CKD ve stadiu 3–5. Podle metaanalýz jsou DOAC při středně těžkém funkčním postižení (CKD G3) ve schválené dávce účinnější a bezpečnější než VKA. Antagonisty faktoru Xa (na rozdíl od dabigatranu) lze používat s opatrností i u těžšího onemocnění ledvin (CKD G4). V současné době existují robustní důkazy o tom, že VKA na rozdíl od DOAC vedou k progresi CKD.
Problematická je situace u pacientů v konečném stadiu selhání ledvin a u hemodialyzovaných pacientů, protože u nich je obzvláště vysoké riziko krvácení, infarktu myokardu, CMP a VTE. Nedávná metaanalýza opět potvrzuje, že VKA u pacientů s FS a CKD nesnižuje riziko tromboembolie a úmrtí, ale vede k významnému zvýšení výskytu hemoragické CMP. Širší údaje u antagonistů faktoru Xa zatím nejsou k dispozici.
Situace u pacientů s terminálním selháním ledvin (end stage renal disease – ESRD) je příkladem potřeby nejen bezpečnějších, ale také účinnějších antikoagulancií a substancí s lepším poměrem přínosů a rizik. DOAC zřejmě nemohou tuto potřebu naplnit ve všech případech, protože se ukázalo, že jsou méně účinná než VKA u pacientů s mechanickými srdečními chlopněmi nebo s antifosfolipidovým syndromem.
Problematická je situace i v dalších klinických situacích jako sekundární prevence po CMP (zejména kardioembolické nebo nejasné příčiny) nebo profylaxe trombózy po transkatétrové implantaci aortální chlopně (TAVI).
Nové perspektivy antikoagulační léčby
Oproti starším předpokladům (původní koncept koagulační kaskády) je nyní všeobecně přijímáno, že jak vnitřní, tak zevní větev koagulačního systému je prvotně spouštěna uvolněním aktivního tkáňového faktoru, vznikem komplexu tkáňového faktoru s faktorem VIIa a následnou aktivací buď přímo faktoru X na Xa, nebo cestou faktoru IXa.
Role FXII v aktivaci koagulace je podle nové teorie koagulace méně významná, důležitější roli plní při aktivaci fibrinolýzy. Defekty FXII nejsou spojovány s krvácivými projevy, ale naopak se zdá, že zvýšeně predisponující k trombózám z důvodu nedostatečné aktivace plazminogenu. O tom, zda je zvýšený výskyt trombóz při současném defektu FXII, se vedou spory a defekt FXII se v současné době neřadí mezi jednoznačně prokázané rizikové faktory pro trombózu. V případě poškození povrchu cévy dochází ke kontaktu faktoru XII se subendotelem (aktivace kontaktem). Aktivovaný faktor XIIa mění prekallikrein na kallikrein, který společně s HMWK (kininogenem) dokončí aktivaci faktoru XII hydrolýzou na dva fragmenty XII. Kallikrein zvyšuje i uvolňování kininů z HMWK (vysokomolekulární kininogen). Kininy zvýší kontraktilitu hladkých svalů, sníží propustnost cév a vyvolají bolest. Aktivní XIIa mění pak XI na XIa.
Původní koncepce předpokládala, že spouštěcím mechanizmem tzv. vnitřní větve koagulační kaskády je autoaktivace faktoru XII na polyanionickém povrchu.
Již dlouho je tedy známo, že lidé s nedostatkem faktoru XII nevykazují zvýšené riziko krvácení a že lidé s nedostatkem FXI (hemofilie C) více krvácejí pouze po těžkých úrazech a při velkých operacích a že lidé s nedostatkem plazmatického kallikreinu (pK) často ani nejsou odhaleni. Z toho vyplývá, že ačkoli jsou tyto faktory nezbytné pro koagulaci prostřednictvím kontaktní aktivace, pro hemostázu se zdají být spíše nedůležité. Proto se zkoumalo, zda by mohly být cílem pro látky, které zabraňují vzniku trombů, aniž by zvyšovaly riziko krvácení.
Pokusy s knockout myšmi tuto hypotézu potvrdily: vyřazení FXI, FXII a také pK zabránilo vzniku žilní a arteriální trombózy, aniž by se prodloužila doba krvácení. Studie na zvířecích modelech trombózy s protilátkami, antisense oligonukleotidy a dalšími inhibitory tyto výsledky potvrdily.
Na základě experimentálních a epidemiologických údajů se FXI(a) stal hlavní cílovou strukturou pro vývoj nových antikoagulancií.
Vzhledem k tomu, že FXI se podílí také na hemostáze vyvolané tkáňovým faktorem v důsledku jeho „zpětnovazebné“ aktivace trombinem, může být inhibice FXI(a), na rozdíl od inhibice FXII(a), spojena s určitým rizikem krvácení, zato však může být efektivní i tehdy, když se tkáňový faktor podílí na tvorbě trombu, například při operaci nebo aterotrombóze.
Zatímco účinky FXIa se zaměřují na koagulaci, FXIIa má více funkcí. Ve skutečnosti je inhibice FXII(a) jako antitrombotická strategie nyní považována za „dvousečnou zbraň“ a v průmyslu se jí nevěnuje pozornost. FXIIa má nejen prokoagulační, ale také profibrinolytické a trombus stabilizující účinky. Jeho inhibice by proto mohla podporovat růst trombu i jeho embolizaci. To vysvětluje, proč nedostatek FXII na rozdíl od nedostatku FXI nesnižuje výskyt tromboembolie.
Inhibitory FXII(a) jsou však považovány za zajímavé kandidáty pro další indikace; patří mezi ně hereditární angioedém, imunitní trombóza, sepse, roztroušená skleróza, Alzheimerova choroba a neuroprotekce po traumatickém poranění mozku.
Navzdory antitrombotickým účinkům ve studiích na zvířatech nehrají inhibitory pK(a) žádnou roli ani ve výzkumu antikoagulancií. Díky kallikrein-kininové dráze je však inhibice pK(a) zajímavá pro jiné indikace. S ekalantidem (pouze v USA) a lanadelumabem jsou již schváleny dva inhibitory pKa.
Ekalantid je schválen pro trh v USA k léčbě pacientů starších 16 let s hereditárním angioedémem.
Lanadelumab je humánní monoklonální protilátka (třída IgG1 kappa), která je zaměřena proti plazmatickému kallikreinu (pKal) s cílem podpořit prevenci angioedému u osob s hereditárním angioedémem. Lanadelumab byl ve Spojených státech schválen jako první monoklonální protilátka určená k profylaktické léčbě za účelem prevence atak hereditárního angioedému. Lanadelumab je prvním lékem pro prevenci hereditárního angioedému vyrobeným pomocí buněk v laboratoři, nikoliv lidské plazmy.
Do roku 2019 bylo uděleno téměř 150 patentů na inhibitory FXI(a). Strukturálně lze rozlišit pět tříd:
- rozmanité peptidomimetické „malé molekuly“ (small molecule drugs – SM);
- antisense oligonukleotidy (ASO);
- rekombinantní protilátky (rAB);
- aptamery;
- polypeptidy, včetně polypeptidů biogenního původu.
Většina patentovaných inhibitorů jsou malé molekuly, přestože struktura FXI činí vývoj molekul, které jsou současně vysoce účinné, vysoce selektivní a perorálně dostupné, obzvláště složitým. Mechanisticky existují jak kompetitivní, tak alosterické inhibitory (v případě protilátek ty, které se vážou buď na FXI, nebo FXIa, nebo na obě formy) a u antisense oligonukleotidů třída, která blokuje biosyntézu FXI.
Kromě toho se jednotlivé třídy látek liší v některých klinicky významných vlastnostech. Například pro profylaxi VTE po chirurgickém zákroku je lákavé, že se musí aplikovat pouze jedna dávka protilátky. Pro dlouhodobou léčbu jsou obecně perspektivní perorálně dostupné látky, a to i z cenových důvodů. U pacientů s CKD nebo polymedikací však mají antisense oligonukleotidy, rekombinantní protilátky a aptamery tu výhodu, že jsou eliminovány nezávisle na funkci ledvin a nemají farmakokinetický interakční potenciál. Méně častá aplikace rAB a ASO ve srovnání s perorálními přípravky a aptamery může být výhodná z hlediska adherence k léčbě.
Inhibitory faktoru XI(a) v klinických studiích
Prvním inhibitorem FXI(a), který byl hodnocen ve studii fáze II, byl antisense oligonukleotid IONIS-FXIRx). Indikace studie FXI-ASO TKA „profylaxe VTE po elektivní chirurgické náhradě kolenního kloubu (TEP kolenního kloubu)“ jistě není hlavním předmětem zájmu inhibitorů FXI(a), ale jedná se o typickou indikaci proof-of-concept ve vývoji antikoagulancií. Tato studie a tři další studie s TEP kolenního kloubu poskytly konzistentní výsledky. Nedávno publikovaná metaanalýza ukázala významné snížení závažného a klinicky relevantního krvácení a VTE ve srovnání s enoxaparinem.
Vyšší bezpečnost potvrzuje hypotézu o inhibici FXI(a) jako antikoagulaci bez zvýšeného rizika krvácení. Poněkud neočekávaná byla lepší účinnost, protože zejména při operaci náhrady kolenního kloubu se uvolňuje velmi velké množství tkáňového faktoru.
Další směry klinického vývoje
Další studie fáze II/III se zabývají pacienty se selháním ledvin závislými na dialýze (ESRD), pacienty s CMP a pacienty s nádorovým onemocněním, a tedy třemi oblastmi, kde je zřejmá potřeba rozšíření stávajících terapeutických modalit. Šest z osmi samotných inhibitorů FXI(a) bylo nebo je zkoušeno pro profylaxi tromboembolie u pacientů závislých na hemodialýze ve srovnání s placebem z důvodu neexistence schválené alternativy. Dokončené, i když velmi malé studie ukazují, že inhibitory FXI(a) jsou dobře tolerovány a nezvyšují riziko krvácení.
Ischemická CMP je druhou nejčastější tromboembolickou komplikací kardiovaskulárních onemocnění s vysokou morbiditou a mortalitou. Zejména vysoká míra recidiv v časné fázi vyžaduje účinnější antitrombotickou léčbu bez dalšího zvyšování rizika krvácení.
Třetí oblastí, na kterou se v současné době zaměřuje vývoj inhibitorů FXI(a), je žilní tromboembolie u pacientů s nádory. Pro dlouhodobé použití u těchto pacientů, kteří často trpí gastrointestinálními problémy, jsou předurčeny měsíčně podávané injekční protilátky, jako je abelacimab, který je v současné době zkoumán ve dvou studiích fáze III.
Závěr
I přes pokroky, kterých bylo v oblasti antikoagulační léčby dosaženo, je třeba dalšího vývoje antikoagulancií spojených s nižším rizikem krvácení. Preklinické a epidemiologické údaje naznačují, že inhibice FXI(a) vykazuje antitrombotický účinek bez ovlivnění hemostázy. To vedlo k vývoji více inhibitorů FXI(a). V současné době je ve fázi II a III zkoušeno více inhibitorů FXI(a). V profylaxi VTE po operaci náhrady kolenního kloubu prokázaly studie fáze II snížené riziko krvácení a lepší účinnost ve srovnání s enoxaparinem. Nové léky se zdají perspektivní ve více oblastech, např. v případě selhání ledvin vyžadujícího dialýzu, u cévních mozkových příhod a žilní tromboembolie u pacientů s nádory. Výsledky fáze II jsou slibné, ale zda inhibitory FXI(a) skutečně mohou vyřešit některé problémy v antikoagulaci, ukáží až studie fáze III.
Literatura u autorů.
MUDr. Jan Vachek1
MUDr. Vít Motáň2
prof. MUDr. Vladimír Tesař, DrSc.1
1Klinika nefrologie 1. LF UK a VFN v Praze
2Transfuzní oddělení, Nemocnice České Budějovice
