Karcinom pankreatu je třetí nejčastější příčinou úmrtí na nádorové onemocnění, jehož incidence a mortalita podle predikcí nadále porostou. Téměř 80 % pacientů je diagnostikováno s pokročilým onemocněním, a je tudíž odkázáno na paliativní systémovou protinádorovou léčbu s limitovanou účinností. V tomto sdělení uvádím souhrn aktuálních možností léčby metastatického karcinomu pankreatu včetně možností molekulární diagnostiky a cílené léčby podskupin.
Karcinom pankreatu (KP) představuje prognosticky nepříznivé nádorové onemocnění rezistentní k léčbě, jehož incidence i mortalita neustále narůstají a průměrné pětileté přežití dosahuje 6–10 %. V současné době představuje třetí nejčastější příčinu úmrtí na zhoubný nádor ve vyspělých zemích a podle predikcí se v nadcházejících letech předpokládá posun na místo druhé, hned za nádory plic. Incidenci a mortalitu v ČR demonstruje obrázek 1.
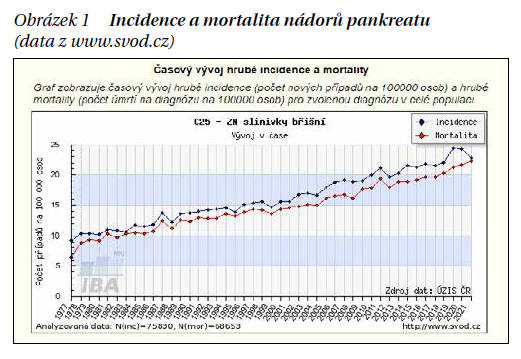
Lokalizované (primárně resekabilní nebo hraničně resekabilní) onemocnění je diagnostikováno jen u cca 10–25 % pacientů, u cca 30 % pacientů je onemocnění lokálně pokročilé (inoperabilní) a u cca 50–60 % pacientů je již v době diagnózy potvrzena vzdálená diseminace.
Rizikovými faktory pro vznik KP jsou zejména chronická pankreatitida, kouření a diabetes mellitus, důležitou roli však hraje i genetická predispozice. Většina (cca 70–80 %) duktálních adenokarcinomů je lokalizována v hlavě pankreatu, kde s výjimkou obstrukčního ikteru zůstává dlouho klinicky asymptomatická, a je tudíž diagnostikována až v pokročilém stadiu. KP často roste infiltrativně do okolí, proniká do retroperitoneální tukové tkáně, prorůstá do okolních cév a infiltruje stěnu duodena. Obvykle metastazuje do jater, plic, nadledvin a peritonea. K histologické verifikaci metastatického onemocnění využíváme perkutánní biopsii jaterních metastáz pod CT nebo UZ kontrolou. Pro adenokarcinom pankreatu je typické denzní vazivové stroma spojené s chronickou obstrukční fibroproduktivní pankreatitidou, která nádorovou infiltraci doprovází a omezuje průnik cytostatik do nádorové tkáně.
První linie léčby metastatického karcinomu pankreatu
Cílem léčby metastatického KP (mKP) je dosažení regrese nebo alespoň stabilizace nádorového onemocnění, prodloužení života pacientů a zlepšení jeho kvality. Medián přežití (mOS) pacientů s mKP se bez použití protinádorové léčby pohyboval v rozmezí 3–4 měsíců. Aplikací gemcitabinu v monoterapii dokážeme prodloužit mOS na cca 6 měsíců při mediánu času do progrese onemocnění (mPFS) cca 3–4 měsíce.
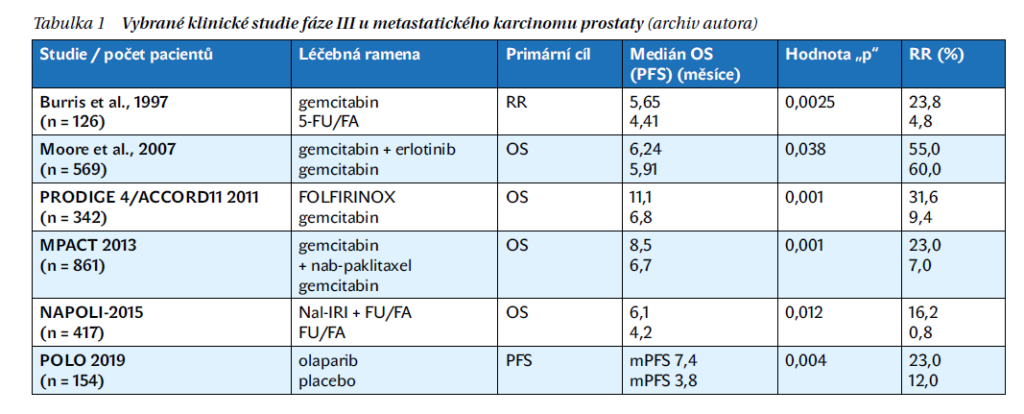
Opravdového pokroku bylo dosaženo až v roce 2011 ve studii PRODIGE 4/ACCORD11, která prokázala signifikantně vyšší efektivitu trojkombinace FOLFIRINOX oproti monoterapii gemcitabinem ve všech sledovaných parametrech: dosažená léčebná odpověď (RR) 31,6 vs. 9,4 %, mPFS 6,4 vs. 3,3 měsíce, mOS 11,1 vs. 6,8 měsíce.
Tento kombinovaný režim však provází významná toxicita, a je proto určen pouze pro pacienty ve velmi dobrém celkovém stavu (PS 0–1), ideálně mladší 70–75 let. Alternativoutripletu FOLFIRINOX je použití kombinace nab-paklitaxel/gemcitabin, která ve studii MPACT (publikované v roce 2013) prokázala v přímém porovnání s gemcitabinem 29 % léčebných odpovědí (oproti 8 % při gemcitabinu), mPFS 5,5 vs. 3,7 měsíce a mOS 8,5 vs. 6,7 měsíce.
Metaanalýza randomizovaných studií potvrdila, že klíčový faktor pro predikci benefitu z kombinované léčby je celkový stav pacienta (PS). Nemocní s PS 0–1 z kombinace jednoznačně profitovali, naopak pacienti s PS 2 či KI 60–80 % z ní profitovali výrazně méně.
Na základě výsledků výše uvedených studií lze tedy shrnout, že terapeutickým standardem pro první linii léčby metastatického karcinomu pankreatu je u pacientů v dobrém celkovém stavu (PS 0–1) kombinovaná chemoterapie (CHT) režimem FOLFIRINOX nebo nab-paklitaxel/gemcitabin. Použití obou režimů je možné a správné, snad mírně účinnější, ale současně i toxičtější se na základě některých srovnávacích studií jeví triplet FOLFIRINOX, který by měl být preferován zejména u mladších pacientů s podezřením na mutaci BRCA1 nebo BRCA2 (viz dále). U pacientů v horším celkovém stavu (PS 2) se preferuje léčba gemcitabinem v monoterapii. V léčbě pokročilého karcinomu pankreatu byla testována řada dalších cílených léčiv (včetně cetuximabu, bevacizumabu, ruxolitinibu, tremelimumabu, durvalumabu a dalších), a přestože výsledky studií fáze I a II byly často velmi nadějné, žádný z uvedených preparátů v randomizované studii fáze III účinnost nepotvrdil.
Možnosti druhé linie léčby
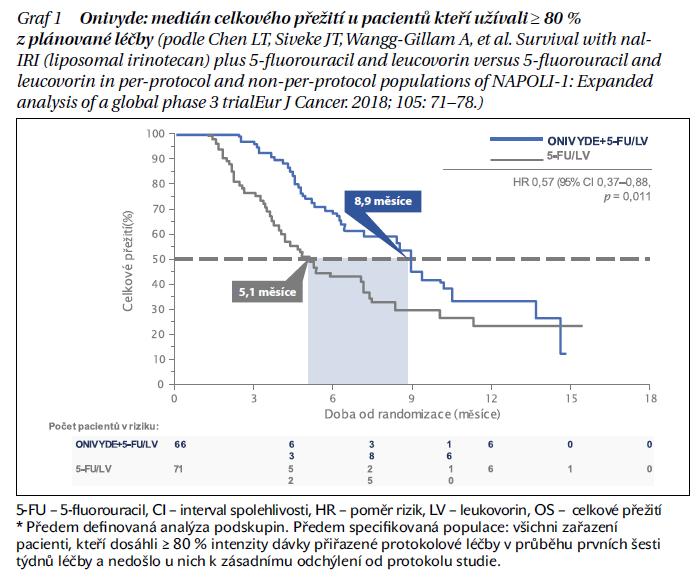
Zásadní podmínkou pro možnost dalšího podání CHT po selhání režimu první linie je dobrý celkový stav pacienta (PS 0–2). Obecně lze shrnout, že po léčbě na bázi 5-fluorouracilu (5-FU) využíváme léčbu na bázi gemcitabinu a naopak. V praxi to znamená, že u pacientů předléčených režimem FOLFIRINOX budeme ve druhé linii zvažovat režim nab-paklitaxel/gemcitabin, případně pouze gemcitabin v monoterapii. U pacientů předléčených režimem nab-paklitaxel/gemcitabin prokázala nejlepší výsledky kombinace nanoliposomálního irinotekanu (nal-IRI) s FU/LV, jejíž použití oproti 5-FU/LV vedlo ve studii NAPOLI-1 k prodloužení mOS ze 4,2 na 6,2 měsíce, mPFS z 1,5 na 3,1 měsíce a navýšení procenta léčebných odpovědí z 1 % na 17 %. Roční přežití pacientů na Onivyde+5-FU/LV dosáhlo 26 % oproti 16 % u pacientů léčených 5-FU/LV. Navíc u pacientů, kteří užívali optimální dávku přípravku Onivyde+5-FU/LV (≥ 80 % doporučené dávky během prvních 6 týdnů léčby), došlo ke zvýšení mediánu OS na 8,9 měsíce vs. 5,1 měsíce v kontrolním rameni na léčbě 5-FU/LV (graf 1).
Alternativou je kombinace 5-FU s oxaliplatinou, která ve studii CONKO-003 prokázala efekt pouze v atypickém aplikačním schématu v rámci režimu OFF (mOS 5,9 vs. 3,3 měsíce, mPFS 2,9 vs. 2,0 měsíce), zatímco klasická kombinace mFOLFOX6 v této indikaci selhala. U pacientů, kteří zůstanou v dobrém celkovém stavu i po progresi na paliativní chemoterapii druhé linie, lze v obou případech zvážit aplikaci 5-FU v monoterapii nebo v kombinaci s oxaliplatinou v rámci třetí linie léčby (již bez opory v datech z randomizovaných studií). Pokud byl pacient v předchozích liniích léčen gemcitabinem a nebyl léčen nal-IRI+ 5-FU/LV, lze do 3. linie použít i tuto kombinaci. Souhrn výsledků vybraných klinických studií f. III u mKP je uveden v tabulce 1.
Cílená léčba podskupin
I v rámci pokročilého KP se podařilo na základě molekulárního profilování identifikovat několik podskupin pacientů, kteří profitují z cílené léčby. První takovou skupinou jsou pacienti s germinální mutací v nádorově supresorovém genu BRCA1 nebo BRCA2 (5–7 % všech pacientů), která je predisponuje ke vzniku karcinomu prsu, ovaria nebo právě karcinomu pankreatu. U této skupiny nemocných se obecně popisuje výrazně vyšší citlivost na CHT platinovými deriváty, delší přežití než u pacientů s klasickým adenokarcinomem pankreatu a efektivita specifické skupiny cílených léčiv zvaných PARP inhibitory. U pacientů s germinální mutací BRCA1 nebo BRCA2, u kterých nedošlo k progresi na prvoliniové léčbě s platinovým derivátem (typicky režim FOLFIRINOX), bylo při použití udržovací terapie PARP inhibitorem olaparibem ve studii POLO dosaženo ovšem bez prokázanání vlivu na mOS. Při konečné analýze OS však bylo procento pacientů, kteří byli naživu a sledováni, 28 % v rameni s olaparibem a 18 % v rameni s placebem.
zdvojnásobení mediánu času do progrese onemocnění (z 3,8 na 7,4 měsíce) a nesignifikantního prodloužení mOS. Kromě olaparibu je však u této skupiny pacientů z klinického hlediska naprosto zásadní především léčba platinovými deriváty(typicky oxaliplatinou v rámci režimu FOLFIRINOX), a to i v případě somatických mutací v některém z tzv. DDR genů (DNA damage response and repair – kromě BRCA 1/2 i geny PALB2, CHEK, ATM a další), které jsou detekovatelné až u 17 % všech KP. Bylo totiž prokázáno, že mOS pacientů s pokročilým KP s DDR mutací je při léčbě platinovými deriváty dramaticky vyšší než při léčbě ostatními neplatinovými cytostatiky – typicky gemcitabinem s nab-paklitaxelem (2,37 vs. 0,76 roku). Přitom právě léčba gemcitabinem v kombinaci s nab-paklitaxelem je v západních zemích preferovanou variantou léčby I. linie mKP a udává se, že až 50 % pacientů s KP je léčeno „neplatinovými“ chemoterapeutickými režimy.
Druhou podskupinou jsou pacienti s tzv. mikrosatelitovou instabilitou (MSI-H). Jedná se o cca 1 % pacientů s karcinomem pankreatu, u kterých byl poměrně jednoduchým a běžně dostupným imunohistochemickým vyšetřením potvrzen defekt opravného systému párování bází MMR (mismatch repair system). U těchto pacientů dochází ke kumulaci defektů v DNA s následnou tvorbou aberantních proteinů, které nádorová buňka vystavuje na svém povrchu, a tím atrahuje efektorové buňky imunitního systému. Při použití tzv. check-point inhibitorů (monoklonálních protilátek proti inhibičním receptorům na povrchu T lymfocytů) dochází k aktivaci imunitního systému s následným protinádorovým efektem. I když podíl léčebných odpovědí na léčbu check-point inhibitory (např. pembrolizumabem nebo nivolumabem) je v případě MSI-H nádorů pankreatu výrazně nižší (cca 18 %) než u ostatních MSI-H solidních nádorů (cca 28–40 %), výhodou imunoterapie je kromě odlišné (většinou nižší) toxicity zejména fakt, že dosažená léčebná odpověď je často dlouhodobá.
Třetí podskupinou, která tvoří méně než 1 % pacientů s KP, jsou pacienti s tzv. NTRK fúzí (resp. fúzí genů pro neurotrofinové receptorové tyrosinkinázy 1, 2 a 3). V těchto velmi vzácných případech, jejichž identifikace vyžaduje specifické molekulárněgenetické vyšetření, lze zvážit léčbu některým z NTRK inhibitorů (larotrektinibem nebo entrektinibem), které prokázaly svoji účinnost u různých typů nádorového onemocnění s NTRK fúzí.
Mezi další potenciálně targetovatelné mutace u KP patří např. mutace BRAF, ALK, ROS1, FGFR1/4, RET, ERBB2 a další. Četnost každé z těchto mutací obvykle nepřesahuje 1 % a jejich diagnostika je možná jen v rámci komplexního NGS testování vzorku nádorové tkáně. Bylo zjištěno, že tyto vzácné mutace se ve většině případů vyskytují u pacientů s absencí mutace onkogenu KRAS, která je u KP přítomná téměř v 90 % případů. Vyšetření mutace KRAS tedy může nasměrovat onkologa k případné indikaci NGS testování s cílem zachytit některé z potenciálně terapeuticky ovlivnitelných genových alterací.
Nové léčebné cíle u karcinomu pankreatu
Přestože řada klinických studií časných fází testujících nové léky v indikaci mKP přinesla slibné výsledky, následné randomizované studie fáze III bohužel efektivitu neprokázaly. Četnost selhání studií fáze III u této diagnózy se udává kolem 80–90 %, a lze tedy konstatovat, že karcinom pankreatu patří mezi nejrezistentnější nádorová onemocnění vůbec. Jednou z hlavních příčin rezistence nádorů pankreatu k léčbě je právě přítomnost denzního nádorového stromatu, která je mimo jiné výraznou překážkou v distribuci cytostatik i cílených léčiv do nádorové tkáně. Klinické studie se tudíž zaměřují na nádorové mikroprostředí a možnosti jeho ovlivnění. Naděje byly vkládány do ovlivnění jedné z klíčových komponent nádorového stromatu – kyseliny hyaluronové (HA). Vysoká hladina HA vede ke zvýšení intersticiálního tlaku, kompresi cév a je asociována s akcelerovaným růstem nádoru a horším přežitím pacientů. Zatímco studie fáze II s PEGylovanou formou rekombinantní lidské hyaluronidázy (PEGPH20) prokázala u pacientů s vysokou hladinou HA signifikantní prodloužení mPFS při kombinaci s CHT nab-paklitaxel/gemcitabin oproti CHT samotné, v prvoliniové studii fáze III (HALO 301), která zařazovala již jen pacienty s vysokou hladinou HA, bohužel benefit v mOS ani mPFS při stejném designu léčby prokázán nebyl. Rovněž inhibitor kmenových buněk nádoru napabucasin (potlačující STAT3 signalizaci) i přes nadějné výsledky studie fáze Ib/II v následné studii fáze III efektivitu nepotvrdil. Oblíbeným explorativním cílem klinických studií u nádorů pankreatu je ovlivnění metabolizmu nádorových buněk – testuje se např. inhibitor mitochondriálního metabolizmu devimistat v kombinaci s CHT případně L-asparagináza enkapsulovaná do erytrocytů (tzv. eryaspáza).
Největší naděje jsou vkládány do molekulárního testování a cílené léčby pacientů s potenciálně targetovatelnou mutací, kterých je podle některých publikací až 26 %. U většiny (cca 90 %) mKP je však detekována mutace onkogenu KRAS, která byla do nedávné doby cílenou léčbou neovlivnitelná – snad s výjimkou mutace KRAS G12C (přítomné u cca 2 % všech mKP, inhibitory sotorasib a adagrasib testované u nádorů plic a kolorektálního karcinomu). Zcela recentně (leden 2023) byla publikována preklinická data týkající se efektivity nízkomolekulárních inhibitorů KRAS G12D u imunokompetentních myší s mKP, která prokázala hluboké regrese až vymizení implantovaných nádorů u myší s touto mutací. Důležité je, že mutace KRAS G12D je detekována u cca 40 % pacientů s mKP a objevení inhibitoru KRAS G12D a jeho použití u člověka by mohlo vést k zásadnímu průlomu v protinádorové léčbě tohoto onemocnění.
Samostatnou kapitolu pak tvoří moderní imunoterapie, jejíž efektivita je ale u nádorů pankreatu podstatně nižší než u ostatních malignit a s výjimkou malé podskupiny pacientů s MSI-H tumory se prozatím v léčbě mKP nepoužívá. V rámci výzkumu se však testují kombinace anti-PD-1 a anti-CTLA4 monoklonálních protilátek, vakcíny na bázi dendritických buněk či adenovirů a další. Je velmi pravděpodobné, že v oblasti imunoterapie lze do budoucna očekávat rovněž výrazný pokrok.
Závěr
KP zůstává nadále jedním z nejobávanějších nádorových onemocnění vůbec. Cca 80 % nemocných je diagnostikováno s pokročilým neresekabilním nebo metastatickým onemocněním, a je tudíž odkázáno na paliativní protinádorovou léčbu s limitovanou účinností. Probíhající klinický výzkum se zaměřením na nádorové mikroprostředí, metabolizmus nádorových buněk, cílenou léčbu targetovatelných mutací a využití moderní imunoterapie přináší určitou naději, že se i u této jinak infaustní diagnózy dočkáme „lepších zítřků“.
MUDr. Radim Němeček, Ph.D.
Klinika komplexní onkologické péče MOÚ a LF MU Brno
