Poznání inkretinů vedlo k novému přístupu v léčbě diabetu. Skupina agonistů receptoru pro GLP-1 (glukagonu podobný peptid) poskytla pacientům s diabetem 2. typu zlepšení kompenzace jejich základního onemocnění, ale současně i ukázala, že jejich působení je daleko širší. Účinky těchto farmak vyplývají z ovlivnění různých buněk a orgánů, což se pak promítá do jejich širšího spektra působení. Semaglutid se stal v této skupině první látkou, kterou je možno podávat perorálně.
Máme-li pochopit úlohu semaglutidu v moderní medicíně 21. století, je zapotřebí nejprve zmapovat postavení inkretinů ve fyziologii a patofyziologii člověka. V roce 1978 popsal profesor Werner Creutzfeldt poprvé inkretinový efekt, který spočívá ve 2–3× větší stimulaci sekrece inzulinu po požití sacharidu glukózy než po jejím intravenózním podání při dosažení stejné glykemie (tzv. izoglykemie). Tento fenomén vedl k objevu dvou hormonů, totiž glukózo-dependentního inzulinotropního polypeptidu (GIP) a glukagon-like peptidu-1 (GLP-1), které se uvolňují ze specifických buněk trávicí trubice vlivem přijaté potravy. Studium GLP-1 vedlo od roku 1987 nejen k novým poznatkům na poli regulace sekrece inzulinu, ale následně i k průkazu normalizace glykemie po aplikaci GLP-1 u diabetiků 2. typu. Další rozvoj bádání s GLP-1 vedl ke studiu jeho analogů, a tím ke klinickému využití ve studiích, které doložily mnohotné efekty přesahující rámec regulace glukózové homeostázy. A právě takovým analogem GLP-1 je semaglutid.
Stručný přehled fyziologického působení inkretinů
V současné době se považuje za primární fyziologickou úlohu obou hormonů (GLP-1 a GIP) jejich inkretinový efekt, který podmiňuje efektní sekreci inzulinu vedoucí k dosažení normoglykemie. Zdrojem obou hormonů jsou buňky střeva. Na sekreci těchto hormonů se podílí požitá potrava, a to zejména ta obsahující sacharidy a tuky (především triglyceridy), kdežto proteiny se podílejí na jejich sekreci málo, resp. spíše se uplatňují aminokyseliny. GIP i GLP-1 působí na cílovou buňku prostřednictvím transmembránových G-proteinových receptorů, které byly prokázány na buňkách řady orgánů (srdce, cév, podkožní a viscerální tukové tkáně, kosterního svalu, plic, na osteoblastech, pro GLP-1 pak v játrech a ledvinách). Přehled účinků obou hormonů je uveden v tabulce 1. Je tedy zřejmé, že působení obou hormonů je daleko širší, než se původně předpokládalo. To by vysvětlovalo jejich další účinky, které se promítají i v klinických studiích.
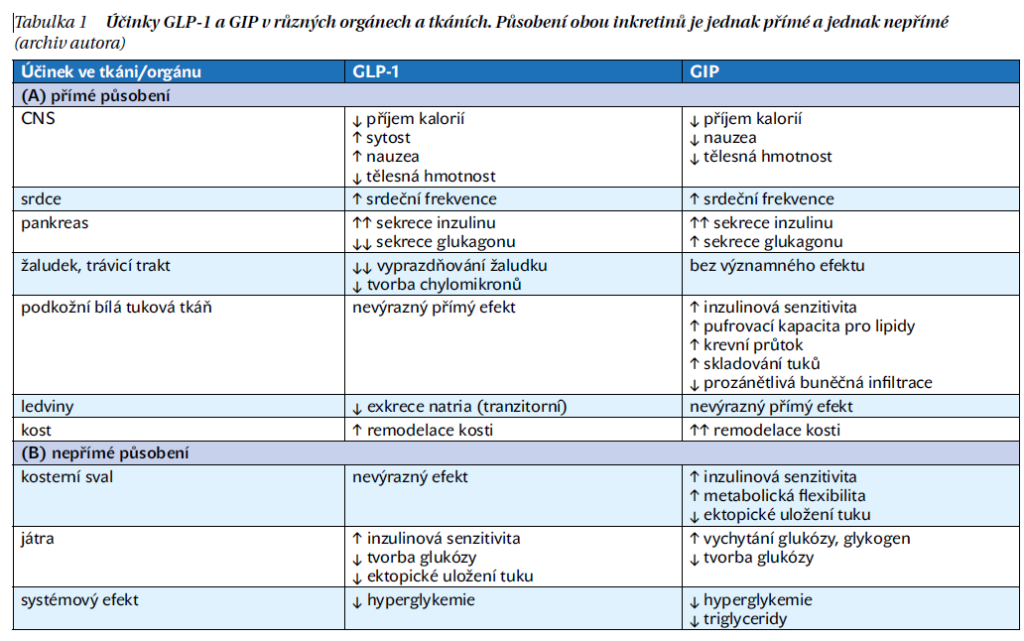
Vzhledem k tomu, že semaglutid je agonistou receptoru pro GLP-1, další text je směrován k tomuto inkretinu. Hlavním stimulem sekrece GLP-1 je hyperglykemie, která podmíní jeho regulované působení. Jeho efekt stoupá při narůstající hyperglykemii, a naopak při glykemii 3,7 mmol/l považované za prahovou hodnotu je účinnost GLP-1 i ve velmi vysoké koncentraci nulová. Jeho působením a též i jeho analogy se uplatňuje regulovaná sekrece inzulinu bez vzniku hypoglykemie, což je zásadní rozdíl proti efektu derivátů sulfonylmočoviny, které svým hypoglykemizujícím efektem nejsou závislé na aktuální glykemii. Na alfa buňky pankreatu GLP-1 působí inhibičně, a tím snižuje sekreci glukagonu.
Významný je účinek inkretinů na energetický metabolizmus. Klinické studie doložily velmi příznivý efekt GLP-1 receptorových analogů na redukci hmotnosti, a to nejen u diabetiků, ale i u obézních nediabetiků. V popředí zájmu je proto působení obou inkretinových hormonů na metabolizmus tukové tkáně, resp. ovlivnění chuti k jídlu, pocitu sytosti, množství konzumovaného jídla, případně energetického výdeje. U zdravých jedinců vede farmakologická dávka GLP-1 k poklesu chuti k jídlu, snížení množství konzumovaného jídla a zvýšení pocitu sytosti. Naopak fyziologická plazmatická koncentrace GLP-1 neovlivňuje energetický příjem. Mnohem složitější je působení GIP, které je rozdílné u experimentálních zvířat a u člověka a není předmětem tohoto sdělení.
Inkretiny však poskytují ještě řadu dalších efektů. Studium vlivu obou inkretinů na vyprazdňování žaludku ukázalo jednoznačný efekt GLP-1 (zpomalené vyprazdňování), kdežto GIP je zcela bez efektu. Vlivem GLP-1 dochází ke zpomalení transportu potravy do dalších úseků trávicí trubice, oploštění vzestupu glykemie a triglyceridů v krvi, ale též i ke snížení motility a sekrece žaludku a exokrinního pankreatu. Zatímco za normálního stavu nutrienty nedospějí do distálních úseků střeva (a tím k L buňkám), při průjmu naopak dochází ke stimulaci sekrece GLP-1 nutrienty s následným omezením motility a sekrece, čemuž se říká ileální brzda.
Zajímavé účinky byly popsány u kostního metabolizmu, i když většinou u zvířecích modelů. Stimulace GIP receptorů vedla ke vzestupu osteoblastické aktivity a potlačení osteoresorpce. Podobné efekty s potlačením funkce osteoklastů byly popsány i u GLP-1. Tyto efekty zřejmě souvisí s provázejícími anabolickými procesy, nicméně v dosavadních klinických studiích nebyly konzistentní účinky pozorovány.
Agonisté GLP-1 receptoru (GLP-1RA) doznaly již velkého zhodnocení svého vlivu na kardiovaskulární systém v řadě klinických studií. Tyto účinky ovlivnily jejich postavení v rámci terapie diabetu 2. typu (viz níže). GLP-1 zvyšuje srdeční frekvenci, krevní průtok v portálním řečišti i v podkožní tukové tkáni. Ukazuje se, že GIP snižuje oxidační stres v endotelových buňkách. Mnohé účinky však zůstávají ještě k objasnění, zejména v klinických studiích.
GLP-1 a diabetes mellitus
Pro diabetes mellitus 2. typu je příznačná kombinace poruchy sekrece inzulinu s různým stupněm inzulinové rezistence. Proto se studium zaměřilo na úlohu inkretinů u tohoto onemocnění. Ukázalo se, že inkretinový efekt, tedy vzestup sekrece inzulinu je u diabetu 2. typu snížen asi na třetinu proti zdravému jedinci, což je podmíněno sníženou stimulací GIP. Naproti tomu je zachován stimulační efekt GLP-1 na sekreci inzulinu a při hyperglykemii reagují B buňky na jeho podání zřetelným poklesem glykemie. Sekrece glukagonu je stimulována GIP, kdežto efekt GLP-1 se vyznačuje jeho inhibicí při hyperglykemii, ale nikoli při normoglykemii. Právě toto inhibiční působení GLP-1 na sekreci glukagonu, které se pojí s potlačením tvorby glukózy v játrech a poklesem glykemie, vedlo k využití GLP-1 v klinické praxi. U diabetu 2. typu byla totiž pozorována zvýšená sekrece glukagonu podmíněná GIP, kdežto reakce GLP-1 potlačující sekreci glukagonu byla snížena.
Tuková tkáň je pod velkým vlivem GIP. U diabetiků 2. typu je působení GIP sníženo, což vede ke sníženému inzulinotropnímu efektu. Ten se uplatní v tukové tkáni, kde působí GIP současně s inzulinem. Pufrovací kapacita tukové tkáně pro lipidy je pak u diabetu 2. typu snížena vlivem porušené regulační úlohy GIP, který fyziologicky zvyšuje krevní průtok tukovou tkání, snižuje hladinu cirkulujících volných mastných kyselin a stimuluje vychytávání glukózy a uskladnění triglyceridů v tukové tkáni. Porušení fyziologické regulace tukové tkáně při diabetu se promítá do zvýšeného ukládání tuků v ektopických lokalizacích – zejména v játrech, pankreatu a svalu. Jedná se o důsledky gluko- a lipotoxicity, které se uplatňují i v patogenezi zhoršeného inkretinového efektu. Proto je důležitá co nejlepší kompenzace diabetu, neboť dosažení normoglykemie vede k částečné reverzibilitě efektu GIP a současně i ke zlepšení inzulinové senzitivity. Poznání mechanizmu působení obou hormonů, GIP a GLP-1, současně odhaluje jejich komplementární působení ve tkáních či orgánech u zdravých jedinců i u diabetiků.
Terapeutické uplatnění účinků GLP-1
Poznání GLP-1 a jeho účinků vedlo k využití v klinické praxi v posledních téměř dvaceti letech. Inkretiny patřící pod peptidové hormony však mají krátký biologický poločas, prakticky jen několik minut, a jsou degradovány dipeptidylpeptidázou-4 (DDP-4). To však limituje jejich podání v nativní podobě, proto byla vytvořena analoga s parenterálním podáním. V klinické praxi se rozšířily v poslední době preparáty s aplikací 1× denně (liraglutid, lixisenatid) a nověji byla vytvořena analoga s prodlouženým působením s aplikací 1× týdně (semaglutid, dulaglutid). Každý analog byl testován se zřetelem na bezpečnost, vedlejší účinky a účinnost, a to v porovnání s placebem a s dalšími antidiabetiky. Studie zároveň ukázaly také další efekty těchto látek, které se předpokládaly na základě fyziologického působení inkretinů v organizmu, a to nejen ovlivněním samotného diabetu. Účinek těchto látek na redukci hmotnosti vedl k uplatnění v obezitologii. Tento efekt není závislý na regulaci glukózového metabolizmu, takže GLP-1RA se nyní velmi široce používají u obézních osob bez diabetu. Vedle toho studie doložily příznivé efekty u pacientů s rizikem kardiovaskulárního onemocnění.
Výsledky dokládají významné snížení rizika kardiovaskulárních příhod hodnocených pomocí MACE (úmrtí z kardiovaskulárních příčin, nefatálního infarktu myokardu a nefatální cévní mozkové příhody). Naprostá většina diabetiků je ve velmi vysokém kardiovaskulárním riziku, takže využití kardioprotektivního působení GLP-1RA je u těchto pacientů namístě. Na tomto efektu se podílí nesporně snížení zánětlivé reakce, a tedy angioprotektivní účinek GLP-1RA.
Další významné působení GLP-1RA je u chronického onemocnění ledvin. Snížení rychlosti poklesu renálních funkcí a zpomalení progrese albuminurie je podkladem jejich nefroprotektivního působení. V současné době je opakovaně doložen vztah mezi srdcem a ledvinou, takže využití GLP-1RA se promítá svým účinkem do obrazu označovaného jako kardionefroprotektivita. Tento příznivý efekt se dostává za hranice diabetu a studie již přinášejí důkazy o příznivém působení GLP-1RA u pacientů bez diabetu, ale se zvýšeným rizikem postižení obou orgánů.
Nežádoucí účinky léčby
Společné pro GLP-1RA jsou nežádoucí účinky, k nimž patří především gastrointestinální. Ty jsou ovšem společné pro celou skupinu GLP-1RA preparátů. V rámci příznaků plynoucích od trávicího ústrojí je v popředí pocit plnosti a snížení chuti k jídlu, které souvisí se zpomaleným vyprazdňováním žaludku. K nežádoucím účinkům patří nauzea, případně zvracení a průjem. Tyto projevy se vyskytují již na začátku terapie, jsou závislé na podávané dávce a velmi často ustupují s pokračující terapií. Proto je účelné začínat s malými dávkami a postupně navyšovat podle tolerance do požadované dávky. Dále byla popsána cholelitiáza (kolem 1 %), vzestup aktivity amylázy a lipázy v séru, nicméně nebyly zjištěny významné odlišnosti v klinických projevech v porovnání s komparátory. Hypoglykemie se vyskytly u pacientů současně léčených inzulinem nebo deriváty sulfonylurey. Ojedinělé případy nádoru štítné žlázy (medulárního karcinomu) a zhoršení retinopatie při rychlém zlepšení kompenzace doplnily výčet nežádoucích účinků.
Semaglutid a jeho klinické využití
Semaglutid existuje jako první GLP-1RA ve dvou formách, jednak podávaný injekční cestou s prodlouženým působením s aplikací 1× týdně, a jednak jako vůbec první GLP-1RA ve formě tablet, které se podávají 1× denně. S oběma formami proběhly klinické studie, s injekční formou studie SUSTAIN 1-6, s perorální formou studie PIONEER 1-8. Vedle potvrzené bezpečnosti se obě skupiny studií mírně liší, ale spíše jen v intenzitě, a tím i klinické významnosti získaných výsledků.
Perorálně podávaný semaglutid se odlišuje od ostatních GLP-1RA vstřebáváním, které probíhá již v žaludku. Doporučuje se užívat tento semaglutid nalačno se zapitím asi 100–120 ml vody a následně vyčkat 30 minut. Po této době byla doložena maximální absorpce léku. Zároveň se doporučuje brát další léky až po uplynutí tohoto intervalu a stejně teprve pak konzumovat jídlo. Semaglutid zpomalující vyprazdňování žaludku může oddálit vstřebávání i ostatních léků.
Ve studiích PIONEER byl perorální semaglutid testován jednak v monoterapii proti placebu, jednak v kombinacích s inzulinem a dále proti aktivním komparátorům. Kombinace s inzulinem vedla ke snížení dávky inzulinu a k významnému zlepšení kompenzace diabetu. Efekt byl přitom srovnatelný s injekčním semaglutidem, ale při použití vyšší dávky perorálního semaglutidu. V dalších studiích byl demonstrován větší efekt na pokles glykovaného hemoglobinu u perorálního semaglutidu než u empagliflozinu nebo sitagliptinu, vedle toho hmotnost klesla významněji po perorálním semaglutidu než po sitagliptinu. Srovnání s liraglutidem, tedy již delší dobu používaným injekčním GLP/-1RA, ukázalo větší efekt perorálního semaglutidu na kompenzaci diabetu i na tělesnou hmotnost.
Vedle bezpečného působení perorálního semaglutidu u pacientů s diabetem 2. typu a renálním selháním nebo kardiovaskulárním onemocněním nebyla doložena superiorita na primární výstupy (endpointy) pro kardiovaskulární onemocnění v porovnání s placebem (nebyl rozdíl v MACE proti placebu na rozdíl od injekčního semaglutidu: ve studiích PIONEER-6 a SUSTAIN-6. U pacientů s chronickým onemocněním ledvin byla prokázána bezpečnost perorálního semaglutidu, ale nikoli zpomalení progrese onemocnění ledvin, jako je tomu po gliflozinech (SGLT-2 inhibitorech).
Poznámky pro praktické použití perorálního semaglutidu
Dosavadní studie prokázaly, že užívání perorálního semaglutidu je velmi účinné pro zlepšení kompenzace diabetu (efekt na glykemie nalačno i postprandiálně) a ke hmotnostnímu poklesu. Jeho dávka je podstatně vyšší než u injekčního preparátu (7 mg vs. 0,5 mg), což je potřeba zohlednit při převodu z jedné formy na druhou. Je bezpečným lékem u chronického onemocnění ledvin, ale nevede ke zpomalení rozvoje onemocnění. Zatím není doložena lepší prognóza u pacientů s aterosklerotickým kardiovaskulárním onemocněním v porovnání s injekčními GLP-1RA preparáty. Z hlediska vedlejších účinků je v popředí zejména nauzea, případně průjem na začátku terapie, které obvykle mizí při pokračování léčby. Je však proto třeba začínat s nízkou dávkou a postupně zvyšovat (3–7–14 mg).
Závěr
Perorální semaglutid zahájil nové období léčby hyperglykemie a obezity u diabetiků a vedle toho obezity u nediabetiků. Vzhledem k výše popsaným účinkům lze očekávat jeho postupné rozšíření včetně využití jeho dalších efektů v klinické praxi.
prof. MUDr. Jan Škrha, DrSc.
3. interní klinika 1. LF UK a VFN v Praze
