Podle klasických představ všechny účinky angiotenzinu II na cílové tkáně vznikaly působením na jediný typ receptoru. Situace se změnila v 80. letech, kdy byla na trh uvedena řada vysoce specifických ligandů pro receptory angiotenzinu II, pomocí kterých se podařilo identifikovat dva hlavní typy receptorů pro angiotenzin II (AT1 a AT2). Homologie se z molekulárního hlediska pohybuje pouze kolem 32–34 %.
Na rozdíl od člověka byly u některých jiných živočišných druhů, např. hlodavců, nalezeny ještě další podtypy receptorů. V posledních letech byly také u člověka nalezeny další receptory, jejich význam však není zatím objasněn.
Mechanizmus účinku AIIA
AT1 receptor zprostředkovává většinu klinicky známých účinků angiotenzinu II. Z biochemického hlediska se jedná o peptidový řetězec, který se u člověka vyskytuje od prvních týdnů gestace. U dospělého člověka byla jeho přítomnost prokázána především v kardiovaskulárním systému – na povrchu myocytů, endoteliálních buněk, fibroblastů, v hladkých svalových buňkách a periferních neuronech sympatiku.
Stimulace AT1 receptotů na presynaptických membránách neuronů vede k rychlému vyplavování noradrenalinu, k inhibici K+ kanálů a ke stimulaci Ca++ kanálů. Ve zdravém i selhávajícím srdci člověka je denzita AT1 receptorů zvýšena právě v oblasti nervových zakončení. Kromě kardiovaskulárního systému byla přítomnost AT1 receptorů prokázána v ledvinách, nadledvinách, endometriu, CNS, ale i na povrchu makrofágů, mononukleárů, trombocytů a osteoblastů.
Hustota AT1 receptorů je dynamická, jedním z hlavních regulačních mechanizmů ovlivňujících jejich denzitu je přítomnost angiotenzinu II, který již v nízkých koncentracích snižuje expresi genů kódujícho AT1 receptor. Chronické srdeční selhání je typickým příkladem down regulace exprese genu kódujícího AT1 receptor, při stárnutí organizmu byla naopak pozorována jejich up regulace.
V roce 1971 Pals popsal účinky saralazinu jako přímého neselektivního antagonisty angiotenzinu II. Hypotenzní efekt saralazinu se ukázal být velmi cenný k průkazu renin závislé hypertenze. Při nízkých plazmatických koncetracích angiotenzinu II však saralazin způsoboval výraznou presorickou odpověď, což bránilo jeho širšímu klinickému použití. Navíc tento preparát má velmi krátkou dobu účinku a malou biologickou dostupnost při perorálním užití, což vyžadovalo intravenózní podávání.
Také další vyvinuté preparáty (S-8307, S-8308, EXP 6155, EXP 6803, EXP 7711) neodstraňovaly plně výše uvedené nevýhody saralazinu. Teprve vývoj preparátu DuP 753, který byl později pojmenován losartan, vyřešil většinu problémů s předchozími substancemi (především krátkou dobu působení a nízkou dostupnost při perorálním podávání) a vedl k mohutnému rozvoji a dalšímu výzkumu v této oblasti i k vývoji dalších AT1 blokátorů, jako valsartan, kandesartan, ibesartan, telmisartan, tasosartan.
Rozdělení AIIA
Nebylo zatím vytvořeno jednotné dělení AT1 blokátorů a efekt je považován za skupinový, tedy pro jednotlivé preparáty srovnatelný. Farmakokinetické rozdíly jednotlivých nejčastěji užívaných preparátů ukazuje tabulka 1.
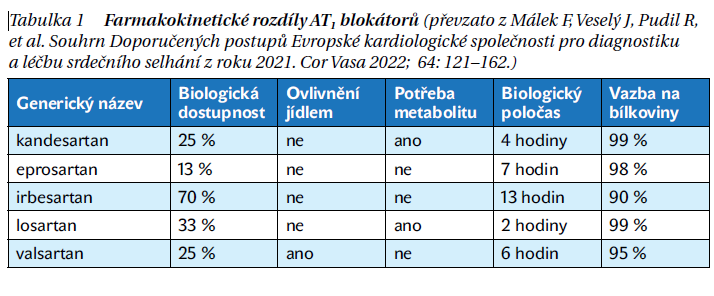
Základní charakteristika AIIA
Kandesartan – kompetitivní antagonista s dlouhým biologickým poločasem a vysokou afinitou k AT1 receptoru. Doporučená dávka je 8–16 mg, kontraindikací je gravidita a kojení.
Irbesartan – nepeptidový kompetitivní antagonista, s dlouhým biologickým poločasem (11–15 h), účinek nastupuje asi za 1 hodinu a maximum je za 2–4 hodiny. Doporučená dávka je 75–300 mg.
Losartan – nepeptidový kompetitivní antagonista s relativně dlouhým biologickým poločasem (6–9 h), s nástupem účinku za 1–3 hodiny a maximem účinku za 3–4 hodiny. K účinku potřebuje biotransformaci na aktivní metabolit. Doporučená dávka je 25–50 mg.
Telmisartan – nepeptidový antagonista se zvýšenou lipofilií a nekompetitivní, ale reverzibilní vysoce specifickou blokádou AT1 receptoru. Po perorálním podání je maximální koncentrace za 0,5–2 hodiny, eliminační poločas je asi 24 hodin a biologická dostupnost 40–60 %. Doporučená dávka je 20–80 mg.
Valsartan – nepeptidový kompetitivní antagonista, biologický poločas má 9 hodin, účinek nastupuje asi za 2 hodiny a maximum je za 4–6 hodin. Doporučená dávka je 80–160 mg, výhodné je podání 2× denně.
Kandesartan + amlopidin (Caramlo) – indikován jako substituční léčba dospělým pacientům s esenciální hypertenzí, jejichž krevní tlak je dostatečně kontrolován amlodipinem a kandesartanem podávaným současně ve stejné dávce. Pro běžné dávkování jsou k dispozici různé síly tohoto léčivého přípravku. Při dávce 16 mg kandesartanu-cilexetilu a 5 mg amlodipinu denně je podávána 1 tableta přípravku Caramlo 16 mg/5 mg. Maximální denní dávka kandesartanu-cilexetilu je 32 mg a maximální denní dávka amlodipinu je 10 mg. Přípravek Caramlo je kontraindikován u pacientů s těžkou poruchou funkce jater a u pacientů s cholestázou. U pacientů s lehkou až středně těžkou poruchou funkce ledvin není třeba upravovat dávkování (clearance kreatininu > 15 ml/min). U pacientů se středně těžkou poruchou funkce ledvin se doporučuje sledovat hladiny draslíku a kreatininu.
Obdobnou kombinací je léčivý přípravek s obsahem telmisartanu a amlodipinu (např. Tezefort).
Indikační kritéria u jednotlivých onemocnění
Hypertenze
Arteriální hypertenze představuje ve vyspělých zemích závažný zdravotní problém. Spolu s kouřením, diabetes mellitus (DM), dyslipidemií a obezitou (zejména abdominální) je jedním z nejzávažnějších rizikových faktorů kardiovaskulárních (KV) komplikací – cévních mozkových příhod (CMP), ischemické choroby srdeční (ICHS) a dalších projevů aterosklerózy. Prevalence hypertenze v ČR ve věku 25–64 let se pohybuje kolem 50 % u mužů a 34 % u žen se zřetelným nárůstem ve vyšších věkových skupinách. Podle dat Národního registru hrazených zdravotních služeb bylo v České republice v roce 2021 léčeno pro hypertenzi 1,9 milionu osob, což je 17,7 % populace. Kolem tří čtvrtin hypertoniků ví o své nemoci. Úspěšná kontrola hypertenze, tj. dosažení cílového krevního tlaku (TK), se daří u 30–37 % hypertoniků. Tyto údaje vycházejí ze screeningového vyšetření rozsáhlého náhodně vybraného vzorku obecné populace v letech 2016–2017.
Nefarmakologická léčba je součástí léčby všech nemocných s hypertenzí a její principy mají být vysvětleny každému jedinci, u něhož naměříme TK ≥ 140/90 mm Hg. Příznivý vliv antihypertenzní farmakologické léčby na výskyt KV příhod byl prokázán v mnoha studiích. Léčba hypertenze snižuje především výskyt CMP a srdečního selhání, v menší míře také výskyt ICHS, renálního selhání a fibrilace síní. Prospěšnost léčby je prokázána u různých forem hypertenze včetně hypertenze ve stáří a izolované systolické hypertenze.
Při farmakoterapii hypertenze pro monoterapii i kombinační léčbu užíváme v první řadě přípravky ze skupin, pro které jsou k dispozici data ze studií vyhodnocujících morbiditu a mortalitu na KV příhody. Jsou to následující třídy antihypertenziv: ACE inhibitory, blokátory receptorů angiotenzinu II (blokátory AT1 receptorů), dlouhodobě působící blokátory kalciových kanálů, thiazidová diuretika a jejich analoga a betablokátory.
AIIA patří k šesti základním lékovým skupinám, které byly Světovou zdravotnickou organizací označeny jako léky první volby hypertenze. Indikace a kontraindikace AIIA u hypertenze ukazuje tabulka 2.
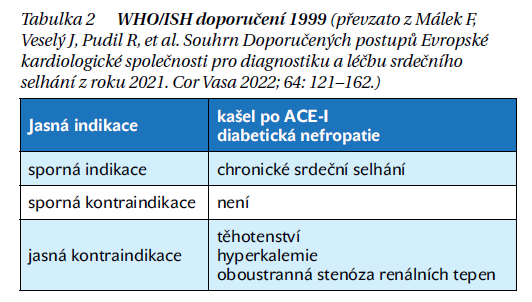
AIIA mají antihypertenzní účinek srovnatelný s jinými antihypertenzivy. Nebyla zatím provedena mortalitní studie, která by prokazovala větší efekt AIIA na snížení úmrtnosti než jiná antihypertenziva.
Inhibitory receptorů angiotenzinu II, typ AT1 AT1 blokátory (sartany), je možné využít k léčbě hypertenze v podobných indikacích jako ACE-I. Navíc jsou vhodné u nemocných s CHOPN. Také kontraindikace jsou stejné jako u ACE-I. Sartany nevyvolávají kašel jako ACE-I. Mají ze všech antihypertenziv nejméně nežádoucích účinků a nemocní léčení sartany vykazují nejlepší dlouhodobou perzistenci na léčbě. Po zahájení léčby sartany je nutné zkontrolovat hladinu draslíku a kreatininu.
Hlavní výhoda AIIA je především u nemocných, kde je indikována léčba ACE-I, tato však není tolerována pro suchý dráždivý kašel.
Pilotní i první větší klinické studie s AIIA v léčbě hypertenze prokázaly jejich velmi dobrou účinnost a nízký výskyt nežádoucích účinků, srovnatelný s placebem.
Chronické srdeční selhání
První klinická studie s losartanem u chronického srdečního selhání byla publikována v roce 1993. Na základě hemodynamických měření se jevila jako nejvýhodnější dávka 25 mg. Vyšší dávky již nepůsobily další vazodilataci, a tudíž dále neměnily srdeční hemodynamiku. Z neurohumorálních parametrů byl pozorován vzestup plazmatické reninové aktivity a vzestup hladin angiotenzinu II, zatímco koncentrace aldosteronu klesala.
Druhá studie s losartanem u srdečního selhání již sledovala 134 nemocných ve funkční třídě NYHA II–IV po dobu 12 týdnů. Příznivý hemodynamický efekt byl pozorován jak v akutním podání, tak po 12 týdnech léčby. Teprve po 12 týdnech však byl pozorován statisticky významný pokles tlaku v zaklínění, vzestup minutového srdečního výdeje a pokles tepové frekvence oproti placebu. Příznivý efekt léku podporoval i pokles hladiny aldosteronu a norepinefrinu po 12 týdnech léčby, naopak hladina reninu a angiotenzinu II, která významně stoupla po první dávce, byla při dlouhodobém podávání již statisticky nevýznamně vyšší. Z vedlejších sledovaných ukazatelů bylo pozorováno zmenšení kardiotorakálního indexu. Změny byly více vyjádřeny u dávek 25 či 50 mg než u dávek 2,5 a 10 mg.
Následující dvě ergometrické studie prokázaly podobný efekt losartanu a enalprilu na dobu trvání zátěže.
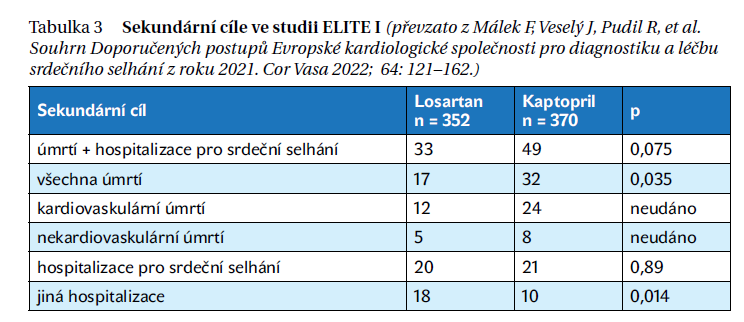
Studie ELITE 1 (Evaluation of Losartan In The Elderly – randomised trial of losartan versus captopril in patients over 65 with heart failure) sledovala 722 nemocných s chronickým srdečním selháním funkční klasifikace NYHA II–IV starších 65 let, kteří do té doby nebyli léčeni inhibitory ACE. K dosavadní léčbě byl nemocným přidán buď kaptopril v dávce 3× 50 mg (n = 370), nebo losartan v dávce 50 mg 1× denně (n = 352). Nemocní byli sledováni po dobu 48 týdnů a hlavním cílem studie bylo určit změny renálních funkcí, především hladiny kreatininu.
Vzestup plazmatické koncentrace kreatininu byl na konci studie v obou skupinách stejný (asi 10,5 %); primární cíl, tj. menší snížení renálních funkcí po losartanu, tedy nebyl prokázán.
Zajímavé jsou však některé vedlejší sledované ukazatele. Pro nežádoucí účinky byla léčba losartanem přerušena ve 12,2 %, zatímco léčba kaptoprilem ve 20,8 % (p = 0,002). Ani jeden nemocný léčený losartanem nepřerušil studii pro kašel na rozdíl od 14 nemocných ve skupině kaptoprilové.
Částečně překvapivé jsou výsledky sekundárního cíle, kterým byla úmrtnost a hospitalizace. Ve skupině léčené kaptoprilem bylo téměř 2× více úmrtí než ve skupině s losartanem, hospitalizace pro srdeční selhání byla v obou skupinách stejná. Výsledky jsou shrnuty v tabulce 3. Ke snížení celkové úmrtnosti došlo především snížením úmrtnosti na náhlou smrt a nebyl rozdíl v úmrtnosti na progresi srdečního selhání.
V červenci 1999 byla ukončena první mortalitní studie srovnávající ACE-I s AT1 blokátory u chronického srdečního selhání. Tato studie je známá pod názvem ELITE II (Effects of Losartan Versus Captopril on Mortality in Patients With Symptomatic Heart Failure). Studie probíhala ve 46 zemích, 289 centrech a zahrnula 3 152 nemocných, z čehož polovina byla zavzata v Evropě, čtvrtina v Severní Americe a čtvrtina v Jižní Americe.
Hlavní cíl vyplýval z překvapivého, ale velmi slibného výsledku studie ELITE, kde bylo pozorováno 46% snížení celkové úmrtnosti a 64% snížení úmrtnosti na náhlou smrt. Primárním cílem studie byla celková mortalita, sekundárním cílem úmrtnost na náhlou smrt.
Vstupním kritériem byl věk: > 60 let, NYHA II–IV, EF < 40 %, léčba ACE-I nesměla být delší než 7 dní v posledních 3 měsících, digitalis a/nebo diuretika byly doporučeny, léčba betablokátory byla součástí samostatné randomizace a celkově neměly být betablokátory u více než 25 % nemocných. Na léčbu kaptoprilem 3× 50 mg bylo randomizováno 1 574 nemocných, na léčbu losartanem 1× 50 mg 1 578 nemocných.
Studie byla ukončena po dosažení 530 úmrtí a průměrná doba sledování činila 555 dní.
Vstupní parametry nemocných randomizovaných do obou skupin se nelišily, průměrný věk byl 71,5 roku, 70 % randomizovaných tvořili muži, průměrná ejekční frakce byla 31,1 %, 51 % nemocných bylo ve funkčním stadiu NYHA III–IV, příčinou srdečního selhání byla v 80 % ischemická choroba srdeční. Doprovodná léčba betablokátory byla ve 24 %, aspirinem v 59 %, diuretika byla v 78 % a digitalis ve 49 %.
Průměrná roční mortalita byla 11 %. V kaptoprilové větvi zemřelo 250 (15,9 %) nemocných, v losartanové 280 (17,7 %) nemocných (p = 0,16, RR = 0,88). Náhlá smrt a resuscitace v kaptoprilové větvi byla ve 115 (7,3 %) případech, v losartanové ve 142 (9,0 %) případech (p = 0,08). Kombinovaný cíl celková úmrtnost a všechny hospitalizace se vyskytly u 707 (45 %) nemocných léčených kaptoprilem a u 752 (48 %) nemocných léčených losartanem (p = 0,21, RR = 0,94).
Výsledky studie ELITE II nepotvrdily nález ve studii ELITE. Z pohledu úmrtnosti a/nebo hospitalizací nebyl losartan lepší než kaptopril, naopak byl naznačen trend ve prospěch kaptoprilu.
Ve skupině léčené kaptoprilem se v 15,9 % vyskytl kašel a ve 3 % byl příčinou vyřazení ze studie, kašel ve skupině léčené losartanem se vyskytl v 8,6 % kašle a příčinou ukončení studie byl v 1 % (p < 0,001). Výskyt kašle potvrzuje předchozí údaje o nižším výskytu tohoto nežádoucího účinku po losartanu než po kaptoprilu.
Nebyl nalezen rozdíl v ovlivnění hladiny kalia či kreatininu mezi oběma skupinami.
Na základě těchto výsledků můžeme uzavřít, že ACE-I jsou nadále zlatým standardem léčby chronického srdečního selhání, AT1 blokátory jsou v této indikaci doporučeny u nemocných netolerujících ACE-I pro suchý kašel. V oblasti léčby hypertenze jsou však AT1 blokátory a ACE inhibitory rovnocenné. V zásadě lze tak shrnout, že základem léčby u většiny pacientů je inhibitor ACE či sartan. Nadále v některých lékařských
kruzích panuje mylná představa, že nejprve je vhodné zahájit léčbu inhibitorem ACE a teprve při rozvoji nežádoucích účinků zaměnit za sartan. Obě lékové třídy jsou ekvivalentní a je čistě v rukou lékaře, kterou skupinu si vybere v iniciální léčbě. Cochranova metaanalýza z roku 2014 ukázala, že sartany jsou srovnatelné s inhibitory ACE v ovlivnění celkové i kardiovaskulární mortality a incidenci kardiovaskulárních příhod s nižším výskytem nežádoucích účinků u pacientů s arteriální hypertenzí.
Ischemická choroba srdeční – infarkt myokardu
V posledních letech došlo k výraznému zlepšení léčby akutní fáze infarktu myokardu a stále více nemocných tuto akutní fázi přežívá. Je proto třeba nalézt jejich optimální dlouhodobou léčbu
Experimentální i klinická data ukazují, že užití ACE-I kaptoprilu v časné fázi infarktu myokardu vede ke snížení benigních i maligních arytmií. Užití ACE-I u nemocných se sníženou systolickou funkcí po akutním infarktu myokardu pak vede ke zmenšení objemu levé komory a zlepšení ejekční frakce ve srovnání s placebem. Užití ACE-I u nemocných po infarktu myokardu se sníženou, ale i se zachovanou ejekční frakcí, s i bez známek srdečního selhávání vede k výraznému zlepšení krátkodobé i dlouhodobé prognózy.
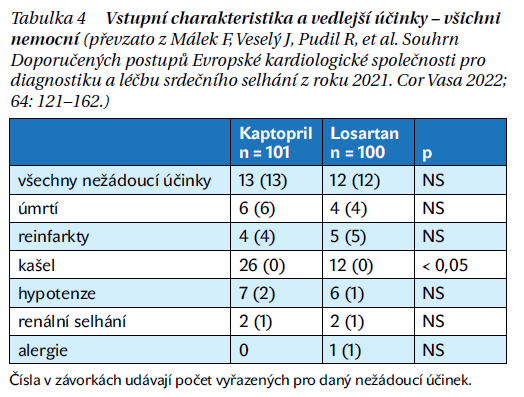
První větší klinická práce s AII antagonisty u srdečního selhání prokázala jejich bezpečnost, kdy výskyt nežádoucích účinků byl srovnatelný s ACE-I (tabulka 4).
AIIA blokátory doporučujeme těm pacientům po infarktu myokardu, u kterých je indikováno podávání ACE inhibitorů, pacient je však netoleruje pro suchý kašel.
Další indikace
Další indikace jsou shodné s indikacemi ACE-I v případě netolerance ACE-I pro suchý kašel.
Nežádoucí účinky a kontraindikace
Výskyt nežádoucích účinků je velmi nízký a v mnoha pracích srovnatelný s placebem. Zřídka se můžeme setkat se symptomatickou či asymptomatickou hypotenzí či se zhoršením renálních funkcí. Kontraindikací je zatím pouze gravidita a známá intolerance.
prof. MUDr. Jindřich Špinar, CSc.
I. interní kardioangiologická klinika, FNUSA
