Poslední dekáda přinesla signifikantní pokrok v terapii psoriázy díky nástupu moderních blokátorů interleukinu 17 a 23. Výrazně se tak posunul předpokládaný standard účinnosti léčby na alespoň 75% zlepšení oproti výchozímu stavu. Současně selektivní blokátory interleukinů prokazují velmi dobrý dlouhodobý bezpečnostní profil, který umožňuje nejen účinnou, ale také bezpečnou léčbu pacientů s psoriázou. Nejnovějším preparátem pro terapii psoriázy v této skupině je bimekizumab, který dále posouvá nároky na léčbu pacientů s psoriázou.
Bimekizumab je humanizovaná monoklonální protilátka IgG, inhibující signalizaci interleukinu (IL)-17A a IL-17F, která je indikována pro terapii středně těžké až těžké ložiskové psoriázy dospělých, u nichž je indikována systémová léčba. IL-17 je klíčovým efektorovým cytokinem v patogenezi psoriázy, na který jsou zaměřena i jiná další léčiva této skupiny (brodalumab, ixekizumab, sekukinumab). Duální blokáda obou podjednotek u bimekizumabu umožňuje rozsáhlejší kontrolu zánětlivého procesu díky výraznějšímu potlačení genové exprese, ale také omezení migrace a produkce zánětlivých cytokinů.
Způsob podání léčby
Bimekizumab se stejně jako ostatní biologické léky pro terapii psoriázy podává jako subkutánní injekce. Aplikují se vždy 2 injekce po 160 mg v týdnu 0, 4, 8, 12, 16 a následně každých 8 týdnů. Při dlouhodobé léčbě tak musí pacienti aplikovat léčbu pouze jedenkrát za každé 2 měsíce, což má pozitivní vliv na compliance pacientů. U obézních pacientů s tělesnou hmotností nad 120 kg, u nichž není dosaženo dostatečného efektu, je možné zkrátit interval na každé 4 týdny i v udržovacím režimu. Účinnost léčby je nutné hodnotit po 16 týdnech terapie, pokud pacient nedosáhne do této doby zlepšení alespoň o 75 % oproti výchozímu stavu (Psoriasis Area and Severity Index, PASI-75), je nutné terapii ukončit. V průběhu léčby je nutné monitorovat její účinnost a při opakovaném poklesu pod PASI-50 (zlepšení oproti stavu před léčbou alespoň o 50 %) nebo poklesu pod PASI-75 současně s negativním vlivem na kvalitu života pacienta je nutné taktéž terapii ukončit či změnit.
Kontraindikace
Léčba bimekizumabem je kontraindikována pouze u pacientů s hypersenzitivitou na léčivou látku nebo u pacientů s klinicky významnými aktivními infekcemi. Z toho důvodu se před zahájením léčby provádí screening na latentní tuberkulózu, HIV a hepatitidy. Pokud pacient má chronické infekční onemocnění, které je pod kontrolou, je možné po konzultaci s příslušným infekčním specialistou léčbu za pravidelných kontrol taktéž zahájit.
Účinnost v klinickém hodnocení
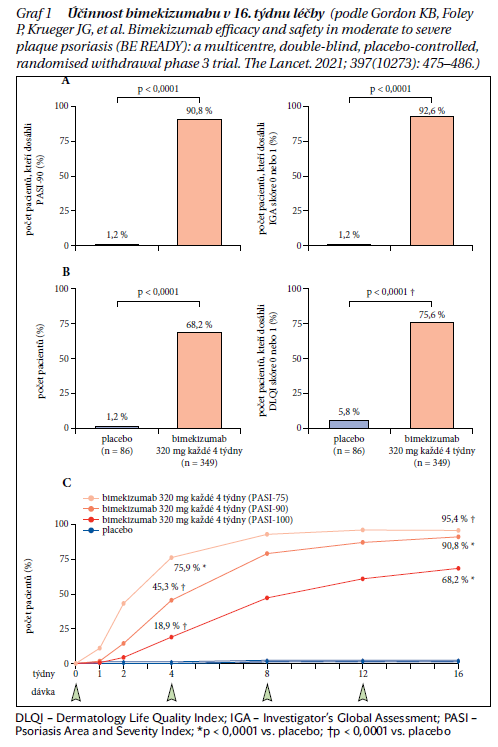
Ve třetí fázi klinického hodnocení byl bimekizumab porovnáván s placebem ve studii BE READY na 435 pacientech po dobu 56 týdnů. Do této studie nebyli zařazováni pacienti, u kterých v minulosti terapie blokátory IL-17 již selhala. V 16. týdnu studie dosáhlo hodnoty PASI-90 91 % pacientů na bimekizumabu oproti 1 % pacientů na placebu, obdobně úplného vymizení psoriázy (PASI-100) dosáhlo 68 % pacientů na bimekizumabu a jen 1 % pacientů na placebu (graf 1). Současně pacienti v rameni s bimekizumabem vykazovali již po několika týdnech výraznější zlepšení kvality života, hodnoceno Dermatology Life Quality Index (DLQI), i ústupu symptomů psoriázy, jako je svědění. Dlouhodobé hodnocení účinnosti a bezpečnosti až do 144 týdnů léčby probíhá v rámci extenze této studie nazvané BE BRIGT. Výsledky této studie nemáme zatím k dispozici, neboť by měla být ukončena až v průběhu letošního roku.
V rámci studie BE SURE byla účinnost bimekizumabu porovnávána s adalimumabem u 478 pacientů v průběhu 56 týdnů. Již po 4 týdnech terapie dosáhlo statisticky signifikantně více pacientů v ramenu s bimekizumabem účinnosti PASI-75 (76,5 vs. 31,4 %). Po 16 týdnech terapie přísnějšího kritéria PASI-90 dosáhlo 86,2 % pacientů na bimekizumabu oproti 47,2 % pacientům na adalimumabu. Pacienti, kteří byli po 16 týdnech terapie adalimumabem převedeni na bimekizumab, dosahovali po 56 týdnech léčby stejné účinnosti jako pacienti, kteří byli na terapii bimekizumabem od začátku studie (graf 2).
Studie BE RADIANT porovnávala účinnost bimekizumabem se sekukinumabem, který taktéž patří do skupiny blokátorů IL-17, a to na 743 pacientech v průběhu 48 týdnů. Po 16 týdnech léčby dosáhlo PASI-90 85,5 % pacientů léčených bimekizumabem a 70,5 % pacientů na sekukinumabu. Po 48 týdnech udrželo tuto odpověď 83,6 % pacientů na bimekizumabu a 70,5 % pacientů na sekukinumabu.
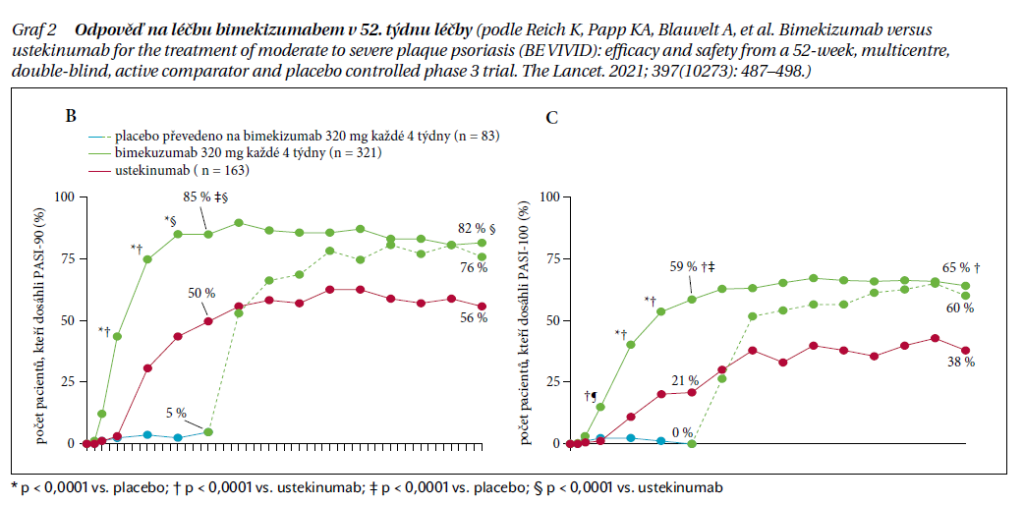
Poslední komparativní studií byla studie BE VIVID, ve které byl bimekizumab poměřován s ustekinumabem i placebem. Po 16 týdnech dosahovalo signifikantně více pacientů na bimekizumabu odpovědi PASI-90 (85 %) oproti pacientům na ustekinumabu (50 %) i na placebu (5 %). Po 52 týdnech léčby dosáhlo úplné remise psoriázy (PASI-100) 65 % pacientů na bimekizumabu oproti 38 % pacientů na ustekinumabu. Obdobně jako v předchozí studii pacienti, kteří užívali ustekinumab, byli po 16 týdnech převedeni do ramene s bimekizumabem, dosahovali stejné účinnosti jako pacienti s bimekizumabem od začátku studie.
Nežádoucí účinky
V rámci robustního klinického hodnocení máme k dispozici kvalitní bezpečností data o terapii bimekizumabem u více než 4 821 pacientů s psoriázou, psoriatickou artritidou či axiální spondylartritidou (tabulka 1). Nejčastěji hlášeným nežádoucím účinkem léčby byly stejně jako u ostatních biologických léčiv infekty horních cest dýchacích, hlavně charakteru nazofaryngitidy. Většina těchto infekcí měla mírný nebo nezávažný průběh. V placebem kontrolovaných studiích se infekce vyskytly u 36,0 % pacientů léčených bimekizumabem a 22,5 % pacientů léčených placebem. Výskyt závažných infekcí byl zaznamenán pouze u 0,3 % pacientů na terapii bimekizumabem.
U pacientů léčených bimekizumabem byla v rámci všech studií zaznamenána vyšší četnost orální a orofaryngeální kandidózy, která souvisí s mechanizmem účinku. Více než 98 % těchto případů však bylo nezávažných a nevyžadovalo přerušení léčby.
Při podávání bimekizumabu byly hlášeny nové případy nebo exacerbace zánětlivého střevního onemocnění, obdobně jako u jiných blokátorů IL-17. Bimekizumab se proto pro pacienty se zánětlivým střevním onemocněním nedoporučuje, neboť může dojít i k exacerbaci již existujícího zánětlivého střevního onemocnění.
Pacientům léčeným bimekizumabem nemají být podávány živé vakcíny (např. proti žluté zimnici). Je možné však podávat inaktivované (neživé vakcíny) s předpokladem normální imunologické odpovědi. Zdraví jedinci, kteří dostali jednu dávku bimekizumabu 2 týdny před vakcinací inaktivovanou vakcínou proti sezonní chřipce, měli podobné protilátkové odpovědi jako jedinci, kteří bimekizumab před vakcinací nedostali.
Ačkoliv nebyly v rámci klinického hodnocení provedeny žádné studie interakcí, neexistuje žádný důkaz o roli IL-17A nebo IL-17F při expresi enzymů CYP450. Bimekizumab je tedy možno podávat s jinými léčivy bez omezení.
Specifické populace
Bimekizumab by se neměl podávat v těhotenství a při kojení z preventivních důvodů, neboť tyto skupiny pacientek nejsou zařazovány do klinického hodnocení a údaje o podávání těhotným a kojícím jsou tak velmi omezené. Studie na zvířatech však nenaznačují přímé ani nepřímé škodlivé účinky na matku či plod. V současnosti je doporučováno, že by žena neměla otěhotnět dříve než 17 týdnů po ukončení léčby bimekizumabem. Není taktéž známo, zda se bimekizumab vylučuje do mateřského mléka.
Klinické hodnocení pro pacienty mladší 18 let dosud nebylo dokončeno, v budoucnu však lze očekávat, že bimekizumab, stejně jako ostatní léčiva skupina inhibitorů IL-17, bude možné využít u dětských pacientů.
Psoriatická artritida
Bimekizumab získal velmi recentně indikaci i na terapii axiální spondylartritidy a psoriatické artitidy. Bimekizumab je tak možné podat u dospělých s aktivní psoriatickou artritidou, kteří nemají adekvátní odpověď nebo intoleranci na jeden nebo více chorobu modifikujících antirevmatických léků, a to jak v monoterapii, tak v kombinaci s methotrexátem. Účinnost a bezpečnost bimekizumabu u pacientů s psoriatickou artritidou byla hodnocena v rámci studie BE OPTIMAL na 852 pacientech v průběhu 52 týdnů. Po 16 týdnech léčby dosáhlo hodnoty ACR50 44 % pacientů užívajících bimekizumab, 46 % pacientů užívajících adalimumab a 10 % pacientů užívajících placebo. Účinnost bimekizumabu na psoriatickou artritidu byla superiorní nad placebem a obdobná adalimumabu i v dalších hodnocených kritériích.
Závěr
Bimekizumab je v současnosti nejnovějším dostupným lékem pro terapii středně závažné a závažné plakové psoriázy. Jeho hlavní předností je extrémně rychlý nástup účinku, kdy pacienti mohou pozorovat výrazné zlepšení již v rámci dnů až jednotek týdnů od zahájení léčby. Podle dostupných metaanalýz se taktéž zdá, že při terapii bimekizumabem mají pacienti největší šanci na dosažení úplného vymizení kožních projevů psoriázy (PASI-100). Současně pacientům taktéž nabízí příjemný aplikační interval, s nutností aplikace léčiva pouze jednou za 2 měsíce v rámci udržovací léčby. Bezpečnostní profil bimekizumabu je velmi dobrý, obdobný ostatním moderním biologickým léčivům psoriázy, s výjimkou zvýšeného rizika mykotických, převážně mukokutánních kandidových infekcí.
doc. MUDr. Filip Rob, Ph.D.
Dermatovenerologická klinika 2. LF UK a FN Bulovka
