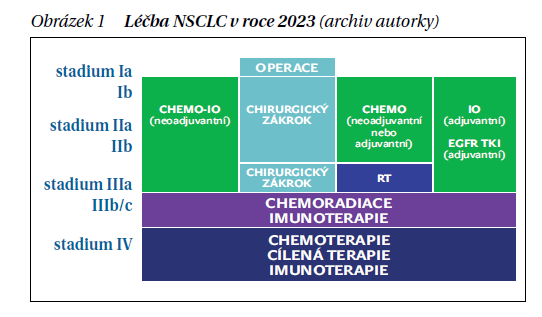
Imunoonkoterapie je již řadu let standardem léčby metastatického nemalobuněčného karcinomu plic (NSCLC). V 1. linii léčby metastatického NSCLC přibývají aktualizovaná data celkového přežití z řady studií, která potvrzují její účinnost. Následovalo její zavedení do klinické praxe v léčbě lokálně pokročilého inoperabilního NSCLC. Nyní jsme svědky jejího posunu i do léčby časných resekabilních stadií NSCLC s cílem zabránit recidivám u pacientů po radikální operaci.
Metastatický nemalobuněčný karcinom plic (NSCLC) je onemocněním s nepříznivou prognózou a u pacientů s onemocněním v pokročilém, metastatickém stadiu léčených pouze chemoterapií byl medián celkového přežití (OS) udáván 8–10 měsíců (obrázek 1). K dramatickému obratu v prodloužení OS došlo při zavedení testování genetických aberací, kdy při zjištění některých z nich je indikována cílená léčba, jejíž možnosti se stále rozšiřují. Dalším výrazným pokrokem pak bylo zavedení checkpoint inhibitorů do klinické praxe. V 1. linii léčby byly zpočátku indikovány při průkazu vysoké exprese PD-L1 (ligand receptoru programované buněčné smrti) na nádorových buňkách (tumor proportionscore, TPS ≥ 50 %), následně pak v kombinaci s chemoterapií u negativní a nižší exprese PD-L1 (TPS 1–49 %). Prospěch z léčby monoklonálními protilátkami proti PD-l/PD-L1 však mají i pacienti s lokálně pokročilým onemocněním po předchozí chemoradioterapii, pokud při ní nedojde k progresi onemocnění. Nejnověji jsou k dispozici i výsledky studií s imunoonkoterapií u pacientů s časnými, operabilními stadii onemocnění, kdy je podávána s neoadjuvantním či adjuvantním záměrem.
U řady studií máme k dispozici již aktualizované výsledky s mediánem OS 5 let.
Imunoterapie v 1. linii léčby metastatického NSCLC
Studie KEYNOTE-024
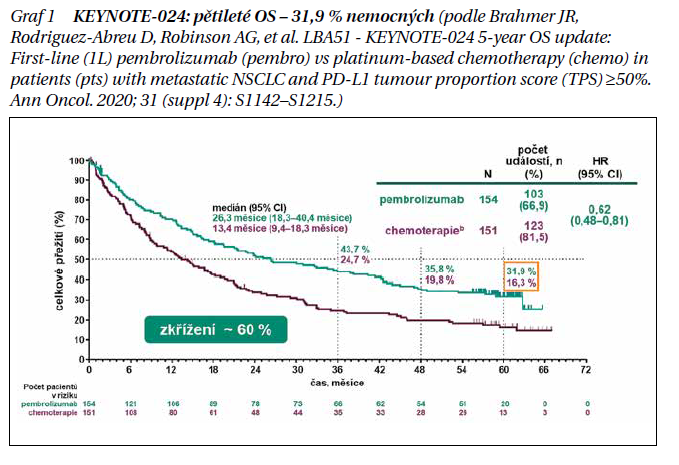
KEYNOTE-024 je otevřená, randomizovaná, kontrolovaná studie fáze III porovnávající pembrolizumab s chemoterapií na bázi platiny u pacientů s dosud neléčeným NSCLC s expresí PD-L1 ≥ 50 % a bez senzibilizujících změn EGFR/ALK. Vhodní pacienti byli náhodně přiřazeni (1 : 1) k pembrolizumabu (200 mg jednou za 3 týdny po dobu až 35 cyklů), nebo chemoterapii na bázi platiny. Pacienti ve skupině chemoterapie při progresi onemocnění mohli přejít na pembrolizumab. Primárním cílovým ukazatelem bylo přežití bez progrese (PFS), OS byl sekundární cílový parametr. Náhodně bylo rozděleno 305 pacientů: 154 do ramene s pembrolizumabem a 151 do ramene s chemoterapií. Medián doby od randomizace do ukončení dat (1. června 2020) byl 59,9 (55,1–68,4) měsíce. Mezi pacienty původně přiřazenými k chemoterapii dostalo 99 následnou terapii anti-PD-1 nebo PD-L1, což představuje 66,0% efektivní míru zkřížení. Medián OS byl 26,3 měsíce (95% CI 18,3–40,4) pro pembrolizumab a 13,4 měsíce (9,4–18,3) pro chemoterapii (HR, 0,62; 95% CI 0,48–0,81). Kaplanovy–Meierovy odhady míry 5letého OS byly 31,9 % pro skupinu s pembrolizumabem a 16,3 % pro skupinu s chemoterapií (graf 1); 39 pacientů dokončilo 35 cyklů (tj. přibližně 2 roky) pembrolizumabu, z nichž 82,1 % bylo stále naživu v době analýzy (přibližně 5 let). Toxicita se při delší expozici nezvyšovala. Pembrolizumab prokázal trvalý klinicky významný dlouhodobý přínos pro OS oproti chemoterapii jako první linie léčby metastatického NSCLC s expresí PD-L1 ≥ 50 %.
Studie KEYNOTE-189
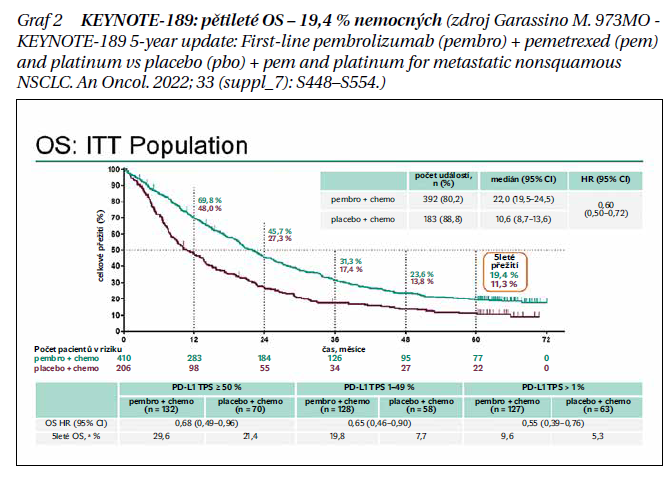
Kombinace pembrolizumab (pembro) + pemetrexed (pem)-platina významně zlepšila přežití oproti placebu (pbo) + pemetrexed-platina u pacientů s dříve neléčeným metastatickým neskvamózním NSCLC bez senzibilizujících změn EGFR/ALK, bez ohledu na expresi PD-L1, ve studii fáze III KEYNOTE-189. Na kongresu ESMO 2022 byly prezentovány aktualizované výsledky pětiletého sledování. Pacienti byli randomizováni v poměru 2 : 1 k pembro 200 mg nebo placebu Q3W po dobu až 35 cyklů (2 roky). Všichni pacienti také dostávali 4 cykly pemetrexedu podle výběru zkoušejícího s karboplatinou/cisplatinou, po nichž následovala udržovací léčba pemetrexedem až do progrese/nepřijatelné toxicity. Při progresi byl povolen přechod ze skupiny placeba + pem-platina na monoterapii pembro. Primárními cílovými parametry byly OS a PFS. Mezi 616 randomizovanými pacienty (pembro + pem-platina, n = 410; pbo + pem-platina, n = 206) byl medián doby od randomizace do ukončení dat (8. března 2022) 64,6 (60,1–72,4) měsíce. 116/202 (57,4 %) léčených pacientů přešlo z pbo + pem-platiny na anti-PD-1 nebo anti-PD-L1 terapii během/mimo studii. Medián (95% CI) OS byl 22,0 (19,5‒24,5) měsíce vs. 10,6 (8,7‒13,6) měsíce s pembro + pem-platina vs. pbo + pem-platina (HR 0,60; 95% CI 0,72) a 5letá míra OS byla 19,4 vs. 11,3 % (graf 2). Medián (95 % CI) PFS byl 9,0 (8,1‒10,4) měsíce vs. 4,9 (4,7‒5,5) měsíce (HR 0,50; 95% CI 0,42‒0,60). Mezi pacienty s 1 dávkou přidělené léčby se NÚ stupně 3‒5 vyskytly u 295/405 (72,8 %) vs. 136/202 (67,3 %) pacientů. Mezi 57 pacienty, kteří dokončili 35 cyklů pembra, byla celková odpověď (ORR) 86,0 % (kompletní regrese CR 8; částečná regrese PR 41). Míra OS za 3 roky po dokončení 35 cyklů pembra byla 71,9 %. První linie pembro + pem-platina nadále vykazovala přínosy OS a PFS se zvládnutelnou toxicitou oproti pbo + pem-platina, bez ohledu na expresi PD-L1. Pacienti, kteří dokončili 35 cyklů pembra, zaznamenali trvající odpovědi. Tato data dále podporují pembro + pem-platina jako standard léčby první linie metastatického neskvamózního NSCLC bez senzibilizujících změn EGFR/ALK.
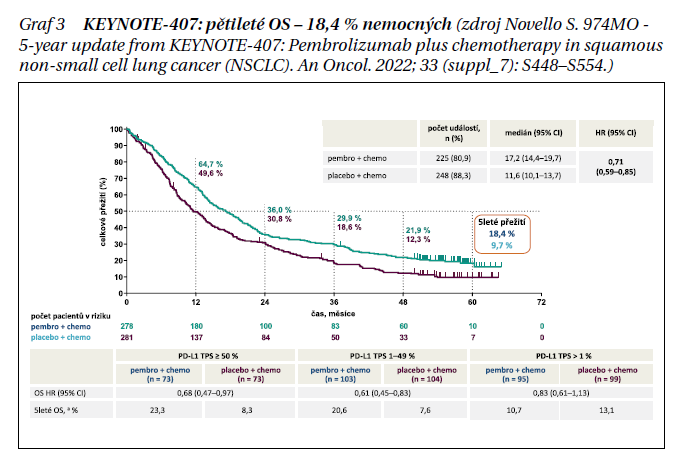
Studie KEYNOTE- 407 Kombinace pembrolizumab (pembro) + chemoterapie na bázi platiny významně prodloužily OS a PFS ve srovnání s placebem + chemoterapií u pacientů s dříve neléčeným metastatickým skvamózním NSCLC ve studii fáze III KEYNOTE-407. Uvádíme výsledky po 5 letech v populaci Intent-to-Treat (ITT), tj. všichni zařazení pacienti, a u pacientů, kteří dokončili 35 cyklů pembra (2 roky). Vhodní pacienti byli randomizováni v poměru 1 : 1 k podávání pembra 200 mg nebo placeba + karboplatiny a paklitaxelu/nab-paklitaxelu Q3W po 4 cykly, po nichž následovalo pembro nebo placebo až do 35 cyklů. Způsobilým pacientům ve skupině placebo + chemo bylo umožněno přejít během studie až na 35 cyklů otevřené monoterapie pembro po odslepení a po ověření progrese onemocnění (PD) pomocí BICR (zaslepené nezávislé centrální hodnocení). Primárními cílovými parametry byly OS a PFS podle RECIST v1.1 podle BICR. Pacienti byli randomizováni do skupiny pembro + chemo (n = 278) nebo placebo + chemo (n = 281). K 23. únoru 2022 byl medián doby od randomizace do ukončení dat 56,9 (49,9–66,2) měsíce; 117 pacientů přešlo ze skupiny placebo + chemo na monoterapii pembro a dalších 26 pacientů dostalo následnou anti-PD-1/PD-L1 terapii; efektivní míra zkřížení byla 51,1 %. Medián OS v populaci ITT byl 17,2 měsíce pro skupinu pembro + chemo a 11,6 měsíce pro skupinu s placebem + chemo; HR 0,71 (95% CI 0,59– 0,85). Příslušné pětileté míry OS byly 18,4 a 9,7 % (graf 3). AE stupně 3‒5 se vyskytly u 74,8 a 70,0 % pacientů ve skupinách pembro + chemo a placebo + chemo. Mezi 55 pacienty, kteří dokončili 35 cyklů pembra, byla ORR 90,9 % a míra OS ve 3 letech po dokončení 35 cyklů (⁓5 let po randomizaci) 69,5 %. Po 5 letech sledování pembro + chemo nadále vykazovalo prodloužené OS a PFS oproti samotné chemoterapii bez zvýšené toxicity. Většina pacientů, kteří dokončili 35 cyklů, měla objektivní odpovědi a byla naživu v okamžiku analýzy dat. Tato dlouhodobá data podporují použití pembro + chemo jako standardní možnosti léčby první linie u metastatického skvamózního NSCLC.
Studie CheckMate 9LA
Tato studie fáze III prokázala, že kombinace NIVO + IPI + 2 cykly chemoterapie v 1. linii léčby u pacientů s metastatickým NSCLC poskytuje lepší přežití ve srovnání se samotnou chemoterapií. Pacienti ve stadiu IV nebo s rekurentním NSCLC, bez senzibilizujících změn EGFR/ALK byli randomizováni 1 : 1 k NIVO 360 mg Q3W + IPI 1 mg/kg Q6W + 2 cykly chemoterapie (n = 361) nebo 4 cykly samotné chemoterapie (n = 358). Pacienti byli stratifikováni podle exprese PD-L1 nádoru, pohlaví a histologie. Pacienti s neskvamózním (NSQ) NSCLC v rameni s chemoterapií mohli dostávat udržovací léčbu pemetrexedem. Hodnocení zahrnovalo OS, PFS a ORR. Pro všechny pacienty s NSQ NSCLC a se tkání pro hodnotitelnou mutační analýzu (n = 313) byl použit test FoundationOne CDxTM k identifikaci mutací nebo divokého typu genů KRAS a STK11. Při minimální době sledování 36,1 měsíce (uzavření databáze 15. února 2022) pacienti nadále získávali dlouhodobý, trvanlivý přínos pro OS v rameni s NIVO + IPI + chemo vs. chemo (HR, 0,74, 95% CI 0,62–0,87); 3letý OS byl 27 vs. 19 %. Klinický přínos s NIVO + IPI + chemo vs. chemo byl pozorován u všech randomizovaných pacientů a napříč většinou podskupin, včetně úrovně exprese PD-L1 nebo histologie. Přínos přežití NIVO + IPI + chemo vs. chemo byl pozorován bez ohledu na stav mutace KRAS a STK11.
Imunoterapie v léčbě lokálně pokročilého NSCLC
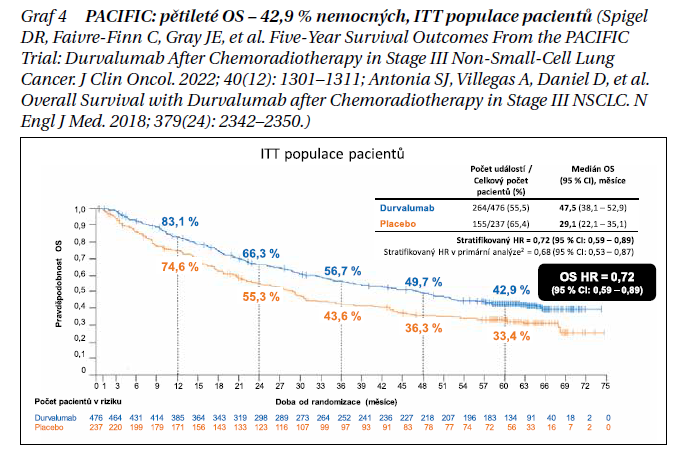
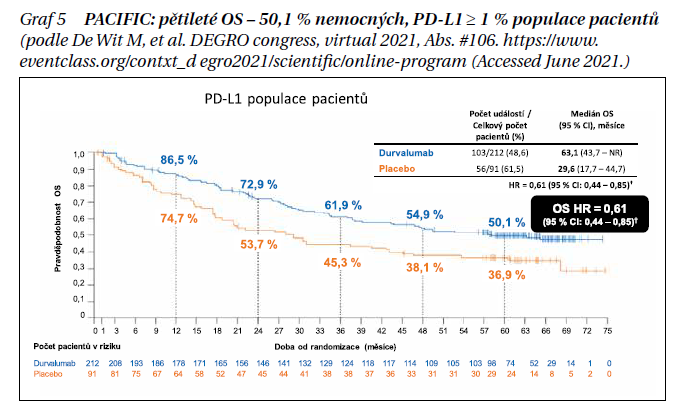
Studie PACIFIC V placebem kontrolované studii fáze III PACIFIC u pacientů s neresekovatelným NSCLC stadia III, jejichž onemocnění neprogredovalo po souběžné chemoradioterapii na bázi platiny (cCRT), zlepšil durvalumab OS (HR 0,68; 95 % CI 0,53–0,87; p = 0,0025; mezní hodnota dat [DCO] 22. března 2018) a PFS (HR 0,52, 95% CI 0,42–0,65; p < 0,0001; DCO 13. února 2017). Na základě DCO použitých pro primární analýzy míra prospěchu zůstala konzistentní i v dalších aktualizacích. Ve srovnání s placebem byl durvalumab spojen se zvládnutelným bezpečnostním profilem a neměl nepříznivý vliv na výsledky hlášené pacienty. Na virtuálním ASCO 2021 byly prezentovány aktualizované průzkumné analýzy OS a PFS, hodnocené přibližně 5 let po randomizaci posledního pacienta. Pacienti s WHO PS 0/1 (a jakýmkoli nádorovým stavem PD-L1), jejichž onemocnění po cCRT neprogredovalo (≥ 2 překrývající se cykly), byli randomizováni (2 : 1) 1–42 dní po cCRT (typická celková dávka radioterapie 60–66 Gy ve 30–33 frakcích) k podání 12měsíčního durvalumabu (10 mg/kg i. v. každé 2 týdny) nebo placeba, rozvrstvené podle věku (< 65 vs. ≥ 65 let), pohlaví a historie kouření (současný/dřívější kuřák vs. nikdy nekouřil). Primárními cílovými parametry byly OS a PFS (zaslepený nezávislý centrální přehled; RECIST v1.1) v populaci ITT. HR a 95% CI byly odhadnuty pomocí stratifikovaných log-rank testů v populaci ITT. Mediány a míry OS/PFS po 60 měsících byly odhadnuty Kaplanovou–Meierovou metodou. Celkově bylo 709/713 randomizovaných pacientů léčeno buď v rameni s durvalumabem (n/N = 473/476), nebo placebem (n/N = 236/237). Poslední pacient absolvoval studijní léčbu v květnu 2017. K 11. lednu 2021 (medián doby sledování 34,2 měsíce u všech pacientů, rozmezí 0,2–74,7 měsíce), aktualizovaný OS (HR 0,72, 95% CI 0,59–0,89; medián 47,5 vs. 29,1 měsíce) a PFS (stratifikovaná HR 0,55, 95% CI 0,45–0,68; medián 16,9 vs. 5,6 měsíce) zůstaly v souladu s výsledky primárních analýz. Míra 60měsíční OS byla 42,9 a 33,4 % s durvalumabem a placebem (graf 4), 60měsíční četnost PFS byla 33,1 a 19,0 %. Pokud se vezme v úvahu podskupina pacientů s expresí PD-L1 ≥ 1 %, tedy kritérium odpovídající schválené indikaci EMA, míry 60měsíčních OS byly 50,1 % v rameni s durvalumabem a 36,9 % v rameni s placebem a odpovídající mediány OS u této skupiny pacientů činily 63,1 a 29,6 měsíce (graf 5). Tyto aktualizované analýzy přežití, založené na 5letých datech ze studie PACIFIC, demonstrují robustní a trvalý přínos OS a PFS.
Imunoterapie v léčbě časných, operabilních stadií NSCLC
Studie CheckMate 816
V neoadjuvanci ve studii fáze III CheckMate 816u pacientů s kompletně resekovaným NSCLC stadia IB (T ≥ 4 cm) až IIIA (AJCC v7), byly hlavními ukazateli výsledku účinnosti přežití bez příhody (Event-Free Survival – EFS) a patologická kompletní odpověď (pathological complete responce – pCR). Medián EFS byl 31,6 měsíce (95% CI 30,2–nedosaženo) ve větvi NIVO + chemo vs. 20,8 měsíce (95% CI 14,0–26,7) ve větvi se samotnou chemo, HR 0,63 (97,38% CI 0,43–0,91, p = 0,0052). Míra pCR byla 24 % (95% CI 18,0–31,0) v rameni s NIVO + chemo vs. 2,2 % (95% CI 0,6–5,6) v rameni se samotnou chemo. Na základě těchto výsledků v dubnu 2022 schválil FDA nivolumab s platinovou dubletovou chemoterapií (3 cykly) pro dospělé pacienty s resekovatelným NSCLC v neoadjuvantní léčbě a následně v červnu 2023 EMA.
Studie IMpower010
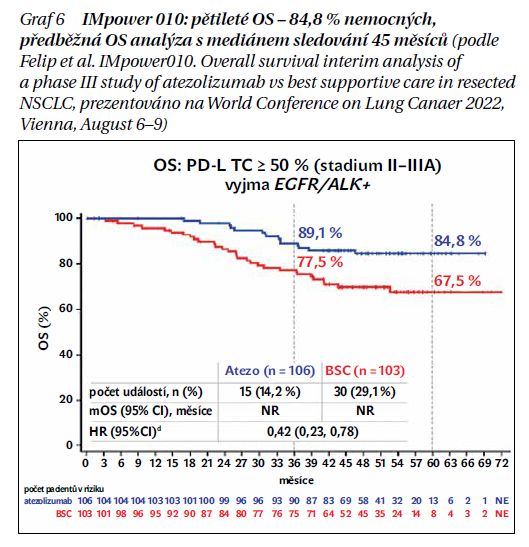
Ve studii fáze III IMpower010 byl porovnáván atezolizumab (atezo) s nejlepší podpůrnou péčí (BSC) po adjuvantní chemoterapii u pacientů s resekovaným NSCLC. Do studie byli zařazeni pacienti po kompletní resekci (4–12 týdnů před zařazením) stadia IB (≥ 4 cm) – IIIA NSCLC (AJCC verze 7) a ECOG PS 0-1. Celkem bylo zařazeno 1 280 pacientů a 1 269 pacientů dostalo až čtyři 21denní cykly chemoterapie na bázi cisplatiny (plus pemetrexed, docetaxel, gemcitabin nebo vinorelbin). Z těchto pacientů bylo 1 005 následně randomizováno 1 : 1 k 16 cyklům atezo 1 200 mg Q3W nebo BSC. Primární cílový parametr přežití bez nemoci (disease free survival – DFS) hodnocený zkoušejícím a sekundární, OS, byly testovány hierarchicky: nejprve DFS v podskupině PD-L1 TPS ≥ 1 % (SP263) s onemocněním stadia II–IIIA, poté DFS u všech randomizovaných pacientů stadia II–IIIA, poté DFS v populaci ITT (stadium IB–IIIA) a nakonec OS v populaci ITT. Při uzavření dat (21. ledna 2021) byl medián sledování 32,2 měsíce v populaci ITT. 24měsíční DFS bylo 74,6 % v rameni s atezo ve srovnání s 61,0 % v rameni BSC. Po 36 měsících bylo DFS 60,0 % s adjuvantním atezo vs. 48,2 %. Medián DFS nebyl dosažen (95% CI 36,1–NE) v rameni s atezo oproti 35,3 měsíce (95% CI 29,0–NE) v rameni BSC (stratifikovaná HR, 0,66; 95% CI 0,50–0,88, P = 0,0004). Výrazný prospěch z adjuvantního atezo oproti BSC měli pacienti s expresí PD-L1 ≥ 50 % (HR 0,43, 95% CI 0,27–0,65). Rovněž předběžná analýza OS prezentovaná na WCLC 2022 s mediánem sledování 45 měsíců (HR 0,42, 95% CI 0,23–0,78) ukázala prospěch z adjuvantní imunoterapie (graf 6). Ve studii nebyly pozorovány žádné nové bezpečnostní signály. V adjuvantní větvi s atezo se u 92,7 % pacientů vyskytly NÚ jakéhokoli stupně ve srovnání se 70,7 % ve větvi BSC. Na základě těchto výsledků EMA v červnu 2022 schválila atezolizumab jako první adjuvantní imunoterapii po kompletní resekci a chemoterapii na bázi platiny pro dospělé s NSCLC s vysokým rizikem recidivy, jejichž nádory exprimují PD-L1 ≥ 50 % a kteří nemají EGFR mutovaný nebo ALK pozitivní NSCLC. Od 1. 3. 2023 je tato léčba hrazena z veřejného zdravotního pojištění i v České republice.
Studie PEARLS/KEYNOTE-091
Účinnost pembrolizumabu v adjuvantní léčbě po resekci a chemoterapii na bázi platiny u NSCLC stadia IB (T2a ≥ 4 cm) až IIIA byla hodnocena ve studii fáze III PEARLS/KEYNOTE-091. Pacienti byli randomizováni (1 : 1) k podávání pembrolizumabu 200 mg nebo placeba intravenózně každé 3 týdny po dobu až 1 roku. Z 1 177 randomizovaných pacientů dostalo 1 010 (86 %) adjuvantní chemoterapii na bázi platiny po kompletní resekci. Hlavním měřítkem výsledku účinnosti bylo přežití bez onemocnění (DFS) hodnocené zkoušejícím. Studie splnila svůj primární cíl a prokázala statisticky významné zlepšení DFS v celkové populaci. V explorativní analýze podskupin 167 pacientů, kteří nedostávali adjuvantní chemoterapii, byl poměr rizika DFS 1,25 (95% CI 0,76–2,05). U pacientů, kteří dostávali adjuvantní chemoterapii, byl medián DFS 58,7 měsíce v rameni s pembrolizumabem (95% CI 39,2–nedosaženo) a 34,9 měsíce v rameni s placebem (95% CI 28,6–nedosaženo) (HR 0,73, 95% CI 0,60–0,89). V lednu 2023 schválil FDA pembrolizumab pro adjuvantní léčbu po resekci a chemoterapii na bázi platiny u NSCLC stadia IB (T2a ≥ 4 cm) až IIIA.
Závěr
S rozšiřujícími se možnostmi imunoonkoterapie NSCLC jsme svědky dlouhodobé léčebné odpovědi u řady pacientů. Potvrzují to i aktualizované výsledky pětiletého celkového přežití v řadě studií, se kterými jsme se dříve u pokročilého onemocnění bez prokázaných genetických aberací nesetkávali. Její posun do časných, operabilních stadií v neoadjuvantním či adjuvantním podání ukazuje na významné snížení rizika recidivy onemocnění u pacientů po radikální operaci.
MUDr. Leona Koubková
Pneumologická klinika 2. LF UK a FN v Motole
