Jsou uvedeny kategorizace kardiovaskulárního rizika s doporučenými hladinami LDL cholesterolu jako primárního cíle terapie. V moderní farmakologické léčbě dyslipidemie se i nadále uplatňují především statiny. Článek se však věnuje především novějším lékům, které se již v praxi používají (PCSK9 inhibitory), a hodnotí rovněž efekt inklisiranu, který by měl být do praxe zaveden v nejbližší době.
Kardiovaskulární (KV) onemocnění stále představují hlavní příčinu mortality. Jejich základním rizikovým faktorem je dyslipidemie (DLP), jejíž incidence je v ČR 20 % (podle výzkumu uskutečněného v roce 2016 u 40letých mužů a 50letých žen). Její ovlivnění hraje klíčovou roli v časnosti rozvoje KV onemocnění. Kromě časné diagnostiky je důležité také načasování zahájení léčby DLP. Příznivý vliv kompenzace se kumuluje v čase, napodobuje geneticky dané nižší KV riziko a vede k prevenci progrese aterosklerózy a manifestace KV onemocnění.
Kategorizace KV rizika a cílové hodnoty LDL cholesterolu
Podle doporučení EAS (European Atherosclerosis Society) i ČSAT (Česká společnost pro aterosklerózu) je cílovým parametrem při léčbě dyslipidemií LDL cholesterol, jehož role v patogenezi a v mortalitě na KV onemocnění byla opakovaně potvrzena mnoha rozsáhlými studiemi. Sekundárními cíli v léčbě DLP jsou non-HDL cholesterol a apolipoprotein B (apoB). Cílovou hodnotu a vhodnost zahájení farmakoterapie DLP pro konkrétného pacienta určíme po zařazení do příslušné kategorie KV rizika (tabulka 1).
Tabulka 1 Kategorizace kardiovaskulárního rizika (podle Vrablík M et al. Stanovisko výboru ČSAT k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2019)

V kategorii velmi vysokého KV rizika se doporučuje dosáhnout cílových hladin LDL cholesterolu pod 1,4 mmol/l (anebo snížení LDL cholesterolu alespoň o 50 % výchozí hodnoty, sekundární cíle: non-HDL cholesterol < 2,2 mmol/l, apoB < 0,65 g/l).
V kategorii vysokého rizika se doporučuje dosáhnout cílových hladin LDL cholesterolu pod 1,8 mmol/l (anebo snížení LDL cholesterolu alespoň o 50 % výchozí hodnoty, sekundární cíle: non-HDL cholesterol < 2,6 mmol/l, apoB < 0,8 g/l).
V kategorii středního rizika se doporučuje dosáhnout cílových hladin LDL cholesterolu pod 2,6 mmol/l (anebo snížení LDL cholesterolu alespoň o 50 % výchozí hodnoty, sekundární cíle: non-HDL cholesterol < 3,4 mmol/l, apoB < 1,0 g/l).
Statiny jako základní pilíř léčby dyslipidemie
Statiny, i když se jedná o léky používané již několik desetiletí, představují stále základní pilíř léčby DLP (jak smíšené DLP, tak čisté hypercholesterolemie), protože jsou schopny významně snížit KV riziko i mortalitu. Jejich nasazení by mělo být co nejčasnější, když se zjistí, že se nepodařilo dosáhnout cílových hodnot lipidogramu pro příslušnou kategorii KV rizika (tabulka 1). Mechanizmus účinku statinů spočívá ve snížení endogenní syntézy cholesterolu v játrech díky inhibici HMG-CoA reduktázy. To následuje zvýšená exprese LDL receptorů, které ve větší míře vychytávají apoB obsahující cirkulující částice (zejména LDL, ale také VLDL) z krve. Léčbu statiny provází pokles celkového cholesterolu, a to v průměru o 20–40 %, LDL cholesterolu o 25–60 %, triglyceridů o 5–20 % a vzestup HDL cholesterolu o 5–10 %. Preferovat bychom měli vysoké a střední dávky vysoce potentních statinů (atorvastatin a rosuvastatin), abychom dosáhli uvedených ambiciózních cílových hodnot LDL cholesterolu.
Jak ukazuje schéma 1 s doporučeným postupem terapie, měli bychom v případě nedosažení cílových hodnot pomocí maximální či maximálně tolerované dávky statinů přidat do kombinace ezetimib – v dávce 10 mg snižuje celkový cholesterol o 13 %, LDL cholesterol o 19 %, apoB o 14 %, triglyceridy o 8 % a zvyšuje koncentraci HDL cholesterolu o 3 %. Pokud je ezetimib podán současně se statinem, dochází ve srovnání s monoterapií statinem k další zhruba 20% redukci LDL cholesterolu.
Schéma 1 Doporučený postup terapie hypercholesterolemie (podle Vrablík M et al. Stanovisko výboru ČSAT k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2019)
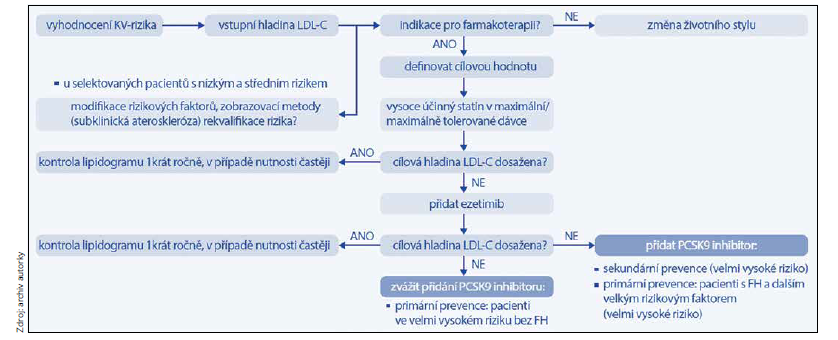
Pokud ani při této terapii není dosaženo cílových hodnot LDL cholesterolu, přichází na řadu léčba PCSK9 inhibitory.
Inhibitory PCSK9 (inhibitory proprotein konvertázy subtilisin/kexin typu 9)
Jedná se o monoklonální protilátky cílené na protein PCSK9. Protein PCSK9 se účastní intracelulární a extracelulární regulace exprese LDL receptoru. Je to proteáza, která se vyskytuje v mnoha tkáních, zejména však v játrech. V játrech snižuje PCSK9 počet LDL receptorů na povrchu jaterních buněk – váže se na ně a podporuje jejich intracelulární degradaci, kdy nedochází k recyklaci LDL receptorů. Mechanizmus účinku inhibitorů PCKS9 závisí na snížení plazmatických koncentrací PCSK9, kdy enzym PCSK9 chybí a nemůže se vázat na LDL receptory. Nízké koncentrace PCSK9 tak vedou k vyšší expresi LDL receptorů na povrchu buněk, což má za následek snížení koncentrace cirkulujícího LDL cholesterolu. Inhibitory PCSK9 snižují koncentrace LDL cholesterolu o zhruba 60 % nezávisle na souběžně podávané hypolipidemické léčbě, kdy neovlivňují její farmakokinetiku a farmakodynamiku. Jsou podávány formou subkutánních injekcí 1× za 2 týdny anebo 1× za měsíc (podle typu preparátu). Nejčastějšími nežádoucími účinky jsou lokální reakce v místě aplikace a chřipkové příznaky.
Tato léčba je podávána v centrech pro léčbu DLP a je z veřejného zdravotního pojištění hrazena pro pacienty s DLP v sekundární prevenci (tedy při manifestním kardiovaskulárním onemocnění), pokud stávající vysoce intenzivní hypolipidemická léčba nebyla dostatečně účinná pro dosažení hodnot LDL cholesterolu alespoň 2,5 mmol/l. V primární prevenci je léčba PCSK9 inhibotory hrazena v kombinaci s vysoce intenzivní hypolipidemickou terapií u pacientů s heterozygotní familiární hypercholesterolemií (HeFH),s hladinou LDL cholesterolu ≥ 3,1 mmol/l navzdory vysoce intenzivní hypolipidemické léčbě. Tato kritéria LDL cholesterolu platí i pro úhradu u pacientů, u kterých je léčba statinem prokazatelně kontraindikována či netolerována. Vysoce intenzivní hypolipidemická terapie je definována jako terapie maximální tolerovanou dávkou atorvastatinu nebo rosuvastatinu, v případě prokázané intolerance obou pak maximální tolerovanou dávkou jednoho jakéhokoli statinu v kombinaci s dalším hypolipidemikem, jako je ezetimib, v případě statinové intolerance hypolipidemikem v monoterapii, pokud je indikováno.
V ČR jsou momentálně dostupní dva zástupci této lékové skupiny – evolokumab a alirokumab. Ve většině klinických studií byly PCSK9i podávány formou subkutánních injekcí v intervalu 2 týdnů, protože se toto dávkovací schéma zdálo být nejvhodnější. Pro evolokumab (Repatha) máme k dispozici injekční pero se 140 mg účinné látky a pacient si jej aplikuje každé 2 týdny. Alirokumabem (Praluent) můžeme léčit pomocí dávek75 mgnebo150 mgpodávaných také každé 2 týdny. Nověji byla na trh uvedena léková forma alirokumabu s 300 mg k podávání jen 1× za měsíc. Farmakokinetická a farmakodynamická klinická studie na zdravých dobrovolnících porovnala podání 1 dávky alirokumabu 75 mg, 150 mg a 300 mg s placebem. Po všech dávkách alirokumabu klesla hladina volné PCSK9 k nule, přičemž blízko nulovým hodnotám zůstala i 11 dnů po podání 75 mg, respektive 15 dnů od podání 150 mg a 29 dnů od aplikace 300 mg alirokumabu. Maximálního snížení LDL cholesterolu bylo po dávce 75 mg alirokumabu dosaženo 8. den (redukce o 55,3 %), po dávce 150 mg 15. den (redukce o 63,7 %) a po dávce 300 mg alirokumabu byla nejnižší hodnota LDL cholesterolu po 22 dnech od podání (redukce o 73,7 %). Farmakodynamická data tedy jednoznačně podporují podání alirokumabu v dávce 300 mg každé 4 týdny.
Inklisiran (první siRNA v léčbě DLP)
Inklisiran je představitelem siRNA, který inhibuje syntézu PCSK9 v játrech. Má tedy potenciál redukovat hlavně LDL cholesterol, podobně jako monoklonální protilátky proti PCSK9. Jeho velká výhoda spočívá v dlouhých intervalech mezi podáním účinné látky. Po první subkutánní aplikaci následuje druhá za 3 měsíce a další se pak podávají každých 6 měsíců.
Tato nová léčba si již získala schválení Evropské lékové agentury a byla zaregistrována pod obchodním názvem LEQVIO. Inklisiran byl schválen k léčbě na základě výsledků klinického výzkumného programu ORION. Na základě tohoto programu lze shrnout, že léčba inklisiranem je provázena dlouhodobou asi 50% redukcí LDL cholesterolu a je velmi dobře tolerována. Inovativní mechanizmus účinku umožňující velmi dlouhý dávkovací interval představuje zcela novou modalitu v léčbě DLP. Díky aplikaci 1× za půl roku v ordinaci lékaře bude jistě zajištěna výborná adherence k této léčbě. Zatím čekáme na výsledky studie ORION4, která zkoumá vliv inklisiranu na cévní příhody, a také na úhradové podmínky zdravotních pojišťoven, abychom mohli inklisiran využívat v denní praxi.
Podpořeno grantem MZ ČR – RVO (FNOl, 00098892).
Literatura u autorky.
MUDr. Ľubica Cibičková, Ph.D.
3. interní klinika, FN Olomouc
