Nová léčiva u endometriálního karcinomu navazují na konvenční chemoterapii a patří do léčebného armamentária pokročilých, metastatických a recidivujících stadií onemocnění, která mají dosud špatnou prognózu. Novinkami v systémové léčbě jsou monoklonální protilátky (lenvatinib, trastuzumab), checkpoint inhibitory (dostarlimab, pembrolizumab) a cílená léčiva (zejména ze skupiny kinázových inhibitorů). V klinické praxi se u gynekologických malignit potvrdila malá účinnost imunoonkoterapeutik v monoterapii, obvykle se kombinují s konvenční chemoterapií nebo s cílenými léčivy. Je popsána signifikantní synergická účinnost kombinace dostarlimab + karboplatina s paklitaxelem v kohortě pacientek s hypermutovaným typem karcinomu. Významnost úspěchů těchto terapeutik dokládá i recentní změna v doporučených postupech České onkologické společnosti.
Karcinom endometria je nejčastější onkogynekologickou malignitou. Incidence v České republice za rok 2020 je udávána 34,89 nových případů za rok na 100 000 žen. To v absolutních číslech představuje 1 893 nových pacientek na 100 000 žen za rok. Naopak mortalita tohoto onemocnění je považována za nízkou (6,36 zemřelých pacientek na 100 000 žen za rok 2020). Incidence má narůstající dynamiku, etiologie vzestupu incidence je multifaktoriální, avšak za velmi významný faktor je považováno abnormální množství tělesného tuku (graf 1). Nová léčiva navazují na konvenční chemoterapii a patří do léčebného armamentária pokročilých, metastatických a recidivujících stadií onemocnění, která mají dosud špatnou prognózu. Časná stadia jsou obvykle řešena chirurgickým výkonem (eventuálně v kombinaci s adjuvantní radioterapií a/nebo chemoterapií založené na platině).
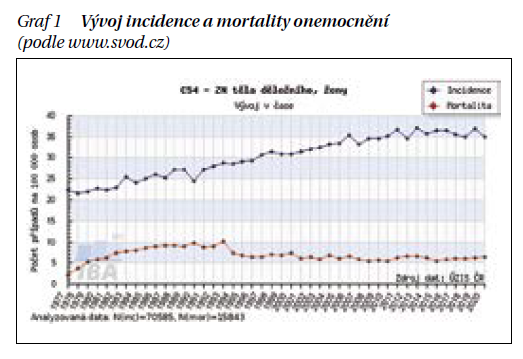
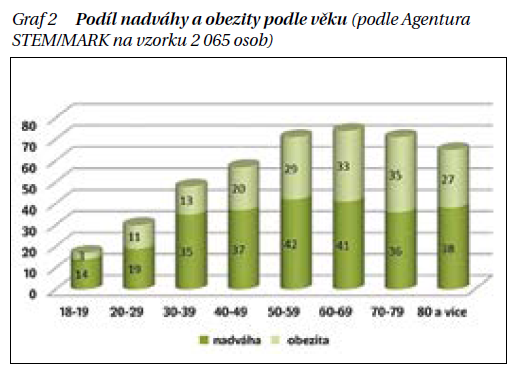
Karcinom endometria vzniká v onkogenně mutovaných buňkách sliznice dělohy – v endometriu. Typicky se vyskytuje u postmenopauzálních žen. Převažuje typ karcinomu, který se vyvíjí vlivem proliferačního účinku vysokých hladin extraovariálního estradiolu. U postmenopauzálních žen estradiol vzniká biochemickou cestou v buňkách tukové tkáně ze steroidů účinkem aromatázových enzymatických systémů. Tím se částečně vysvětluje nárůst incidence tohoto typu karcinomu v souvislosti s narůstající obezitou populace žen po menopauze (graf 2).
Nikoliv vzácně se vyskytují i typy bez hormonální etiopatogenetické souvislosti a smíšené typy karcinomů. Nutno je také zmínit situace, kdy se karcinom endometria vyvíjí u nosiček hereditárních nádorových syndromů: Lynchův syndrom II. U těchto pacientek je pak typická dřívější manifestace onemocnění, obvykle o dekádu dříve. Preventivně je možno těmto nosičkám (kromě frekventních kontrol) nabídnout odstranění dělohy po ukončení reprodukčních plánů, ideálně po 40. roce věku.
Velmi často se onemocnění projeví vaginálním krvácením v menopauze, které zpravidla bývá projevem časného – potenciálně dobře kurabilního onemocnění. Pokud není onemocnění rozpoznáno nebo jsou příznaky jinak zanedbávány, šíří se karcinom endometria jednak prorůstáním do stěny dělohy, do čípku děložního a i mimo ně, další metastatickou cestou je šíření lymfatickými cestami.
Preventabilita onemocnění
V současné době není známa populační screeningová metoda umožňující záchyt prekanceróz (primární prevence) nebo záchyt asymptomatických časných stadií (sekundární prevence). Avšak roční preventivní gynekologické prohlídky, jejichž součástí je i provedení ultrazvukového vyšetření pánve pomocí vaginální sondy, představují v naprostné většině případů dostatečnou metodu k vytřídění suspektních nálezů na základě měření výšky děložní sliznice, jejího vzhledu a ostrosti ohraničení vůči svalovině děložní. Suspektní ultrazvukové nálezy je pak možné histologicky verifikovat ze získaného materiálu z operačního výkonu v rozsahu hysteroskopie a separované abraze.
Soudobý pohled na skupinu karcinomů endometria se od r. 2020 rozšiřuje o parametry molekulární analýzy a doplňuje stávající histopatologické a klinické hodnocení s přímým dopadem na diagnosticko-terapeutické protokoly. Molekulární klasifikace tak poskytuje nezávislou prognostickou informaci k tradičním klinicko-patologickým parametrům. K molekulárním parametrům (somatickým prediktivním markerům), které patří do nového testování, se řadí mutační analýza genu p53, mutační analýza genu POLE (DNA polymeráza epsilon, ε), mutační analýza genů mismatch repair systému (MMR), resp. mikrosatelitové nestability (tabulka 1).

Léčebné přístupy
Základní léčebnou metodou je chirurgický výkon zaměřený na odstranění dělohy (hysterektomie). Rozsah chirurgického výkonu a způsob provedení se pak odvíjejí od klinického stavu pacientky, histopatologického nálezu, výsledků stagingových vyšetření a technických možností pracoviště/operačního týmu. Ideálním cílem předoperačních vyšetření a onkologické rozvahy je naplánovat terapeutický postup tak, aby se nekombinoval radikální chirurgický výkon a radioterapiez důvodu významné morbidity na vrub této kombinace. Doporučuje se vždy zvažovat provedení hysterektomie, alespoň jako paliativního výkonu ze symptomatických (hemostyptických) důvodů – zamezení významným krevním ztrátám z nádorem postižené dělohy.
Pro časná stadia je základní léčebnou metodou operační výkon v rozsahu radikální hysterektomie s bilaterální adnexektomií a s vyšetřením sentinelových uzlin ze spádové oblasti. Je snahou provádět výkony minimálně invazivně, především roboticky. Robotická operativa má své nesporné výhody u pacientek s vysokým BMI, zejména při hodnotách nad 40.
Samostatná radioterapie slouží jako terapeutická metoda pacientkám kontraindikovaným k chirurgickému výkonu a pro pokročilá inoperabilní stadia. Adjuvantní radioterapie slouží ke zvýšení lokální kontroly onemocnění. Molekulární klasifikace představuje nástroj, který rozkrývá diskutabilní histopatologické případy a představuje vodítko k zamezení především overtreatmentu pacientek a z něj plynoucích omezení kvality života a morbidity.
Nové možnosti systémové léčby karcinomu endometria
Systémová léčba u karcinomů endometria patří do armametária pokročilého, metastatického a recidivujícího onemocnění.
Novými systémovými terapeutiky jsou myšleny skupiny léčiv, které navazují na konvenční chemoterapii a jsou vyhrazena pro léčbu pokročilých, metastatických a recidivujících stadií onemocnění. Obecně sem patří skupina imunoonkoterapeutik a cílená léčiva.
Konkrétně se jedná o monoklonální protilátky (lenvatinib, trastuzumab), imunoterapeutika v užším slova smyslu – checkpoint inhibitory (immune checpoint inhibitors – ICs) (dostarlimab, pembrolizumab), kinázové inhibitory, např. TRK-950, entrektinib, BEZ 235 – inhibitor PI3K, selektivní inhibitor exportu genů z jádra nádorové buňky směrem k proteosyntéze (selinexor), WEE1 (KPT – 330) inhibitor resenzitizující nádorové buňky k účinkům chemoterapie, afatinib blokující receptor ERBB2 u HER2 pozitivních serózních karcinomů aj. (tabulka 2).
Nejvýznamnějším posunem v obtížně léčitelné kohortě pacientek s pokročilým, metastatickým nebo recidivujícím onemocněním od dob konvenční chemoterapie je jednoznačně kombinace pembrolizumabu s lenvatinibem, která je dostupná i pro pacientky v České republice (zatím bez možnosti úhrady ze zdravotního pojištění).
Dostarlimab
Dostarlimab vstupuje do portfolia onkologických léčebných metod u progredujícího a metastatického karcinomu endometria s deficitní opravou chybného párování bází (mismatch repair deficient – dMMR) či vysokou mikrosatelitovou nestabilitou (microsatellite instability high – MSI-H) u dospělých pacientek, u kterých došlo k progresi v průběhu léčby režimem obsahujícím platinu nebo po jejím skončení.
Jedná se o humanizovanou monoklonální protilátku proti proteinu programované buněčné smrti (PD-1) vyráběnou technologií rekombinantní DNA v ovariálních buňkách křečíka čínského, dostupný je jako léčivý přípravek Jemperli® 500 mg – koncentrát pro infuzní roztok. Registrace evropským lékovým úřadem (European Medicines Agency – EMA) byla schválena v dubnu 2021, držitelem rozhodnutí o registraci je firma GlaxoSmithKline. Tato registrace byla schválena postupem tzv. podmínečného schválení s povinností uskutečnit poregistrační opatření se závaznými termíny splnění. Dostarlimab patří do skupiny checkpoint inhibitorů (inhibitory kontrolních bodů imunitní reakce) a je určen k podávání v monoterapii. Přípravek je v České republice registrován Státním ústavem pro kontrolu léčiv (SÚKL), nemá schválenou úhradu (platí k 1. 10. 2023, viz www.sukl.cz).
Typ nádoru dMMR/MSI-H musí být stanoven pomocí validované testovací metody, jako je imunohistochemie, PCR nebo NGS (sekvenování nové generace). Účinnost byla prokázána u těchto subtypů karcinomů, tudíž není třeba ještě prokazovat přítomnost PD-1 receptorů v nádoru jako další prediktivní marker účinnosti.
Doporučená dávka v monoterapii je 500 mg dostarlimabu každé 3 týdny v prvních 4 cyklech následovaná dávkou 1 000 mg každých 6 týdnů ve všech následujících cyklech. Dávkovací režim je uveden v tabulce 3. Podávání dostarlimabu má pokračovat podle doporučeného rozvrhu až do progrese onemocnění nebo do nepřijatelné toxicity.

Snížení dávky se nedoporučuje. Na základě individuální bezpečnosti a snášenlivosti může být nutné podání dávky odložit, nebo léčbu vysadit.
Nežádoucí účinky
Imunoterapie má za cíl překonat imunotoleranci vůči nádoru. To může být doprovázeno nežádoucími účinky charakteru porušení tolerance k vlastním nenádorovým tkáním. Vznikají pak nežádoucí účinky, které připomínají autoimunitní onemocnění (imunitně podmíněné vedlejší účinky, immune related adverse effect – irAE). Jedná se o zcela jiný typ nežádoucích účinků, který vychází z vlastní podstaty léčby.
IrAE jsou pro imunoterapii typické a obecně se dělí na orgánově specifické a orgánově nespecifické. Z hlediska časového se pak irAE dělí na časné a pozdní. Nežádoucí autoimunitní reakcí může být postižen jakýkoliv orgán. Na druhou stranu byly publikovány observace, že rozvoj nežádoucího vedlejšího účinku je doprovázen lepší a déletrvající léčebnou odpovědí. Pravděpodobně se ale jedná o neoddělitelnost léčebného a nežádoucího účinku v rámci organizmu, kdy nádorová tkáň je svým původem tělu „vlastní“. Nejvíce poznatků z oblasti irAE je zdokumentováno u pacientů s maligním melanomem, nemalobuněčným karcinomem plic a renálním karcinomem, tedy u diagnóz, kde se moderní imunoterapie aplikuje v léčebných schématech přibližně celé desetiletí.
Žádné z imunoterapeutik není bez potenciálu irAE vyvolávat, vyšší nárůst irAE je v případě kombinací imunoonkologických preparátů. Četnost irAE v rámci publikovaných klinických studií kolísá (30–50 %), je dána typem a dávkou léčiva, užitím v kombinacích, délkou užívání, nemocí samotnou a v neposlední řadě i dispozicemi a komorbiditami pacienta. Nástrojem pro hodnocení závažnosti příznaků toxicity jsou kritéria obecné terminologie pro nežádoucí účinky (common terminology criteria for adverse events – CTCAE). Koncept zvládání nežádoucích účinků stojí na pěti základních pilířích: prevence, vstupní vyšetření, detekce, léčba a monitorace. Hlavní léčebnou metodou je imunosuprese – terapie kortikoidy (1–2 mg/kg/den prednisonu nebo ekvivalentu).
V klinické praxi je časté, že původně nevýrazné a nejednoznačné symptomy hodnocené jako toxicita mírného stupně, nevypovídají nic o jejich potenciálním závažném dopadu a původně nízký stupeň toxicity může mít fatální následky. Klinickým příkladem jsou různé periferní neuropatie, které ale vzácně mohou probíhat až pod obrazem paralýzy podobné Guillaina–Barrého syndromu. Neurotoxicita na úrovni CNS může probíhat pod obrazem encefalitidy, např. inflamace bazálních ganglií. Dalším příkladem původně nevýrazných potíží je lymfocytární myokarditida, která nemusí mít žádný klinický korelát, ale může se vyvíjet až do rychle progredujícího kardiogenního šoku.
Svá specifika má endokrinní toxicita. Její nástup může být opožděný a trvání dlouhodobé až celoživotní. Nejčastěji bývá postižena štítná žláza, hypofýza a nadledviny. Opět původně nevýrazné symptomy mohou vyústit v život ohrožující stavy, jako je nadledvinová krize nebo diabetes mellitus 1. typu s ketoacidózou. Základem terapie u endokrinopatií je suplementace chybějící funkce – tedy dlouhodobá hormonální substituce, protože imunitně podmíněné endokrinopatie jsou často ireverzibilní.
Pro vzácné nežádoucí účinky platí, že se obvykle vyskytují spolu s imunotoxicitou jiných orgánových soustav (kožní, jaterní, střevní) a při jejich zvládání je důležitá spolupráce se specialistou příslušného oboru (kardiolog, neurolog, endokrinolog).
Léčba dostarlimabem musí být trvale ukončena při opakovaném výskytu jakýchkoli imunitně podmíněných nežádoucích účinků stupně 3 a při výskytu toxicity stupně 4 vyvolané imunitně podmíněnými nežádoucími účinky s výjimkou endokrinopatií, které jsou pod kontrolou substitučními hormony. Nejčastěji sledované imunitně podmíněné nežádoucí účinky jsou kolitida, hepatitida, diabetes mellitus typu I, pneumonitida, hypofyzitida nebo adrenální insuficience (tabulka 4).
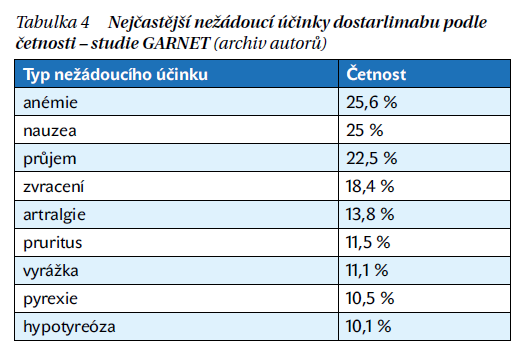
Podávání přípravku Jemperli® bylo ukončeno kvůli nežádoucím účinkům u 17 (3,3 %) pacientek. Většinou se jednalo o imunitně podmíněné nežádoucí příhody. Závažné nežádoucí účinky se vyskytly u 8,7 % pacientek.
Klinická studie GARNET
Bezpečnost dostarlimabu byla hodnocena v klinické studii fáze I GARNET (TSR 042, dostarlimab, TESARO) (NCT02715284), kdy u více solidních nádorů byla zkoušena humanizovaná monoklonální protilátka anti-PD-1 dostarlimab v monoterapii. V rameni vysoce předléčených pacientek s recidivujícím karcinomem endometria, podle molekulárního profilu dMMR/MSI high, tato léčba vedla ke zmenšení tumoru u 42 % pacientek, z toho 13 % mělo kompletní regresi, 30 % parciární regresi a 15 % stabilní onemocnění bez známek progrese. Výsledky byly publikovány v roce 2020 v časopisu JAMA. Na základě těchto výsledků byl dostarlimab schválen FDA a EMA u předléčených pacientek s pokročilým, perzistujícím nebo recidivujícím dMMR/MSI high karcinomem endometria, ve stejné indikaci se podává i v ČR. V konkrétních číslech se jednalo o 515 pacientek s karcinomem endometria nebo s jinými solidními nádory v pokročilém stadiu, které dostávaly dostarlimab v monoterapii, včetně 129 pacientek s pokročilým nebo rekurentním karcinomem endometria s dMMR/MSI-H.
Farmakodynamické vlastnosti: mechanizmus účinku
Dostarlimab je humanizovaná monoklonální protilátka (mAb) izotypu IgG4, která se váže na receptory PD-1, a blokuje tak jejich vazebné interakce s ligandy PD-L1 a PD-L2. Výsledkem inhibice imunitní odpovědi zprostředkované dráhou PD-1 je inhibice funkce T lymfocytů, jako je např. inhibice proliferace, produkce cytokinů a cytotoxické aktivity. Dostarlimab zesiluje reakce T lymfocytů, včetně protinádorové imunitní odpovědi, blokováním vazby PD-1 na PD-L1 a PD-L2. Na modelech syngenních nádorových buněk u myší vedlo blokování aktivity PD-1 ke zpomalení růstu nádoru.
Klinická účinnost a bezpečnost
Ve studii GARNET byla hodnocena účinnost a bezpečnost přípravku Jemperli®. Jednalo se o multicentrickou, nekontrolovanou, otevřenou studii s více paralelními kohortami. Studie GARNET zahrnovala expanzní kohorty pacientek s rekurentními nebo pokročilými solidními nádory, které mají omezené možnosti léčby. Kohorta A1 zahrnovala pacientky s MMR deficientním (dMMR) karcinomem endometria či karcinomem s vysokou mikrosatelitovou nestabilitou (MSI-H), které progredovaly na bázi platiny nebo podstoupily léčebný režim obsahující platinu a po jeho ukončení progredovaly. Pacientky dostávaly 500 mg dostarlimabu každé 3 týdny, a to ve 4 cyklech, poté následovalo 1 000 mg každých 6 týdnů. Léčba pokračovala až do nepřijatelné toxicity nebo progrese onemocnění po dobu až 2 let.
Hlavními kritérii hodnocení účinnosti byly výskyt objektivní léčebné odpovědi (ORR) a trvání odpovědi (DOR) stanovené na základě zaslepeného nezávislého centrálního radiologického hodnocení (BICR) za využití kritérií pro hodnocení odpovědi u solidních nádorů (RECIST). Účinnost byla ve studii GARNET hodnocena celkem u 108 pacientek s karcinomem endometria s dMMR/MSI-H.
Výchozí charakteristika těchto 108 pacientek: medián věku 64 let (50 % pacientek bylo 65 let a více), 77,8 % bělošky, 4,6 % Asiatky, 1,9 % černošky; celkové skóre fyzické aktivity (PS) na škále podle Východní kooperativní onkologické skupiny (performance status podle ECOG) 0 (38,9 %) nebo 1 (61,1 %). V době stanovení diagnózy byl u 18,5 % pacientek s dMMR/MSI-H karcinomem endometria nádor klasifikován jako nádor ve IV. stadiu podle klasifikace Mezinárodní federace gynekologů a porodníků (FIGO).
K detekci exprese dMMR/MSI-H v nádorové tkáni byly využity diagnostické testy dostupné na příslušném pracovišti (IHC, PCR, NGS), většina pracovišť využila NGS, jedná se o nejběžnější test.
Medián follow-up u 108 pacientek byl 16,3 měsíce. Celkově byl medián trvání léčby 26,0 týdne. Dvanáct pacientek (9,3 %) bylo léčeno po dobu ≥ 96 týdnů (22 měsíců). Ze 108 pacientek vykazovalo 78,3 % trvalou odpověď po dobu 6 nebo více měsíců.
Ze studie byly vyloučeny pacientky s následujícími stavy: výchozí skóre fyzické aktivity ECOG ≥ 2; nekontrolované metastázy v centrálním nervovém systému nebo karcinomatózní meningitida; další malignity v uplynulých 2 letech; imunodeficience nebo podávání imunosupresivní léčby v posledních 7 dnech; aktivní infekce HIV, hepatitida B nebo hepatitida C; aktivní autoimunitní onemocnění vyžadující systémovou léčbu v uplynulých 2 letech s výjimkou substituční léčby; anamnéza intersticiálního plicního onemocnění; podání živé vakcíny v posledních 14 dnech.
Soudobá praxe v aplikaci dostarlimabu
V červnu 2023 byly publikovány výsledky klinické studie fáze III prof. Mirzou (univerzita v Kodani), prokazující synergický efekt na statisticky významné prodloužení doby do další progrese onemocnění u dostarlimabu, karboplatiny a paklitaxelu při podání v kombinaci u pacientek s pokročilým nebo recidivujícím hypermutovaným karcinomem endometria. Po dokončení této léčby dostávaly pacientky v maintenence terapii dostarlimab nebo placebo. Zařazeno bylo celkem 494 pacientek, z nichž 118 mělo dMMR/MSI-H karcinom endometria. Podle publikovaných výsledků multicentrické, dvojitě zaslepené, placebem kontrolované studie v rameni pacientek s dMMR/MSI-H karcinomy léčených kombinací dostarlimab + karboplatina + paklitaxel a udržovací léčbou s dostarlimabem mělo 61,4 % pacientek DFI (disease free interval, doba bez známek onemocnění) 24 měsíců. Oproti 15,7 % DFI za 24 měsíců v rameni pacientek se stejným typem karcinomu léčených pouze placebem s karboplatinou + paklitaxelem a placebem v udržovací fázi. Pacientky s karcinomem endometria bez deficitu MMR, resp. bez MSI-H subtypu měly v obou ramenech (dostralimab + karboplatina s paklitaxelem / placebo + karboplatina s paklitaxelem) jiné výsledky DFI (36,1 % v rameni s dostarlimabem a chemoterapií a 18,1 % v rameni s placebem a chemoterapií). Výsledky potvrzují již deklarovanou účinnost dostralimabu u hypermutovaných subtypů karcinomu endometria, navíc potencovanou konvenční chemoterapií v podmínkách snesitelné toxicity obou typů léčiv.
Závěr
Imunoterapeutika v podobě checkpoint inhibitorů vstupují do léčebných protokolů gynekologických malignit pozvolna. Lze doufat, že budou obdobně mocným pilířem v portfoliu léčebných metod u pokročilých klinických stadií tak, jako se tomu stalo u maligního melanomu, nemalobuněčného karcinomu plic a renálního karcinomu. Z imunologického hlediska jsou gynekologické malignity charakteristické nízkou mutační náloží a vysoce imunosupresivním nádorovým mikroprostředím s výjimkou právě dMMR/MSI-H karcinomů endometria. Výsledky užití dostralimabu v monoterapii nebo v kombinaci s konvenční chemoterapií u pacientek s rekurentním a metastatickým karcinomem endometria přinášejí naději na prodloužení intervalu do další progrese v dobré kvalitě života tam, kde byly již tradiční terapeutické možnosti vyčerpány. Uvedené terapeutické možnosti jsou zahrnuty v doporučených postupech České onkologické společnosti (podrobně v Modré knize ČOS, kapitola C54 Zhoubný novotvar děložního těla), dosud však tato léčba není hrazena z prostředků veřejného zdravotního pojištění. Konečně je nutno dodat, že klinické studie u pokročilých omezeně kurabilních stadií vysoce předléčených pacientek se soustřeďují i na jiná terapeutika, především na kinázové inhibitory, např. TRK-950, entrectinib, BEZ235 – inhibitor PI3K nebo selektivní inhibitor exportu genů z jádra nádorové buňky směrem k proteosyntéze (selinexor), WEE1 (KPT-330) inhibitor resenzitizující nádorové buňky k účinkům chemoterapie a i k účinkům iPARP, afatinib blokující receptor ERBB2 u HER2 pozitivních serózních karcinomů.
Podpořeno MZ ČR – RVO (MOÚ, 00209805).
MUDr. Monika Náležinská
MUDr. Josef Chovanec, Ph.D.
Oddělení gynekologické onkologie Kliniky operační onkologie LF MU a MOU, Brno
