Léčba plicní rakoviny zažívá velký rozmach, a to jak u malobuněčných nádorů, tak i u nemalobuněčných. Cílená léčba a imunoterapie se pomalu od pokročilých stadií posouvají do nižších, kurabilnějších stadií. Je proto i logické, že je kladen velký důraz na screening, kdy je největší šance podchytit tato nízká, asymptomatická stadia a nemocným dopřát naději na úplné vyléčení.
NSCLC je agresivní onemocnění. Tvoří přibližně 80 % všech plicních karcinomů. Většina NSCLC je diagnostikována v pokročilém, inoperabilním stadiu. Radikální resekci tumoru může podstoupit pouze zhruba 25–30 % pacientů, nicméně ani tito nemocní nemají jistotu úplného vyléčení. Neoadjuvantní nebo adjuvantní chemoterapie totiž zásadně riziko recidivy NSCLC nesnižuje. Recidivy tak vídáme poměrně často včetně návratu nemoci již ve formě vzdálených metastáz. Neustále se hledají možnosti, jak tento nepříznivý trend zvrátit. Moderní přístupy v neoadjuvantní a adjuvantní terapii zahrnují účinnou cílenou léčbu. Patří sem i osimertinib.
Osimertinib se řadí k 3. generaci TKI (tyrosinkinázových inhibitorů) cílících na EGFR (receptor pro epidermální růstový faktor). Inhibuje aktivační EGFR mutace (delece na exonu 19, substituční mutace L858R v exonu 21) a předchází vzniku EGFR mutace T790M, která je odpovědná za rezistenci. Zároveň má osimertinib minimální vliv na nemutovanou formu EGFR.
Osimertinib je v monoterapii indikován k adjuvantní léčbě dospělých pacientů po úplné resekci NSCLC ve stadiu IB–IIIA, pokud u něj byla prokázána delece na exonu 19 EGFR nebo substituční mutace L858R v exonu 21. Dále je osimertinib v monoterapii indikován v první linii léčby dospělých pacientů s lokálně pokročilým nebo metastazujícím NSCLC s aktivačními mutacemi EGFR a k léčbě dospělých pacientů s lokálně pokročilým nebo metastazujícím NSCLC s přítomnou mutací EGFR T790M.
Studie ADAURA a data o celkovém přežití
ADAURA (NCT02511106) je randomizovaná, dvojitě zaslepená, placebem kontrolovaná, multicentrická, mezinárodní studie fáze III. Hodnotí účinnost a bezpečnost osimertinibu oproti placebu v adjuvantní léčbě dospělých pacientů po úplné resekci EGFR pozitivního NSCLC stadia IB–IIIA.
Pro zařazení platilo, že EGFR pozitivní NSCLC musel vykazovat deleci na exonu, 19 nebo substituční mutaci L858R v exonu 21. Určení stadia probíhalo podle 7. edice AJCC klasifikace. Předpokladem pro vstup do studie byl rovněž dobrý výkonnostní stav odpovídající WHO PS (World Health Organization Performance Status) 0, nebo 1.
Screening s následnou randomizací probíhal po resekci NSCLC a případné adjuvantní chemoterapii, která byla povolena, ne však vyžadována.
Randomizaci v poměru 1 : 1 podstoupilo celkem 682 pacientů. Stratifikace probíhala podle stadia NSCLC (IB/II/IIIA), typu EGFR mutace (delece na exonu 19/substituční mutace L858R) a etnické příslušnosti (asijská/neasijská).
V prvním rameni dostávalo osimertinib 339 pacientů. Dávka osimertinibu byla 80 mg perorálně jednou denně. Ve druhém, kontrolním, rameni obdrželo 343 pacientů placebo. Maximální doba léčby byla 3 roky. Dříve přestala být studijní medikace podávána při potvrzené recidivě onemocnění nebo při splnění některého kritéria pro ukončení léčby.
Vstupní charakteristiky byly mezi oběma rameny vyrovnané.
Věkový medián byl 64 let v rameni s osimertinibem, 62 let v kontrolním rameni. V obou ramenech převažovaly ženy, nekuřáci, Asiati a výkonnostní stav WHO PS 0. Jednotlivá stadia NSCLC (IB, II, IIIA) byla zastoupena zhruba po třetině a mírně převažovala delece na exonu 19 (55 %) nad substituční mutací L858R (45 %). Zařazení pacienti měli v drtivé většině diagnostikovaný adenokarcinom, pro který nejčastěji podstoupili lobektomii. V každém rameni obdrželo adjuvantní chemoterapii na bázi platiny 60 % pacientů.
Primárním cílem studie bylo stanovení DFS (přežití bez nemoci) hodnocené investigátorem u pacientů s NSCLC stadia II a IIIA. DFS bylo definováno jako čas od randomizace do recidivy onemocnění (potvrzené zobrazovacími metodami nebo biopsií) nebo do smrti z jakékoliv příčiny.
Sekundárních cílů měla studie několik. Šlo především o zhodnocení DFS v celkové populaci ve studii (stadia IB–IIIA), OS (celkové přežití) v primárně sledované populaci pacientů se stadii onemocnění II a IIIA, OS v celkové populaci ve studii (stadia IB–IIIA), dále byla zkoumána kvalita života a bezpečnost. Předem specifikovaným exploratorním cílem studie bylo zjistit, ve kterém orgánu došlo k recidivě onemocnění (včetně CNS) a určení času do recidivy nemoci v CNS nebo do smrti.
Publikované výsledky studie ADAURA s mediánem doby sledování 44,2 měsíce prokázaly statisticky signifikantní přínos adjuvantně podávaného osimertinibu v parametru DFS oproti placebu. U pacientů se stadii onemocnění II–IIIA (primární cíl studie) bylo zmenšeno riziko recidivy onemocnění nebo úmrtí o 77 %, u celkové studijní populace pak o 73 %.
Benefit osimertinibu byl zaznamenán napříč všemi predefinovanými podskupinami a nezávisle na stadiu nebo na tom, zda byla, nebo nebyla podána předchozí adjuvantní chemoterapie. Adjuvantně podávaný osimertinib významně snížil riziko vzniku lokoregionálních a především vzdálených recidiv včetně recidiv v CNS (centrálním nervovém systému). Riziko vzniku recidivy v CNS bylo u pacientů se stadii onemocnění II–IIIA zmenšeno o 76 %. Bezpečnostní profil osimertinibu v adjuvantním podání byl podobný jeho známému bezpečnostnímu profilu při léčbě pacientů s lokálně pokročilým nebo metastazujícím EGFR mutovaným NSCLC.
Data byla pro finální analýzu OS uzavřena k 27. lednu 2023. Při adjuvantním podávání osimertinibu došlo ke statisticky významnému zlepšení OS ve srovnání s placebem v primárně sledované populaci pacientů se stadii onemocnění II a IIIA, stejně jako v celkové populaci ve studii (stadia IB–IIIA).
U pacientů s resekovaným NSCLC se stadii II a IIIA došlo ke 100 úmrtí (21% zralost dat, 35 úmrtí v rameni s osimertinibem, 65 úmrtí na placebu). Medián trvání sledování OS byl 59,9 měsíce u osimertinibu, 56,2 měsíce u placeba. Pětiletá četnost OS činila 85 % na osimertinibu, 73 % na placebu. Celkově snížil osimertinib riziko úmrtí oproti placebu o 51 % (OS HR [poměr rizik] = 0,49 (95,03% CI 0,33–0,73, p < 0,001)] (graf 1).
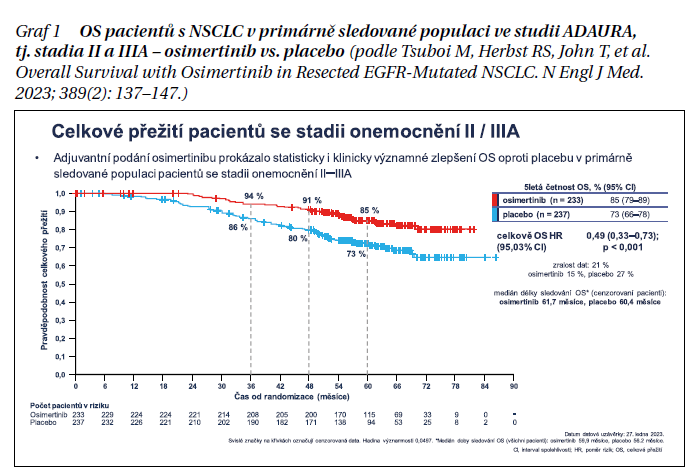
V celkové populaci ve studii, tj. u pacientů s resekovaným NSCLC ve stadiích IB–IIIA bylo zaznamenáno 124 úmrtí (18% zralost, 42 úmrtí v rameni s osimertinibem, 82 úmrtí na placebu). Medián trvání sledování OS byl 60,4 měsíce u osimertinibu, 59,4 měsíce u placeba. Pětiletá četnost OS činila 88 % na osimertinibu, 78 % na placebu. Osimertinib snížil riziko úmrtí oproti placebu o 51% (OS HR = 0,49 [95,03% CI 0,34–0,70, p < 0,001)] (graf 2).
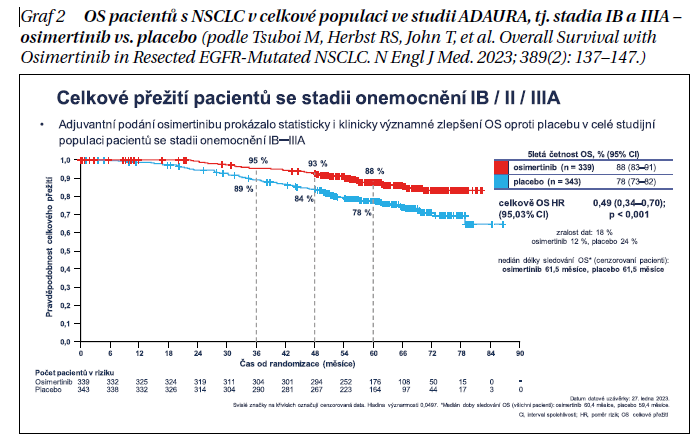
Benefit osimertinibu v parametru OS byl zaznamenán napříč všemi predefinovanými podskupinami (bez ohledu na stadium onemocnění, anamnézu kouření, etnickou příslušnost, pohlaví, věk, typ EGFR mutace) a nezávisle na tom, zda byla, nebo nebyla podána předchozí adjuvantní chemoterapie.
V rameni s osimertinibem mělo recidivu onemocnění 93 pacientů (27 %), z toho následnou léčbu podstoupilo 76 nemocných (22 %). V rameni s placebem došlo k recidivě u 205 pacientů (60 %), další léčbu podstoupilo 184 nemocných (54 %). Nejčastější používanou následnou léčbou byl osimertinib, následovaly jiné TKI, radioterapie, chemoterapie.
Nebyly zaznamenány nové bezpečnostní signály. Bezpečnostní profil osimertinibu byl konzistentní s primární bezpečnostní analýzou ve studii.
Závěr
Výsledky finální analýzy OS potvrzují výrazně vyšší účinnost osimertinibu oproti placebu při adjuvantní léčbě dospělých pacientů s radikálně resekovaným NSCLC s EGFR mutací (delecí na exonu 19, substituční mutací L858R v exonu 21) ve stadiích IB–IIIA. Stejně jako v předchozí analýze DFS, i v analýze OS z léčby osimertinibem profitovaly všechny podskupiny a nezáleželo na tom, zda pacientům byla, nebo nebyla podána adjuvantní chemoterapie. O efektivitě osimertinibu v adjuvantním podání tudíž nemůže být pochyb. Nutno rovněž zmínit, že osimertinib má příznivý bezpečnostní profil. Navíc je již delší dobu v adjuvantním podání plně hrazen z prostředků veřejného zdravotního pojištění. S jeho indikací bychom tudíž u vhodných pacientů neměli váhat.
Literatura u autorky.
MUDr. Marie Drösslerová
Pneumologická klinika 1. LF UK a FTN Praha
