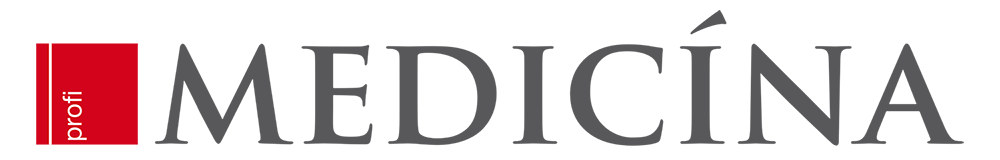Niraparib je malou molekulou cílené léčby, inhibitorem poly-ADP-ribózo polymerázy (PARP), která se účastní reparace zlomů DNA. Za jeho terapeutickým efektem stojí ale i další mechanizmy účinku a jeho klinický dopad v rámci udržovací léčby je patrný prakticky bez ohledu na stav homologní rekombinace, resp. BRCA mutace, u pacientek s pokročilými high-grade karcinomy ovaria (tj. ovaria, vejcovodu nebo primárního peritoneálního karcinomu) po dosažení léčebné odpovědi nejen v první linii léčby.
Niraparib je perorální vysoce selektivní PARP1 a PARP2 inhibitor, který v rámci studie NOVA (ENGOT-OV16/NOVA)
u pacientek s recidivujícím karcinomem vaječníků s léčebnou odpovědí na chemoterapii na bázi platiny prokázal v rámci udržovací terapie významně delší přežití bez progrese (PFS) oproti placebu, a to jak v případně nádorů
s germinální mutací BRCA (n = 203) tak i bez ní (n = 350). Pacientky v kohortě s germinální mutací (gBRCA) ve skupině s niraparibem měli významně delší medián PFS oproti skupině s placebem: 21,0 vs. 5,5 měsíce (HR 0,27; 95% CI, 0,17–0,41), přičemž v kohortě bez gBRCA to bylo při léčbě s niraparibem 9,3 vs. 3,9 měsíce (HR 0,45; 95% CI,
0,34–0,61), nicméně v případě pacientek bez gBRCA, ale současně s deficitem homologní rekombinace (HRD) byly tyto hodnoty lepší: 12,9 vs. 3,8 měsíce (HR 0,38; 95% CI, 0,24–0,59).
Efekt léčby byl patrný také u pacientek bez ohledu na dosažení parciální nebo kompletní remise po chemoterapii. Nejčastějšími nežádoucími účinky léčby stupně 3 nebo 4, které byly hlášeny ve skupině s niraparibem, byly trombocytopenie (33,8 %), anémie (25,3 %) a neutropenie (19,6 %) zvládnutelné úpravami dávky.
Velmi zřetelný klinický přínos potvrdila i studie PRIMA (PRIMA/ENGOTOV26/GOG-3012)
Studie byla zaměřená na účinnost a bezpečnost udržovací terapie niraparibem po odpovědi na chemoterapii na bázi platiny u pacientek s nově diagnostikovaným pokročilým karcinomem vaječníku s vysokým rizikem relapsu (např. zbytková nemoc po primárním chirurgickém debulkingu (23,1 %), stadium IV (35,0 %), parciální léčebná odpověď po chemoterapii na bázi platiny (30,5 %). Ze 733 randomizovaných pacientek byla malignita s deficitem homologní rekombinace (HRD) klasifikována u 373 (50,9 %) – ať už byla s průkazem BRCA mutace nebo bez ní (pozn.: stav deficitní homologní rekombinace není definován výskytem specifické mutace, ale zvýšenou hodnotou indexu pro hodnocení výskytu celkové genomické instability ve vzorku tumoru). Niraparib zde opět poskytl významný klinický přínos oproti placebu s ohledem na medián PFS prakticky ve všech ověřovaných skupinách – nejvíce u pacientek, které měly nádory s deficitem homologní rekombinace (HRD) a s mutací BRCA (22,1 vs. 10,9 měsíce; HR 0,40), ale také u pacientek s HRD bez mutace BRCA (19,6 vs. 8,2 měsíce; HR 0,50) a nakonec i v podskupině homologní rekombinace proficientní, tedy bez HRD (8,1 vs. 5,4 měsíce; HR 0,68). Výsledky podporují hypotézu i jiných mechanizmů účinku niraparibu, než je pouze podíl na opravě poškození DNA, tedy např. transkripce genů regulovaných prostřednictvím PARP, biogeneze ribozomů, imunitní aktivace, ale i vyšší průnik a expozice v nádoru.
V době hodnocení po dvou letech byla míra celkového přežití 84 % ve skupině s niraparibem a 77 % ve skupině
s placebem (HR 0,70; 95% CI, 0,44–1,11). Velmi důležitým prvkem, jak vyplývá z dalších dílčích výstupů PRIMA, bylo
i nezhoršování kvality života udržovací léčbou niraparibem. Byla pozorována jasná vazba zhoršení kvality života na progresi pokročilého ovariálního karcinomu a naopak, prodloužení doby do progrese nemoci při účinné udržovací léčbě kvalitu života prodlužovalo. Nejčastější nežádoucí příhody stupně 3 nebo vyšší ve studii byly anémie (31,0 %), trombocytopenie (28,7 %) a neutropenie (12,8 %) a nedošlo k žádnému úmrtí v souvislosti s léčbou (graf 1).
Zkušenosti z reálné praxe
Tak jako u jiných léčiv, i v případě niraparibu se objevují sdělení o zkušenostech z reálné praxe. Ty dokládají, stejně jako studie NOVA a PRIMA, např. vyšší efekt u BRCA mutovaných onemocnění oproti wild-type, ale také fakt, že do studie PRIMA byly zařazovány pacientky více rizikové a že v případě stadií onemocnění III s provedením primárního chirurgického debulkingu bez nádorového rezidua jsou léčebné výsledky v denní klinické praxi s využitím udržovací léčby s niraparibem oproti závěrům studie PRIMA příznivější (medián PFS 2,45 let (1,69–3,1) a medián OS 6,84 let (4,11–7,67), HR 0,43; P < 0,0001). I z důvodu právě vyššího zastoupení rizikových pacientek ve studii PRIMA nelze jednoduše porovnávat dosažené výsledky oproti studii SOLO s olaparibem.
Indikační kritéria
Aktuálně je niraparib registrován v ČR v lékové formě perorálních tobolek o síle 100 mg. Indikován je jako monoterapie k udržovací léčbě dospělých pacientek s pokročilým high-grade epiteliálním karcinomem vaječníků (stadia FIGO III a IV), vejcovodů nebo primárním karcinomem peritonea, které odpovídají (úplná nebo částečná odpověď) po dokončení první linie chemoterapie založené na platině, a jako monoterapie k udržovací léčbě dospělých pacientek s rekurentním a na léčbu platinou senzitivním high-grade serózním epiteliálním karcinomem vaječníků, vejcovodů nebo primárním karcinomem peritonea, které odpovídají (úplná nebo částečná odpověď) na chemoterapii založené na platině.
Za pozornost v zavedené indikaci tedy hlavně stojí rozdíl v definici typu karcinomu v rámci první linie léčby oproti stavu v rámci linií následných po platina-senzitivní rekurenci, kdy je uvedeno zúžení indikace na podskupinu již pouze serózních high-grade epiteliálních karcinomů. Zároveň je nutno mít na zřeteli fakt, že k zahájení udržovací léčby není dostatečné pouze dosažení stabilizace, ale je nutná alespoň parciální léčebná odpověď.
Úhradové podmínky
Mimo to však v denní praxi musíme vnímat i úhradové podmínky pro léčivo. Niraparib, resp. Zejula tbl má schválenu úhradu od 1. 3. 2022 v „udržovací léčbě dospělých pacientek s pokročilým (stadium FIGO III, FIGO IV) high-grade serózním či endometroidním epiteliálním karcinomem vaječníku, vejcovodu nebo primárně peritoneálním karcinomem, které na terapii prvoliniové chemoterapii režimem obsahujícím platinu dosáhly odpovědi (parciální či kompletní remise) přetrvávající po ukončení platinové chemoterapie. Jedná se o pacientky nepředléčené bevacizumabem, ve stavu výkonnosti 0–1 podle ECOG. Udržovací léčba niraparibem musí být zahájena do 12 týdnů po poslední dávce platinového derivátu. Léčba niraparibem je hrazena do progrese onemocnění nebo neakceptovatelné toxicity, nebo nejdéle po dobu 3 let (36 měsíců)“.
Z pohledu lékových interakcí a metabolizmu
Niraparib nepatří mezi vysloveně rizikové molekuly a z praktického pohledu je spíše vyžadována opatrnost při možné komedikaci s metforminem (riziko zvýšení jeho koncentrace), pozornost je vhodné věnovat také antikoagulanciím, případně statinům. Velmi zajímavým fenoménem je i vyšší distribuční objem, vyšší průnik a expozice v nádoru (3,3× vyšší než expozice v plazmě), jako jedinečné vlastnosti niraparibu ve srovnání s jinými PARPi. Kromě toho niraparib prochází hematoencefalickou bariérou a vykazuje dobrou udržitelnost v mozku. V souladu se svou příznivou distribucí v nádoru a mozku dosahuje niraparib silnější inhibice růstu nádoru než olaparib v modelech BRCA-wt
a v modelu intrakraniálního nádoru při maximálních tolerovaných dávkách.
Dávkovací schéma
Dávkování je poměrně jednoduché, jen v rámci první linie je počáteční dávka přípravku vázána na hranici hmotnosti 77 kg a hodnotu trombocytů ≥ 150 000/μl – u pacientek s hmotností ≥ 77 kg a výchozím počtem trombocytů
≥ 150 000/μl je doporučená počáteční dávka 300 mg (tři 100mg tobolky) užívaná jednou denně, jinak je to dávka
200 mg (dvě 100mg tobolky) užívaná jednou denně v přibližně stejnou dobu a bez zásadní vazby na jídlo. V případě udržovací léčby v další linii je možno zvážit použití počáteční dávky 200 mg u pacientek s tělesnou hmotností nižší než 58 kg (s ohledem na vyšší – 78 % – výskyt nežádoucích účinků stupně 3 nebo 4 u pacientek s nízkou tělesnou hmotností v rámci studie NOVA). Další úpravy dávkování jsou standardně podle nežádoucích účinků s tím, že léčbu lze případně přerušit (maximálně na 28 po sobě následujících dnů). U pacientek s lehkou poruchou funkce jater
a u pacientek s lehkou až středně těžkou poruchou funkce ledvin není nutná žádná úprava dávkování.
Závěr
Z mého pohledu lze shrnout, že niraparib kvalitně rozšiřuje spektrum možností léčby s dobrou účinností
a prodloužením kvality života při udržovací léčbě po dosažení léčebné odpovědi po chemoterapii na bázi platiny u pacientek s high-grade karcinomem ovaria, prakticky bez ohledu na mutaci BRCA, resp. stav homologní rekombinace, i když efekt je samozřejmě nejlepší u pacientek s deficitem homologní rekombinace, resp. s BRCA mutací. Zásadní význam je nutno dále přikládat provedení primárně chirurgického debulkingu s dosažením stavu bez makroskopického nádorového rezidua. Pro klinickou praxi je pak důležitý i fakt poměrně příznivé farmakokinetiky
a nízkého rizika interakcí.
Z analýzy Guy H. et al (Guy H, Travers K, Hawkes C, et al. Systematic literature review of efficacy and safety of first-line maintenance therapy trials in advanced ovarian cancer. International Journal of Gynecologic Cancer 2020; 30:
A73–A74), která byla prezentována v rámci European Society of Gynaecological Oncology State of the Art (ESGO-SOA) v roce 2020 a která nepřímo srovnávala výsledky 18 klinických studií zaměřených na udržovací léčbu po jedné předchozí chemoterapii, vyplývá zásadní význam a prospěch léčby PARP inhibitory (olaparib, niraparib, veliparib) na proloužení PFS oproti jiným modalitám, včetně vlivu na OS oproti placebu u niraparibu bez ohledu na BRCAm status (PRIMA: HR 0,7; 95% CI 0,44–1,11) a olaparibu v BRCA mutované skupině (SOLO-1: HR 0,95; 95% CI 0,60–1,53). Ve vazbě na tyto výsledky a fakt podmínky úhrady niraparibu Zejula v první linii (www.sukl.cz; Zejula 150mg cps; 1. 3. 2022) a olaparibu Lynparza v první linii (www.sukl.cz; Lynparza 150mg tbl flm 56; 18. 2. 2022) jen při nepředléčení
s bevacizumabem, je pozice této anti-VEGF monoklonální protilátky v případně léčby pokročilých high-grade karcinomů ovaria v běžné praxi první linie velmi diskutabilní.
Literatura u autora.
prof. MUDr. Samuel Vokurka, Ph.D.
Onkologická a radioterapeutická klinika LF UK a FN Plzeň