Zhoubné ovariální nádory patří k nádorům s nejhorší prognózou. Cca 75 % pacientek je diagnostikováno ve III. a IV. stadiu nemoci. Primární léčebnou modalitou je radikální chirurgický výkon, optimálně do nulového rezidua. Z chemoterapeutických režimů je základem kombinace paklitaxelu s platinovými deriváty. Biologická léčba bevacizumabem přinesla naději u žen s metastatickým, rekurentním či perzistentním karcinomem. Nejnovější terapie PARP inhibitory přináší výsledky zejména, ale nejen u pacientek s BRCA mutací.
V ČR v roce 2016 byla incidence 18,9 / 100 000 žen a mortalita 11,7 / 100 000 žen. Ovariální karcinomy zaujímají dlouhodobě první místo v mortalitě gynekologických malignit. Incidence stoupá s věkem a nejvyšší prevalence je mezi 6. a 7. dekádou života žen. Celoživotní riziko rozvoje ovariálního karcinomu v běžné populaci se pohybuje kolem 1,5 %. Genetická zátěž je detekována až v 15 % všech případů, zejména v souvislosti s mutacemi v genech BRCA 1 (39% podíl na rozvoji karcinomu) a BRCA2 (11–17% podíl na rozvoji karcinomu).
Etiologie
V etiopatogenezi zaujímají důležitou roli extraovariální tkáně. Podle dualistického modelu karcinogeneze dělíme nádory do dvou skupin. V první skupině jsou nádory s celkově lepší prognózou, postihující často pouze jeden vaječník (low-grade serózní a endometrioidní adenokarcinom, mucinózní adenokarcinom, zhoubný Brennerův tumor a část světlobuněčných adenokarcinomů). Mezi prekurzory této skupiny patří benigní a borderline tumory patřičné diferenciace a endometrióza.
Do druhé skupiny patří nádory s výrazně horší prognózou (nediferencovaný karcinom, high-grade serózní endometrioidní karcinom, smíšený maligní mulleriánský nádor, high-grade karcinom z přechodných buněk a část světlobuněčných adenokarcinomů). Jako prekurzor high-grade serózních karcinomů ovaria je v současnosti uváděn serózní tubární intraepiteliální karcinom (STIC), který má maligní potenciál a může diseminovat cestou implatačních metastáz.
Histologie
Zhoubné nádory vaječníků tvoří heterogenní skupinu, které mohou vznikat z jakéhokoliv typu buněk, které jsou přítomné v ovariální tkáni. Epiteliální nádory tvoří téměř 90 % maligních nádorů ovarií. Řadíme sem tumory serózní, mucinózní, endometrioidní, ze světlých buněk (clear cell), Brennerův tumor a smíšené nádory. K méně častým typům ovariálních nádorů patří germinální tumory – dysgerminomy a non-dysgerminomy (nádor ze žloutkového váčku, nádory z trofoblastu, choriokarcinom, teratom). Nádory z gonadálního mezodermu zahrnují granulózový nádor ovaria a arhenoblastom.
Diagnostika ovariálních tumorů
Obligatorní vyšetření zahrnují odběr anamnézy, somatické a komplexní gynekologické vyšetření včetně vyšetření per rectum, ultrazvukové vyšetření malé pánve, základní hematologické a biochemické vyšetření, z nádorových markerů pak CA 125, HE4 (u mladých žen i CEA, hCG, AFP), rtg. předozadní snímek plic. Z fakultativních vyšetření je možné provést CT malé pánve, břicha a retroperitonea, NMR, PET, PET/CT, cystoskopii, eventuálně intravenózní urografii, vyšetření střev (kolonoskopii) atd.
Klinické příznaky
Časná stadia maligních nádorů ovarií ve většině případů probíhají asymptomaticky. Z počátku může dojít k projevům gastrointestinálního diskomfortu, jako jsou např. plynatost, pocity nadýmání. Postupně mohou přicházet bolesti břicha a zad z útlaku okolních orgánů. V pokročilejších stadiích dochází ke zvětšování objemu břicha vlivem tvorby ascitu a nádorových mas. Pacientky přestávají dopínat oblečení, nastává nechutenství, obtíže se zažíváním, zvracení, obstipace i s možností rozvoje vzniku ileózního stavu. Další klinické příznaky vyplývají z lokalizace metastatického postižení. Při progresi onemocnění dochází k postupné kachektizaci.
Terapie ovariálních nádorů
Nejdůležitější léčebnou modalitou časných a převážné části pokročilých stadií karcinomu vaječníků je radikální operační výkon se snahou o maximální debulking s ponecháním nulového (R0) či malého pooperačního rezidua (R1). Většina pacientek podstupuje po primární cytoredukční operaci adjuvantní chemoterapii založenou na kombinaci taxanu s platinovým preparátem. Asi 30 % pacientek s karcinomem vaječníků má v době diagnózy některou ze známek inoperability. U této skupiny pacientek zahajujeme neoadjuvatní chemoterapii založenou na platinovém preparátu a v případě dobré odpovědi následně pacientky indikujeme k intervalové operaci. U více než 50 % pacientek s kompletní odpovědí na léčbu dochází k recidivě onemocnění, zkrácení doby do dalšího relapsu a úmrtí do 5 let. Tyto údaje vedly ke hledání nových metod v systémové léčbě karcinomu ovaria, které by přispěly ke zlepšení prognózy, prodloužení doby do progrese onemocnění a celkového přežití pacientek s ovariálním karcinomem. Největší rozvoj v poslední době zaznamenala cílená molekulárněbiologická léčba. Podstatou využití a úspěchu biologické léčby je stále narůstající znalost o vnitřních pochodech v organizmu na molekulární úrovni, rozpoznání určitých buněčných receptorů a pochopení šíření informací uvnitř buňky. Základními nástroji cílené léčby jsou monoklonální protilátky a nízkomolekulové tyrosinkinázové inhibitory. Hormonální léčba se s poměrně nízkou úspěšností využívá v systémové léčbě ovariálního karcinomu až ve vyšších liniích léčby.
Operační léčba
Primární radikální nebo cytoredukční operace by měla být provedena v onkogynekologickém centru. Důvodem je jasně prokázaná souvislost mezi optimálně provedeným operačním výkonem a délkou celkového přežívání. Snahou je docílit kompletního odstranění tumoru nebo maximální cytoredukce. Přístup je volen laparotomicky ve snaze o provedení bilaterální adnexektomie, hysterektomie, infrakolické omentektomie, appendektomie, pánevní a paraaortální lymfadenektomie s exstirpací nádorových ložisek. Odebírá se ascites či se provádí laváž na cytologické vyšetření. Pokud není předpoklad dosažení nulového rezidua, nemá smysl provádět systematickou lymfadenektomii. Dále je vhodné odebrat bioptické vzorky z peritonea močového měchýře, pravého a levého parakolického prostoru, bráničních kopul a peritonea pánevní stěny v místě primárního tumoru. U mladých žen, které plánují graviditu, ve stadiu IA nebo IC1 low grade typu serózního či endometriodního tumoru a za podmínky, že peritoneální laváž neprokazuje přítomnost nádorových buněk, lze provést pouze jednostrannou adnexektomii s ponecháním druhostranného vaječníku a dělohy. Provedení radikalizující operace se doporučuje po porodu. U pacientek ve stadiu IB v rámci konzervativní operace možno provést oboustrannou adnexektomii s ponecháním dělohy a pacientky poté mohou být zařazeny do programu IVF s donorským oocytem.
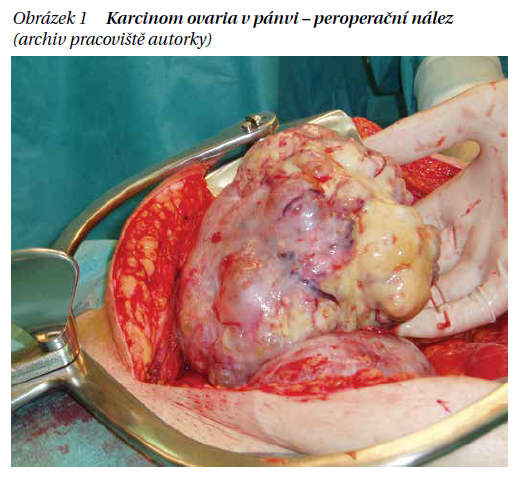
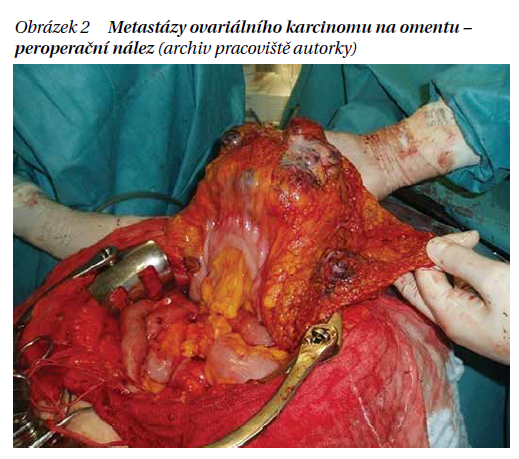
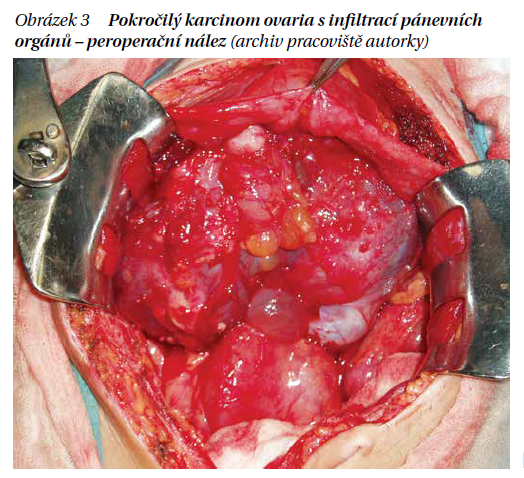
Radikalizující operace (interval debulking surgery – IDS) je druhý operační vstup po předchozím neradikálním nebo neadekvátním výkonu. Většinou se provádí po 3–4 sériích chemoterapie 1. linie. Snahou je odstranit zbylé gynekologické orgány v pánvi a rezidua tumoru. Výkon doplňujeme o omentektomii, appendektomii, lymfadenektomii. Předpokladem pro kompletní výkon je ústup reziduálního tumoru prokázaný zobrazovacími metodami. Po operačním výkonu se následně pokračuje v chemoterapii. V případě popisu CT předoperačního nálezu difuzní hluboké infiltrace radixu mezenteria, miliárního rozsevu, resp. karcinomatózy tenkých kliček v takovém rozsahu, kdy jejich resekce by vedla k syndromu krátkého střeva (pod 1,5 m), difuzní či hluboké infiltrace stěny žaludku a/nebo duodena, postižení hlavy a/nebo střední části pankreatu, postižení truncus coeliacus, hepatických arterií, levé gastrické arterie, či dojde k progresi nálezu při chemoterapii, není IDS indikována.
Hypertermická intraperitoneální chemoterapie (HIPEC) má snahu se zaměřit na reziduální onemocnění po cytoredukční operaci přímým působením na nádorové buňky na peritoneu. Používá se zahřátý roztok chemoterapeutické látky, který je perfundován přes peritoneální prostor. Hypertermie má přímý cytotoxický účinek na nádorové buňky zvýšenou produkcí lyzozomů, synergický účinek s některými chemoterapeutiky (cisplatina, paklitaxel, oxaliplatina a mitomycin), zlepšuje penetraci chemoterapie, pomáhá snižovat rezistenci na cisplatinu a v neposlední řadě hraje imunomodulační roli a zlepšuje imunitní odpověď proti nádorovým buňkám indukcí proteinů tepelného šoku, aktivací buněk prezentujících antigen a migrací lymfocytů. V rámci randomizovaných i nerandomizovaných studií bylo dosaženo protichůdných výsledků. Podle doporučení ESMO není HIPEC považován za standard péče jako léčba první volby. Podle NCCN lze zvážit HIPEC s cisplatinou (100 mg/m2) jako možnost po IDS u žen ve III. stadiu ovariálního karcinomu, které reagovaly nebo měly stabilní onemocnění po třech cyklech neoadjuvantní chemoterapie.
Second look operace zahrnuje odstranění nalezených nádorových ložisek, četné biopsie z malé pánve a dutiny břišní, laváže a eventuální exstirpace zvětšených uzlin.
Paliativní operace se provádí v případě řešení ohraničených solitárních recidiv nebo z důvodů komplikací při progresi onemocnění, nejčastěji při ileózních stavech.
Chemoterapie
Po chirurgické léčbě je primární chemoterapie považována za kurativní. Podmínkou je performance status WHO 0,1,2, předpokládaná délka života více než 6 měsíců, interkurentní onemocnění umožňující dodržet kurativní dávku. Za standardní chemoterapeutický režim v léčbě karcinomu ovaria se považuje kombinovaný režim paklitaxel/karboplatina, který se podává v třítýdenních intervalech. Platinové deriváty a taxany patří k nejúčinnějším cytostatikům. Účinnost cisplatiny a karboplatiny je ekvivalentní, stejně tak jako účinnost paklitaxelu a docetaxelu. Alternativou ve strategii léčby s cílem zlepšit toleranci chemoterapie může být redukce dávek jednotlivých cytostatik v rámci kombinovaného režimu nebo dose-dense režimy. U pacientek vyššího věku a s četnějšími komorbiditami může být volbou monoterapie karboplatinou, která má menší toxicitu.
V případě germinálních tumorů se standardně využívá adjuvantní terapie v režimu BEP (cisplatina 20 mg/m2, etoposid 100 mg/m2, bleomycin 30 mg à 3 týdny), EP (etoposid 20 mg/m2, cisplatina 100 mg/m2 à 3 týdny), CE (etoposid 120 mg/m2, karboplatina 400 mg/m2 à 4 týdny).
Neoadjuvantní chemoterapie je indikována u pacientek ve špatném celkovém stavu, u kterých není iniciálně možná radikální operace. Za standardní režim se také považuje dvojkombinace paklitaxel/karboplatina. Údaje v randomizovaných studiích naznačují, že účinnost neoadjuvantní chemoterapie ve srovnání s primárním operačním výkonem je obdobná.
Intraperitoneální chemoterapie se v současné době nepovažuje za standard. Není vhodná pro pacientky s operačními výkony na střevě v rámci primární operace. Preferovaným režimem byla kombinace paklitaxelu (135 mg/m2 intravenózně D1 v 3–24hodinové infuzi) a cisplatiny (75 mg/m2 intraperitoneálně D2) následovaná podáním paklitaxelu intraperitoneálně D8 (60 mg/m2). Chemoterapie se podává v třítýdenních intervalech, celkově se doporučuje podat 6 cyklů.
Chemoterapie v rámci sekundární léčby bývá zejména u platina rezistentních pacientek, kdy je recidiva nebo progrese onemocnění diagnostikována v kratším časovém odstupu od předchozí linie s platinovým derivátem. Nejčastěji dochází k recidivě v intervalu kratším než 6 měsíců či pacientky progredují při léčbě platinovým derivátem. Ve 2. a další linii lze doporučit léčbu monoterapií nebo kombinaci s bevacizumabem. U indikovaných pacientek lze očekávat největší benefit kombinace chemoterapie s bevacizumabem. Ve studii AURELIA byl kombinovaný bevacizumab s paklitaxelem, topotekanem nebo pegylovaným lipozomálním doxorubicinem. V našich podmínkách lze pacientkám s platina rezistentním onemocněním nabídnout kombinaci paklitaxelu, který je podáván týdně v dávce 80 mg/m2, a bevacizumabu v dávce 10 mg/kg, který je aplikován každých 14 dnů. Bevacizumab je v této indikaci hrazen pouze pacientkám, které nebyly léčeny více než dvěma předchozími liniemi chemoterapie. U platina senzitivních pacientek je terapie recidiv založená na kombinované chemoterapii s platinovým derivátem. U pacientek dosud neléčených antiangiogenní léčbou je možná kombinace CBDCA/gemcitabin/bevacizumab nebo CBDCA/paklitaxel/bevacizumab, nebo Caelyx/CBDCA/bevacizumab.
Regionální paliativní léčba pleurálního výpotku může využítaplikace bleomycinu intrapleurálně.
Cílená biologická léčba (targeted therapy)
Bevacizumab (Avastin) byl v primární terapii testován v randomizovaných studiích ICON7 a GOG 0218. Bevacizumab inhibuje vaskulární endoteliální růstový faktor (VEGF), brání vazbě VEGF na receptory na endoteliích, což vede k normalizaci nádorového krevního řečiště, regresi nádorových cév, zabraňuje neoangiogenezi, a tím inhibuje růst nádoru. Stabilizací cévního řečiště dochází k lepšímu průniku cytostatik a dalších léků k nádorovým buňkám. V našich podmínkách je aktuálně možno léčit bevacizumabem pacientky v rámci 1. linie. Jedná se o pacientky s pokročilým karcinomem vaječníků, vejcovodů nebo primárním nádorem pobřišnice (FIGO stadia IV nebo stadia III u neoperovaných pacientek, nebo stadia III s větším než 1 cm reziduem po operaci). Léčba bevacizumabem se zahajuje s jedním nebo dvěma cykly chemoterapie tak, aby byl zachován odstup minimálně 4 týdny od operace. Bevacizumab je aplikován v dávce 7,5 mg/kg každé 3 týdny v kombinaci s karboplatinou a paklitaxelem po dobu 6 léčebných cyklů. Následně se pokračuje v samostatné léčbě bevacizumabem. Léčba bevacizumabem se ukončuje při trvání léčby 12 měsíců (celkově 18 cyklů) nebo při progresi onemocnění či intoleranci.
PARP inhibitory
PARP 1 je enzym buněčné proliferace a opravy DNA poškození, zejména jednovláknových zlomů v procesu excize bází. DNA PARP1 protein se naváže přímo na místo poškození DNA, zde vytváří rozvětvené řetězce poly (ADP-ribózo) polymeru, na které se vážou další reparační enzymy. Při inhibici PARP se mění neopravené jednoduché zlomy během replikace na zlomy dvojité, které jsou za normálních okolností opravovány bezchybným mechanizmem homologní rekombinace, na které se podílí právě geny BRCA1 a BRCA2. Absence funkční homologní rekombinace nebo procesu excize bází nemá vliv na životaschopnost buněk, ale deficit obou procesů dohromady vede k syntetické smrti buňky. V případě mutace genů BRCA1 a BRCA2 závisí oprava DNA buněk nádoru především na PARP. Pokud je však i PARP inhibován, dochází k chromozomální instabilitě, zástavě buněčného cyklu a apoptóze. Nejvyšší účinnost PARP inhibitorů byla zaznamenána v terapii pacientek s karcinomem vaječníků nesoucím BRCA mutaci, a to buď mutaci zárodečnou, nebo mutaci somatickou. Je ale známo, že aktivita PARP inhibitorů je přítomna také u karcinomů BRCAwt (wild type), zejména u high-grade serózních karcinomů, které vykazují homologní rekombinantní nedostatečnost prostřednictvím mutací nebo jiných molekulových odchylek v dalších kritických genech pro opravu DNA (RAD51C/D, BRIP1, PALB2 atd.). V ČR je k dispozici z řad PAPR inhibitorů preparát olaparib (Lynparza), který je určen k udržovací léčbě dospělých pacientek s relabujícím high-grade serózním epiteliálním karcinomem vaječníků, vejcovodu nebo primárním peritoneálním tumorem s mutací BRCA 1/2 citlivým na léčbu platinou. Po chemoterapii na bázi platiny ve 2. a vyšší linii musí pacientky dosáhnout částečné nebo kompletní odpovědi, po které je nasazena udržovací terapie olaparibem (nejpozději do 8 týdnů po posledním cyklu chemoterapie) a terapie probíhá do progrese či neakceptovatelné toxicity. Přípravek Lynparza je hrazen z veřejného zdravotního pojištění. Podává se 300 mg tbl. p. o. 2× denně kontinuálně do progrese. Dále je z veřejného zdravotného pojištění schválena indikace olaparibu k udržovací léčbě i u nově diagnostikovaných pacientek s pokročilým karcinomem vaječníků, tuby a primárním peritoneálním tumorem, které po chemoterapii na bázi platiny dosáhly odpověď charakteru PR nebo CR – tato indikace je založena na základě výsledků studie SOLO 1. Tato studie fáze III prokázala 70% snížení rizika progrese onemocnění nebo smrti s udržovací léčbou olaparibem po dosažení úplné nebo částečné odpovědi na první linii standardní chemoterapie na bázi platiny u BRCA 1/2 mutovaných pacientek s nově diagnostikovaným pokročilým ovariálním karcinomem. Další indikací přípravku Lynparza je kombinace s bevacizumabem pro udržovací léčbu pacientek s pokročilým high grade epiteliálním karcinomem vaječníků, vejcovodu nebo primárním peritoneálním karcinomem (FIGO III a IV), které dosáhly odpověď po dokončení první linie chemoterapie na bázi platiny a které mají potvrzený deficit homologní rekombinace, definovaný buď mutací BRCA1, BRCA2 a/nebo genomovou nestabilitou.
Dalším PARP inhibitorem, který lze použít v terapii karcinomu ovaria, je niraparib (Zejula).Je indikován bez ohledu na mutace jako monoterapie k udržovací léčbě dospělých pacientek s pokročilým high-grade epiteliálním karcinomem vaječníků stadia FIGO III a IV, vejcovodů nebo primárním karcinomem peritonea, které odpovídají po dokončení první linie chemoterapie založené na platině. Zejula je indikována také v monoterapii k udržovací léčbě dospělých pacientek s rekurentním a na léčbu platinou senzitivním high-grade serózním epiteliálním karcinomem vaječníků, vejcovodů nebo primárním karcinomem peritonea, které částečně či úplně odpovídají na chemoterapii založenou na platině. V indikaci udržovací léčby primárně diagnostikovaného pokročilého ovariálního karcinomu (tzn. u pacientek, které odpovídají na léčbu po dokončení 1. linie platinové chemoterapie) je Zejula hrazena zdravotními pojišťovnami, a to bez ohledu na stav mutací. Udržovací léčba niraparibem musí být zahájena do 12 týdnů po poslední dávce platinového derivátu. Zejula se podává v první linii karcinomu vaječníků v individualizované počáteční dávce podle hmotnosti pacientky a počátečního počtu trombocytů. U pacientek s váhou pod 77 kg a počtem trombocytů pod 150 × 109/litr je udržovací dávka 200 mg. V ostatních případech se podává 300 mg tbl. p. o. 1× denně kontinuálně 3 roky nebo do progrese. U rekurentního karcinomu vaječníků je udržovací dávka 300 mg denně do progrese či toxicity.
Registrační studií pro 1. linii je studie PRIMAí. Jde o studii fáze III, která u pacientek s pokročilým high-grade serózním či endometroidním epiteliálním karcinomem vaječníků, vejcovodu nebo primárně peritoneálním karcinomem (odpovídajícím v 1. linii na léčbu platinou) prokázala snížení rizika progrese nebo úmrtí u pacientek s HRD (s deficitem homologní rekombinace) o 57 %; u ITT skupiny pacientek (tzn. všechny pacientky ve studii bez ohledu na BRCA a stav homologní rekombinace) snížení rizika progrese nebo úmrtí o 38 % a snížení rizika progrese o 60 % u pacienek BRCA mutovaných (explorační analýza). Niraparib prokázal snižení rizika progrese o 32 % dokonce i u špatně léčitelných pacientek bez deficitu homologní rekombinace (tzn. HR proficientních). Další studií podporující užití niraparibu v udržovací léčbě 1. linie ovariálního karcinomu odpovídajícího na platinu je studie PRIME, která prokázala snížení rizika progrese o 55 % pro ITT (nezávisle na BRCA mutacích a stavu HRD) a o 60 % pro pacientky BRCA mutované.
Radioterapie
Radioterapie se u ovariálních nádorů užívá zcela výjimečně v případech při přetrvávajícím ohraničeném ložisku v pánvi při nemožnosti operačního odstranění a rezistenci na chemoterapii.
Hormonální léčba
Hormonální léčba může být podána v případě paliativní terapie recidiv (tamoxifen 20 mg tbl. p. o. denně). Megestrol acetát je spíše podpůrnou léčbou u kachexie. U low grade serózního/endometroidního karcinomu lze podat inhibitory aromatázy (anastrozol, letrozol, exemestan), leuprolid acetát či tamoxifen.
Závěr
Ovariální karcinom řadíme ke zhoubným gynekologickým nádorům s nejvyšší mortalitou a špatnou prognózou na základě pozdní diagnostiky v pokročilém stadiu nemoci. Terapie karcinomu ovaria je postavena zejména na kombinaci primární cytoredukční operace a chemoterapie na bázi platiny a taxanu, která dosahuje vysoké léčebné odpovědi. Přesto u více než poloviny pacientek s kompletní odpovědí na léčbu dochází k recidivě onemocnění. Tyto informace vedly ke hledání nových postupů v systémové léčbě recidivujícího karcinomu ovaria, které by přispěly k prodloužení doby do progrese či celkového přežití. Největšího rozvoje v poslední době zaznamenala cílená molekulárněbiologická léčba. Další nadějí na život těchto žen jsou běžící studie s využitím specifických protinádorových vakcín.
Podpořeno MZ ČR – RVO (MOU, 00209805)
MUDr. Lucie Mouková, Ph.D.
Oddělení gynekologické onkologie, Klinika operační onkologie, Masarykův onkologický ústav, Brno
_______
í González-Martín A, Pothuri B, Vergote I, et al. Niraparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. N Engl J Med. 2019; 381(25): 2391–2402.
