Kastračně rezistentní karcinom prostaty představuje poslední fázi tohoto onemocnění s nejhorší prognózou. Časná identifikace tohoto stadia je nezbytná pro zahájení léčby moderními hormonálními preparáty. Oddálíme tím dobu do vzniku nových nebo progresi stávajících metastáz a prodloužíme nádorově specifické i celkové přežití.
V případě progrese karcinomu prostaty (KP) při první linii hormonální, tj. kastrační léčby (androgen deprivation therapy – ADT), hovoříme o tzv. kastračně rezistentním KP (castration-resistant prostate cancer – CRPC). Jedná se o poslední fázi tohoto onemocnění s nejhorší prognózou v rámci celé diagnózy KP. Ještě v roce 2012 uváděla Doporučení Evropské urologické asociace (EAU) tabulku s rozdělením průměrného celkového přežití (overall survival – OS) v širokém rozsahu 9–36 měsíců (tabulka 1).
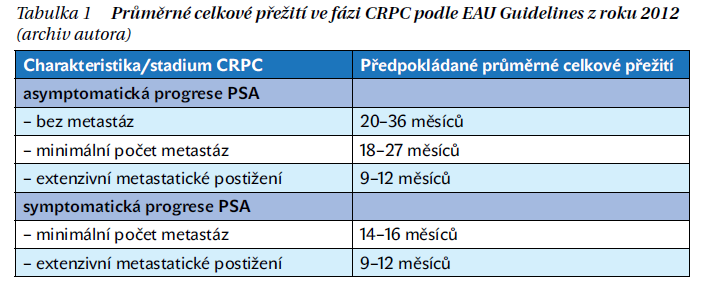
Samotné stadium CRPC můžeme totiž rozdělit do několika dílčích fází podle postupného vývoje onemocnění. Můžeme identifikovat pouze progresi prostatického specifického antigenu (PSA) bez známých metastáz, nejčastěji při ADT zahájené pro relaps onemocnění po radikální léčbě nebo u lokalizovaného KP bez primární radikální léčby. Jedná se tedy o biochemickou progresi.
Další možností je objevení se nových nebo progrese stávajících metastáz, nejčastěji ve skeletu nebo uzlinách. Hovoříme o radiografické progresi. Klinická progrese pak představuje nejčastěji poslední a pro pacienta kritickou fázi CRPC. Objevují se hlavně bolesti limitující denní aktivity, nutnost podávání opiátů, nechutenství, hubnutí nebo samotný život limitující kostní příhody. Radiografická progrese však může nastat i bez té klinické. Současná progrese PSA probíhá téměř vždy, vzácné případy absence vzestupu PSA souvisí nejspíše s určitou transformací klasického acinárního KP směrem k malobuněčné nebo endokrinní složce.
Historie léčby CRPC
Výše zmíněná tabulka prognózy OS se však již v Doporučení EAU od roku 2013 neuvádí, naopak se každým rokem začaly objevovat nové léčebné možnosti CRPC. Historicky totiž při progresi do fáze CRPC bylo možné (při ponechané ADT) přidat pouze starší typy blokátorů androgenního receptoru (bikalutamid, flutamid) s omezeným efektem.
V roce 2004 se objevily publikace s chemoterapií (docetaxel) jako první specifickou linií se vlivem na celkové nebo nádorově specifické přežití (cancer-specific survival – CSS). Postupně se v případě progrese po docetaxelu přidaly nové hormonální preparáty, cílené buď na dosažení ještě nižší kastrační hladiny testosteronu (abirateron), nebo na výrazně účinnější blokádu androgenního receptoru (enzalutamid). Oba preparáty se pak rychle přesunuly před chemoterapii s cílem co nejvíce oddálit její zahájení a s ní související nežádoucí účinky. Došlo také k významnému prodloužení OS ve výše zmíněných studiích. Například před chemoterapií dosáhl medián OS v případě abirateronu 34,7 měsíce, v jiné studii u pacientů léčených enzalutamidem pak 35,3 měsíce. Oba preparáty se pak posunuly ještě blíže do první linie léčby metastatického hormonálně senzitivního KP, kde se k nim připojily další antiandrogeny (apalutamid a darolutamid). Ale to je již jiná kapitola.
Vliv času a nových léčebných možností krásně ilustrovali autoři ze Švédska, kteří analyzovali data 1 712 pacientů s CRPC ze stockholmského registru biopsií z let 2003–2015. Muži, kteří vstoupili do stadia CRPC v roce 2012 a později, měli v případě nemetastatického, respektive metastatického CRPC o 29 %, resp. 40 % nižší riziko úmrtí ve srovnání se skupinou pacientů léčených v letech 2006–2011. U nádorově specifické mortality pak došlo ke snížení o 27 %, resp. 38 %.
Definice CRPC
V roce 2012 také Doporučení EAU zmiňovala CRPC jako „hormonálně refrakterní“ (HRPC). V následujících letech se tento termín z Doporučení opět ztratil, neboť bylo jasně prokázáno, že i při rezistenci na klasickou kastrační léčbu pacienti dobře reagují na nové hormonální preparáty (všechny výše zmíněné). Postupně se také měnila, a hlavně uvolňovala definice CRPC. Ještě v době naší tabulky z roku 2012 musely být pro definici CRPC splněny všechny následující podmínky: (a) kastrační hladina testosteronu < 1,7 nmol/l, (b) progrese PSA (tabulka 2), (c) odejmutí antiandrogenů první generace nebo sekundární hormonální manipulace a (d) radiografická progrese. V současnosti jsou kritéria CRPC výrazně volnější (tabulka 2), musí být udržena kastrační hladina testosteronu a nastat nejméně jedna z možných progresí: (a) biochemická nebo (b) radiografická. Tento posun usnadnil přístup větším skupinám pacientů k moderní hormonální léčbě.

Nemetastatický CRPC
Absence nutnosti radiografické progrese metastáz tak vytvořila zcela nové stadium tzv. nemetastatického CRPC (nmCRPC). Jak zmiňujeme v úvodu, jedná se o pacienty s progresí PSA na kastrační léčbě bez známých metastáz. Mohlo dojít buď k jejich vymizení, častěji však pacienti progredují z původně lokalizovaného nebo lokálně pokročilého onemocnění. Podle kinetiky PSA rozdělujeme nmCRPC do dvou skupin: nízkého a vysokého rizika, tj. podle rizika vzniku metastatického postižení. Pro toto zařazení používáme čas zdvojení PSA (PSA doubling time – PSADT), tedy za jak dlouho (za kolik měsíců) dojde k nárůstu hodnoty PSA na dvojnásobek.
Podle aktuálních Doporučení EAU bychom měli použít nejméně tři (ale ideálně všechny) hodnoty PSA ≥ 0,2 ng/ml, získané v rozmezí maximálně 12 měsíců a v odstupech nejméně čtyři týdny mezi jednotlivými odběry. Pacienti s PSADT ≤ 10 měsíců splňují definici nmCRPC vysokého rizika. Pro tuto populaci pacientů máme pak k dispozici nové hormonální preparáty s účinky potvrzenými ve studiích podobného designu (SPARTAN – apalutamid, PROSPER – enzalutamid, ARAMIS – darolutamid). Apalutamid i darolutamid již mají v ČR stanovenou úhradu pro léčbu nmCRPC, enzalutamid ji bude mít nejspíše od 1. 5. 2023. Kritéria pro zařazení, design i výsledky studií již byly opakovaně popsány, také v časopise Profi Medicína v srpnu 2022 kolegy onkology z Liberce a Prahy (https://profimedicina.cz/soucasne-moznosti-lecby-nemetastatickeho-kastracne-rezistentniho-karcinomu-prostaty/). Zde se zaměříme na praktické aspekty identifikace CRPC a časné nasměrování našich pacientů k další moderní léčbě.
Časná identifikace (nm)CRPC
Modelového pacienta může sledovat ve své ambulanci urolog i onkolog. Dochází například k podávání ADT formou injekcí LHRH analog pro rychlou progresi PSA po radikální prostatektomii nebo radioterapii, bez metastatického postižení na scintigrafii skeletu a CT břicha a pánve. Hormonální léčba může být účinná roky, u nejméně 30 % pacientů však během dvou let dojde k metastatickému postižení kostí.
Úkolem sledujícího lékaře je tedy včas zachytit progresi PSA z často nízkých hladin (např. 0,5 ng/ml). Pokud očekáváme další progresi, lze zkrátit intervaly kontrol PSA a pravidelně kontrolovat hladinu testosteronu, případně spočítat PSADT. Při rychlé progresi (PSADT ≤ 10 měsíců) pak ihned po překročení hladiny PSA hodnotu 2 ng/ml indikovat CT a scintigrafii a při negativním nálezu na zobrazovacích metodách, tj. nmCRPC, indikovat léčbu jedním z hormonálních preparátů (viz odstavec výše).
Podobně postupujeme u pacientů s již potvrzeným metastatickým onemocněním, které léčíme první linií kastrační léčby. Opět se rozhodujeme podle vývoje PSA, pokud hodnota překročí hranici 2 ng/ml, máme potvrzené stadium metastatického CRPC a můžeme indikovat léčbu abirateronem nebo enzalutamidem (před podáním chemoterapie). Nemusíme potvrzovat radiografickou progresi, tj. nemusí se objevit nejméně dvě nové kostní léze nebo zvětšit/objevit se nová ložiska v měkkých tkáních. Smyslem tohoto zrychleného postupu je zajistit účinnou hormonální léčbu pacientům s (ne)metastatickým CRPC co nejdříve. Z tohoto důvodu také stále zdůrazňujeme nutnost úzké spolupráce urologických a onkologických pracovišť, ideálně ve formě pravidelného setkávání v multidisciplinárních uroonkologických týmech. Pokud pacienta sleduje urolog – ambulantní specialista, měl by mít úzkou vazbu na uroonkologickou nebo onkologickou ambulanci, ideálně v rámci komplexního nebo regionálního onkologického centra.
Studie COU–AA–302
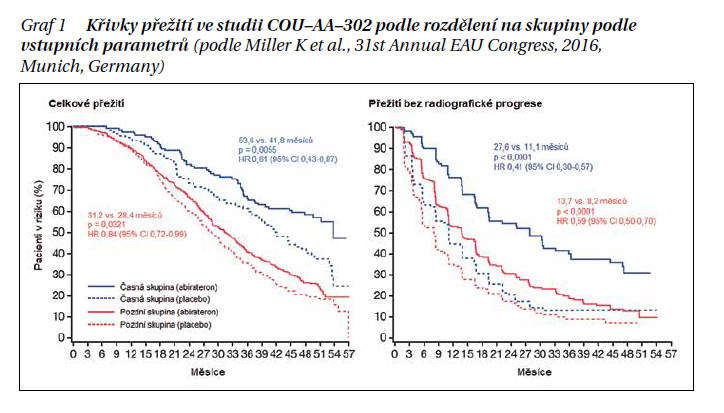
Význam časného zahájení léčby CRPC prokázala subanalýza studie COU-AA-302; abirateron nebo placebo u CRPC v první linii před chemoterapií, kterou v roce 2016 prezentoval Kurt Miller na evropském urologickém kongresu v Mnichově. Pacienty rozdělili do dvou skupin podle bolestivé symptomatologie (žádná vs. mírná), Gleasonova skóre primárního tumoru (< 8 vs. ≥ 8) a hladiny PSA při vstupu do studie (< 80 vs. ≥ 80 ng/ml). Globální výsledky studie byly významně pozitivní pro pacienty léčené abirateronem ve srovnání s placebem, včetně porovnání abirateronu a placeba ve výše uvedených podskupinách. Ve všech sledovaných parametrech (OS, doba do radiografické progrese, do zahájení chemoterapie nebo do podávání opiátů) profitovali z aktivní léčby více pacienti z první, tzv. časné, skupiny. Střední doba OS, respektive přežití bez progrese, byly u pacientů léčených abirateronem delší v první skupině (53,6 vs. 31,2 měsíce, resp. 27,6 vs. 13,7 měsíce) (graf 1).
Zobrazovací metody u (nm)CRPC
Závěrem ještě pár slov k moderním zobrazovacím metodám. Stále častěji využíváme tzv. hybridní metody příští generace, tj. pozitronovou emisní tomografii ve spojení s CT (PET/CT). Pro diagnózu KP máme k dispozici radioligandy 18F-cholin, 18F-fluciklovin a nejnověji 68Ga-PSMA. Musíme však zdůraznit, že pro standardní restagingová vyšetření postačí již výše zmiňovaná scintigrafie skeletu a CT břicha. Tyto metody také byly použity v rámci studií s nmCRPC. Zobrazení pomocí 68Ga-PSMA-PET/CT dosahuje například v případě relapsu PSA po radikální prostatektomii téměř 100% specificity a přibližně 80% pozitivní prediktivní hodnoty pro určení místa rekurence. Pozitivní nálezy na PET/CT také vidíme v případě (nm)CRPC mnohem dříve a mnohem častěji než na konvenčních zobrazovacích metodách. Používáme-li však vyšetření s vyšší přesností, měli bychom tak činit pouze v případě, že výsledek nějak ovlivní náš terapeutický postup. Klinický význam nových zobrazovacích metod také není podložen randomizovanými studiemi. Vlastně tedy nevíme, zda časným zjištěním nových metastáz a časným podáním nových hormonálních preparátů pacientovi prospíváme. Nejspíše ano, ale do výsledků již probíhajících studií platí, že pro pacienta je nejdůležitější včasná identifikace stadia CRPC podle výše uvedených kritérií (tj. postačuje pouze progrese PSA, nemusíme čekat na radiografickou progresi) a v případě urologické ambulance odeslání spolupracujícímu onkologovi.
doc. MUDr. Otakar Čapoun, Ph.D., FEBU
Urologická klinika 1. LF UK a VFN v Praze
