Dlouhodobě incidence karcinomu prostaty, zejména jeho časných stadií, narůstá. V ČR patří mezi nejčastěji diagnostikovaná nádorová onemocnění. Mortalita i přes rostoucí incidenci a prevalenci zůstavá stacionární. Díky novým možnostem diagnostiky a léčby se zlepšily i léčebné výsledky jak časných, tak pokročilých stadií. Nezbytnou součástí léčby je mezioborová spolupráce.
V ČR od roku 2020 probíhá pod záštitou Ministerstva zdravotnictví projekt ProstaPilot, jehož cílem je zhodnotit roli biparametrické magnetické rezonance ve screeningu karcinomu prostaty (KP). Dosud využíváme multiparametrickou magnetickou rezonanci (mp MR) v rámci primárního stagingu pro pozitivní biopsii prostaty, při fúzní biopsii nebo po léčbě.
K vyhodnocení MR má radiolog k dispozici systém PI-RADS klasifikace (Prostate Imaging-Reporting and Data System), aktuálně verzi 2,která využívá 5bodovou škálu rizika přítomnosti KP:
- PI-RADS 1: velmi nízká (přítomnost klinicky významného karcinomu je vysoce nepravděpodobná);
- PI-RADS 2: nízká (nepravděpodobná přítomnost klinicky významného karcinomu);
- PI-RADS 3: střední (přítomnost klinicky významného karcinomu je nejednoznačná);
- PI-RADS 4: vysoká (pravděpodobně je přítomen klinicky významný karcinom prostaty);
- PI-RADS 5: velmi vysoká (klinicky významný karcinom je vysoce pravděpodobný);
- PI-RADS X: součást zkoušky technicky nedostatečná nebo neprovedená.
PI-RADS v2.1 neobsahuje doporučení pro management, protože tato rozhodnutí závisí také na dalších faktorech, jako je prostatický specifický antigen, klinický stav, komorbidity i preference pacienta. Obecně by se však měla biopsie zvážit u lézí PI-RADS 4 nebo 5, nikoli však u lézí PI-RADS 1 nebo 2.
Adenokarcinomy tvoří 95 % nádorů prostaty, kromě histologie patolog hodnotí grading – stupeň diferenciace, kdy G1 je dobře diferencovaný a G5 velmi špatně diferencovaný.
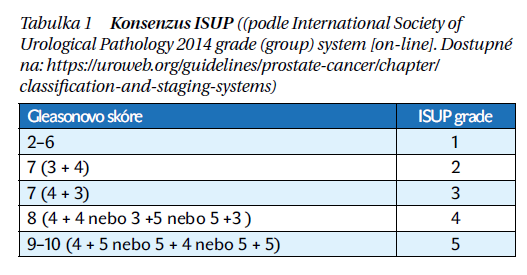
Gleasonovo skóre – hodnoceno patologem – je součtemdvou stupňů diferenciace buněk, nejvíc zastoupeného stupně a druhého nejvíce zastoupeného stupně diferenciace. Výsledkem je hodnota 2−10.
Pro vyhodnocení gradingu u KP existuje konsenzus ISUP (International Society of Urological Pathology) (tabulka 1).
V souvislosti s gradingem KP je m. j. diskutován vývoj v oblasti umělé inteligence (tabulka 2).
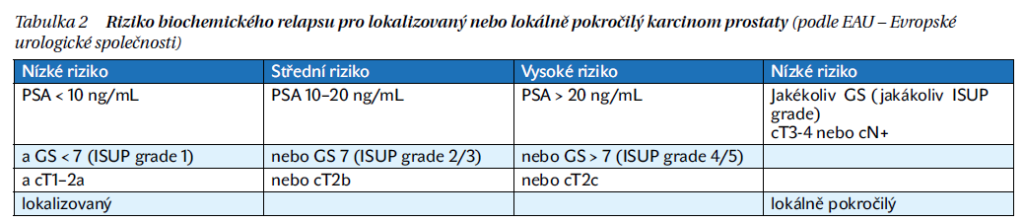
S narůstajícím rizikem stoupá pravděpodobnost vzdálené diseminace.
U pacientů s nízkým rizikem nejsou rutinně indikovány další zobrazovací metody (CT, scintigrafie), u pacientů se středním rizikem od ISUP ≥ 3 (≥ GS 4 + 3) je doporučeno CT břicha a pánve a scintigrafie skeletu, u pacientů s vysokým rizikem by mělo být provedeno CT trupu a scintigrafie skeletu, ev. moderní zobrazovací metody: 18F-cholin PET/CT nebo 68Ga-PSMA PET/CT vyšetření.
Od začátku roku 2023 je možné indikovat 68Ga-PSMA PET/CT u těchto skupin nemocných:
- s vysoce rizikovým KP k upřesnění stagingu před plánovanou kurativní léčbou;
- s biochemickou progresí po kurativní léčbě při hodnotě PSA nad 0,2 μg/l nebo
- perzistující hodnotou PSA po RAPE (radikální prostatektomii);
- po selhání primární hormonální léčby, když přichází v úvahu kurativní záchranná léčba, ev. je zvažována cílená radionuklidová terapie s ligandy PSMA.
Strategie léčby
Léčebné postupy u KP jsou voleny na základě výsledků diagnostických metod s ohledem na celkový klinický stav pacienta, komorbidity a případně i jeho osobní preference. Zatímco u časných stadií KP lze léčbu považovat za kurativní, léčba pokročilého metastatického KP je vždy paliativní a jejím cílem je zachovat kvalitu života.
Pozorné čekání (watchful waiting) znamená konzervativní léčbu u pacientů, kteří jsou od začátku diagnózy KP považováni za nevhodné pro kurativní léčbu. U těchto nemocných sledujeme, zda nedochází k lokální nebo systémové progresi a současně k symptomatické progresi. Při progresi jsou tito nemocní léčeni paliativně. Cílem léčby je zachovat kvalitu života nemocných.
Aktivní sledování (active surveillance) je možné volit u pacientů s velmi nízce rizikovým a/nebo nízce rizikovým karcinomem. Obvykle je indikováno u mužů s předpokládanou dobou přežití > 10 let a jeho snahou je ušetřit muže „zbytečné léčby“ a s ní spojenými vedlejšími účinky. U pacientů se provádějí pravidelné kontroly PSA, MR a rebiopsie.
Existují kritéria pro volbu aktivního sledování, která se mohou se u jednotlivých pracovišť lišit. Nejpřísnější kritéria vyžadují: PSA < 10 ng/ml, Gleasonovo skóre ≤ 6, < 2 nebo méně bioptických vzorků pozitivních a ≤ 20 % postižení buněk.
Pro včasný záchyt případné progrese na mp MR bylo pro radiology vytvořeno tzv. PRECISE skóre, kdy výsledek 3 znamená radiologickou stabilitu, 1 nebo 2 znamená radiologickou regresi a 4 nebo 5 znamená radiologickou progresi. Specifická úmrtnost na karcinom u pacientů v aktivním sledování je velmi nízká (0–1 %).
Prostatektomie
U lokalizovaného nebo malého lokálně pokročilého KP zůstává zlatým standardem chirurgické léčby radikální prostatektomie (RAPE). U stadia cT3 je velmi často následně zjištěno vyšší stadium. Proto je RAPE jako kurativní léčebná metoda vhodná zejména pro pacienty do stadia T3a.
Operace je prováděna otevřeným přístupem, laparoskopicky nebo roboticky. U otevřené radikální retropubické prostatektomie jsou nevýhodou větší krevní ztráty. U laparoskopické prostatektomie kromě menších krevních ztrát je další výhodou i rychlejší rekonvalescence pacienta. Roboticky asistovaná prostatektomie umožňuje operatérovi, který pracuje mimo pacienta, lepší přehled, manipulovatelnost a výsledky. Technika nervy šetřící prostatektomie se provádí za účelem zachování erektilní funkce u KP, který je ohraničen jen na oblast prostaty. Pro dosažení optimálních výsledků histologie je důležitá především jasná a efektivní komunikace mezi chirurgy. Standardní pánevní lymfadenektomie je obvykle provedena u vysoce rizikových pacientů a doporučuje se pro středně rizikovou skupinu. Riziko postižení pánevních lymfatických uzlin lze vypočítat podle nomogramů MSKCC (Memorial Sloan Kettering Cancer Center, Briganti, Partin). U mužů s < 50 % pozitivních vzorků (při biopsii) a karcinomem s nízkým rizikem je riziko zasažení lymfatických uzlin velmi nízké.
Radioterapie
Radioterapie je součástí léčebného algoritmu KP. Podle zdroje záření ji rozlišujeme na zevní a vnitřní – brachyterapii (vhodná pro pacienty T1b–T2a). Zevní radioterapii lze kombinovat s brachyterapií. Podle záměru lze radioterapii KP rozdělit na kurativní, salvage (záchrannou – po radikální prostatektomii) a paliativní.
Díky moderním radioterapeutickým technikám – IMRT (radioterapie s modulovanou intezitou), radioterapie řízená obrazem (IGRT) – je možné dosáhnout vysoké celkové dávky do nádoru s maximálním šetřením okolních tkání. Při volbě celkové dávky radioterapie, léčebné strategie a cílového objemu jsou zohledněny rizikové skupiny. Dávka na oblast prostaty se pohybuje od 70–78 Gy při denní dávce 2 Gy. U starších mužů je možné volit hypofrakcionaci vyšší denní dávku a nižší celkovou dávku.
Fotonová, ev. protonová zevní radioterapie jsou účinné při dosahování vysoké úrovně
konformní radioterapie se srovnatelnou biochemickou kontrolou a profily dlouhodobých vedlejších účinků. Přesnost léčby zaručuje denní lokalizace prostaty, např. obrazem řízená RT (IGRT) pomocí CT, ultrazvuku, implantovaných referenčních značek nebo elektromagnetické zaměřování/sledování. Endorektální balónky lze použít ke zlepšení imobilizace prostaty, používají se také spacery umístěné mezi prostatu a rektum, které slouží k odtlačení rekta a ke snížení dávky na tuto oblast. Cílem je snížit poradiační nežádoucí účinky.
Stereotaktická radioterapie (SBRT) se využívá zejména u oligometastatického onemocnění, např při metastázách ve skeletu.
Brachyterapie lokalizovaného KP využívá permanentní „low dose rate“ (LDR) implantaci s paladiovými (Pd103) nebo jodovými zrny (I125) nebo dočasnou „high dose rate“ (HDR) brachyterapii s použitím iridiových zrn (Ir192). Paladium je spíše vhodné pro rychleji rostoucí tumory, jód pro pomalu rostoucí tumory.
Hormonální terapie
Hormonální terapie je nedílnou součástí léčby KP. Cílem hormonální manipulace je snížit hodnoty testosteronu na kastrační úroveň, tj. na hodnotu 50 ng/dl (1,7 nmol/l).
Využívá se u lokálně pokročilého KP, s radioterapií pro vysoce a středně rizikové KP, v neoadjuvanci (před radioterapií), v adjuvanci (po radioterapii), ev. po operaci při metastázách v lymfatických uzlinách, při biochemickém relapsu a krátkém zdvojovacím čase PSA (PSADT), při generalizovaném KP (obrázek 1).
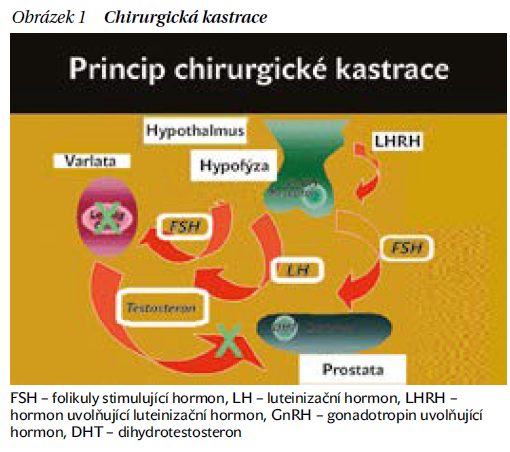
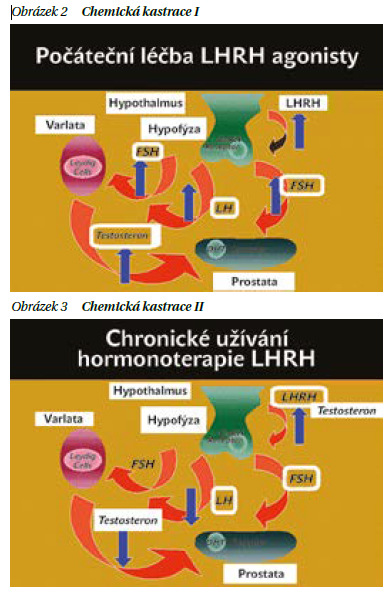
Při tzv. chemické kastraci jsou nejčastěji využívány analoga hormonu uvolňujícího luteinizační hormon (LHRH analoga) (obrázky 2 a 3). Tyto látky působí stejně jako hormony přirozeně vytvářené částí mozku hypothalamem. Mají prodlouženou dobu působení. Účinek chemické medikamentózní kastrace nastupuje později než u chirurgické kastrace (obrázek 1),většinou během jednoho měsíce a tento účinek je částečně vratný. Po vysazení hormonální léčby dochází k pozvolnému vzestupu testosteronu. Při podávání léků ze skupiny LHRH analog je potřeba jako prevenci přechodného vzestupu testosteronu (tzv. flare up fenoménu) podávat antiandrogen po dobu cca 4 týdnů a nejméně 5 dnů před zahájením léčby.
Kombinace LHRH agonistů a antiandrogenu, tzv. maximální androgenní blokáda (obrázek 4), se v současnosti používá v prevenci flare fenoménu. Dříve byla tato kombinace doporučována při selhání léčby LHRH. Vzhledem k omezené účinnosti a vzhledem k nežádoucím účinkům se již nepoužívá.
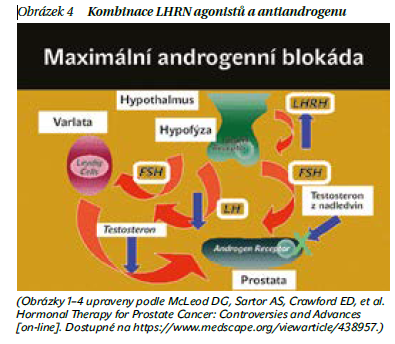
Při zahájení léčby LHRH antagonisty (degarelixem nebo relugolixem) není potřeba podávat antiandrogen. Mezi nejčastěji používaná LHRH analoga patří leuprorelin l (Eligard), goserelin (Zoladex), triptorelin (Dipherelin) a mezi LHRH antagonisty patří degarelix (Firmagon) a relugolix (Orgovyx).
Jiným typem hormonální léčby jsou steroidní a nesteroidní antiandrogeny. Nesteroidní antiandrogeny (bikalutamid)blokují vazbu androgenů na strukturu v jádře, tzv. androgenní receptor. Hladina testosteronu není snížena, může být zvýšena. Dříve využívané steroidní androgeny působily podobně jako nesteroidní, ale navíc snižovaly hladinu testosteronu také přes LHRH.
Jako antiandrogeny vyšší generace jsou někdy označovány preparáty ARTA (androgen receptor targeted agent). Abirateron blokuje produkci androgenů vytvářených nejen varlaty, ale také blokuje tvorbu androgenů v nadledvinách i v samotném nádoru. Enzalutamid, apalutamid a darolutamid jsou inhibitory signalizace androgenních receptorů, keré zablokují androgenní signální dráhu na několika úrovních (vazbu androgenu na androgenní receptory, translokaci aktivovaných receptorů do jádra a spojení aktivovaného androgenního receptoru s DNA). Darolutamid na rozdíl od apalutamidu a enzalutamidu neprochází hematoencefalickou bariérou a díky tomu má příznivější bezpečnostní profil.
Klinické studie s ARTA
První klinickou studií, která zařadila ARTA u pacientů odpovídajících na hormonální léčbu, byla studie LATITUDE, do níž byli zařazeni pacienti za podmínek splnění 2 ze 3 tzv. high risk kritérií: (1) GS ≥ 8, (2) ≥ 3 kostní metastázy, (3) viscerální metastázy.
ARTA byla zařazena do algoritmu léčby metastatického kastračně rezistentního karcinomu prostaty (mCRPC) v prechemo- a postchemoindikaci před více než 10 lety (studie PREVAIL, AFFIRM, AA-COU-302, AA-COU 301).
Následně proběhly další klinické studie a léčba ARTA se stala součástí léčby metastatického hormonálně senzitivního karcinomu prostaty (mHSPC/LATITUDE), v dalších studiích jsou ARTA kombinována s chemoterapií sekvenčně (ARCHES, TITAN) nebo konkomitantně (ENZAMET, PEACE ARASENS).
V současnosti probíhají klinické studie s dalšími skupinami léků (např s inhibitory PARP, poly ADP ribóza polymeráza), ipatasertibem, imunoterapií (pembrolizumabem). Začátkem srpna 2023 schválila FDA kombinaci abirateron a niraparib (PARP inhibitor) do 1. linie léčby metastatického kastračně rezistentního KP (na základě výsledků studie MAGNITUDE). Ve studii PROpel kombinace olaparib + abirateron prokázala prodloužení přežití bez progrese (PFS) oproti samotnému abirateronu. Tato kombinace zatím nemá úhradu ze zdravotního pojištění. U generalizovaných karcinomů prostaty se častěji objevují mutace v genech opravujících DNA, např. BRCA 1, 2, ATM, CHEK 1/2, RAD. Tito nemocní mají obecně horší prognózu. Volba první linie léčby kastračně rezistentního KP bude v blízké budoucnosti ovlivněna zavedením tripletové terapie do klinické praxe u pacientů s mHSPC.
Vysoce rizikoví jsou pacienti s metastázami, které splňují tzv. high volume (HV) – podle CHAARTED klinická studie s docetaxelem. Tito nemocní mají viscerální metastázy a 1 skeletální metastázu nebo nejméně 4 kostní metastázy, z nichž minimálně 1 metastáza byla uložena mimo axiální skelet. U těchto nemocných je současně s hormonální léčbou zahájena i chemoterapie. Po selhání hormonální léčby máme možnost k ADT přidat buď ARTA, nebo chemoterapii.
Chemoterapie
Chemoterapii volíme obvykle u pacientů s klinickou symptomatologií a krátkým doubling time PSA (zdvojovací čas PSA). Docetaxel byl prvním cytostatikem, které prodloužilo OS (celkové přežití) pacientů s kastračně rezistentním KP.
Kastrační rezistence je definována kastrační hladinou sérového testosteronu < 50 ng/dl nebo 1,7 nmol/l a současně buď biochemickou progresí (tj. 3 po sobě jdoucí vzestupy PSA s odstupem alespoň jednoho týdne, což má za následek dvě 50% zvýšení nad nejnižší hodnotu a PSA > 2 ng/ml), nebo radiologickou progresí – objevení se nových lézí (2 nebo více nových kostních lézí na kostním skenu), nebo léze měkkých tkání pomocí RECIST (Response Evaluation Criteria in Solid Tumours). Pouze symptomatická progrese musí být dále dovyšetřena.
Z cytostatik využíváme docetaxel, kabazitaxel u metastatických neuroendokrinních KP je léčba založena na platinových derivátech.
Teranostika
Radiofarmaka byla v paliativní léčbě metastatického KP využívána již dříve. Pacienti bez mimoskeletálních metastáz po selhání hormonální terapie mohou být léčeni radiofarmakem alfaradin – izotop Ra 223. Podává se v 6 injekcích v intervalu 28 dnů.
Novější 177 Lu PSMA (Pluvicto) je radiofarmakum, které se specificky zaměřuje na molekulu na povrchu buněk KP zvanou PSMA. Tato terapie se používá na základě výsledku diagnostického PSMA PET CT (gallium-68 PSMA). Jak lutecium-177 PSMA, tak gallium-68 PSMA byly schváleny FDA v březnu 2022 a na základě prodloužení přežití bez progrese a prodloužení celkového přežití u pacientů s PSMA pozitivním metastatickým KP neodpovídajícím na hormonální léčbu (tj. s metastatickým kastračně rezistentním onemocněním). 177 Lu PSMA není zatím v ČR k dispozici, kromě klinických studií.
Paliativní léčba klade důraz na podpůrnou léčbu. Při kostních metastázách KP podáváme bisfosfonáty – snižují kostní resorpci a snižují riziko vzniku patologické zlomeniny, mezi nejčastěji používané bisfosfonáty patří denosumab (RANK ligand inhibitor).
Součástí podpůrné léčby je vyhovující nastavení analgetické medikace. Ke zmírnění bolestí, zejména ve skeletu, kromě opioidních analgetik můžeme využít např. paliativní radioterapii.
Při prevenci a řešení patologických zlomenin je v rámci multidisciplinárního týmu nutná úzká spolupráce s ortopedy a spondylochirugy.
Závěr
Ke stanovení optimálního léčebného postupu u metastatického KP jsou očekávány výsledky klinických studií, ale snahou je identifikovat prediktivní a prognostické biomarkery cestou NGS (next-generation sequencing, sekvenování příští generace).
MUDr. Darja Šustrová
Onkologická klinika 2. LF UK a FN v Motole
