Primárním cílem hypolipidemické léčby je hladina LDL cholesterolu, jejíž doporučená hodnota odpovídá stanovenému kardiovaskulárnímu riziku nemocných. Kromě vlastní léčby diabetu je u převážné většiny pacientů indikována farmakoterapie včetně kombinace hypolipidemik. Z hlediska redukce kardiovaskulárního rizika je důležité využít maximálně tolerovanou dávku statinů. V dalším kroku přidáváme ezetimib a u vysoce rizikových nemocných je indikována léčba inhibitory proprotein konvertázy subtilisin/kexin typu 9. Nově by měla být k dispozici také kyselina bempedoová. Terapie primárně ovlivňující hladinu triglyceridů má omezený význam.
Diabetes mellitus (DM) zvyšuje kardiovaskulární (KV) riziko nemocných, zejména při delším trvání neuspokojivé kompenzace a nedostatečné korekce ostatních KV rizikových faktorů, jež diabetes provází. Velká analýza, která zahrnula více než 4,5 milionu diabetiků 2. typu s průměrným trváním DM 10 let, zjistila, že zhruba každý třetí diabetik má nějaké KV onemocnění, dominantně aterosklerotického původu. Dyslipidemie patří mezi rizikové faktory s největším potenciálem pro terapeutické ovlivnění KV rizika diabetiků, hlavně pro možnost redukce jejich makrovaskulárních komplikací.
V letošním roce byla publikována nová evropská doporučení pro léčbu KV onemocnění u nemocných s diabetem, která se mimo jiné věnují i léčbě diabetické dyslipidemie. Tato doporučení vycházejí z přesnější stratifikace nemocných, která je založena na eventuálně přítomném aterosklerotickém KV onemocnění, specifických orgánových komplikacích či na určité hodnotě SCORE2-Diabetes. Cílové hodnoty LDL cholesterolu (LDL-C) pak odpovídají stanovenému riziku konkrétního pacienta (schéma 1). Nová je tedy přesnější stratifikace KV rizika, cílové hodnoty se v porovnání s předchozími doporučeními nemění.
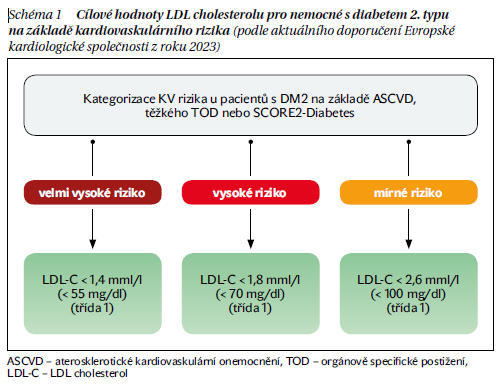
Těžké TOD zahrnuje pokles stanovené glomerulární filtrace (eGFR) < 45 ml/min/1,73 m2 bez ohledu na albuminurii nebo eGFR 45–59 ml/min/1,73 m2 a (mikro)albuminurii, tzn. poměr albumin/kreatinin v moči (ACR) 30–300 mg/g nebo proteinurii (ACR > 300 mg/g) nebo přítomnost mikrovaskulárního postižení na třech různých místech (tzn. mikroalbuminurie plus retinopatie plus neuropatie). SCORE2-Diabetes lze pro každý region (ČR patří mezi regiony s vysokým KV rizikem) zjistit z tabulek, kde se zadává 7 parametrů: věk v době diagnózy diabetu (zohledňuje trvání diabetu), kouření či nekouření, hodnoty systolického krevního tlaku, celkového cholesterolu, HDL cholesterolu, glykovaného hemoglobinu HbA1c a eGFR.
Tabulky jsou určeny zvlášť pro ženy a pro muže ve věku 40–69 let. Lze též využít on-line kalkulátor. Osoby s hodnotou SCORE2-Diabetes ≥ 20 % mají velmi vysoké KV riziko, 10–20 % vysoké KV riziko, 5–10 % střední KV riziko a < 5 % nízké KV riziko.
Principy léčby dyslipidemie u diabetiků
Principy léčby diabetické dyslipidemie vycházejí z dosažení cílových hodnot aterogenních lipidů podle KV rizika nemocných. Primární je dosažení cílových hodnot pro LDL-C. Případně se lze orientovat podle sekundárních lipidových parametrů (non-HDL cholesterolu a/nebo apolipoproteinu B). Lékem první volby zůstávají statiny. Pokud maximálně tolerovaná dávka statinu nevede k dosažení cílových hodnot LDL-C, lékem druhé volby je ezetimib. U pacientů s velmi vysokým KV rizikem, kteří nedosáhnou cílových hodnot LDL-C výše uvedenou kombinací či ji netolerují, je namístě léčba inhibitory proprotein konvertázy subtilisin/kexin typu 9 (PCSK9). Jejich alternativou může být inklisiran. Nově bude zejména pro statin intolerantní pacienty k dispozici kyselina bempedoová. Fibráty a další terapeutické prostředky snižující hladinu triglyceridů (TG) mají omezené využití.
Statiny představují základní pilíř léčby diabetické dyslipidemie, protože mohou zásadním způsobem změnit KV riziko. Jak ukázala metaanalýza 18 686 osob s diabetem léčených pomocí statinů, je každé snížení koncentrace LDL-C o 1 mmol/l provázeno poklesem koronárních příhod o 22 %, koronárních revaskularizací o 25 %, cévních mozkových příhod (CMP) o 21 %, kardiovaskulární mortality o 13 % a celkové mortality o 9 %. U diabetiků s vysokým nebo velmi vysokým KV rizikem je primárně indikována léčba vysoce intenzivními statiny (rosuvastatin a atorvastatin ve vyšších dávkách), protože snižují LDL-C o více než 50 %. Příznivý efekt na redukci KV příhod převažuje nad potenciálně diabetogenním účinkem těchto léků.
Statiny jsou bezpečné a obecně dobře tolerované. Subjektivní nežádoucí účinky (jako je únava a myalgie) jsou častější než objektivní nálezy v důsledku nocebo efektu, a to zejména u žen. Existují důkazy, že 70–90 % pacientů, kteří uvádějí intoleranci statinů v minulosti, jsou při opětovné expozici statin schopni užívat. Ke zvýšení adherence k léčbě můžeme využít několik fixních kombinací statinů s jinými léčivy. K dispozici jsou fixní kombinace s nestatinovými hypolipidemiky (ezetimibem, fenofibrátem) a také s hypertenzivy (amlodipinem či perindoprilem). Tato kombinace je u diabetiků velmi vhodná, neboť až dvě třetiny nemocných s diabetem mají dyslipidemii a hypertenzi zároveň.
Ezetimib představuje další lék primárně snižující hladinu LDL-C. Nejčastěji jej používáme jako součást kombinované terapie hlavně u nemocných, u kterých nebylo dosaženo cílových hodnot lipidů při maximální tolerované dávce statinů. Monoterapie ezetimibem vede (v dávce 10 mg) k redukci LDL-C okolo 10–20 %. Přidání ezetimibu ke statinu je pak účinnější než zdvojnásobení jeho dávky a je srovnatelné se zvýšením počáteční dávky statinu asi na trojnásobek. Podle některých dat se zdá, že kombinace statin + ezetimib je v redukci LDL-C úspěšnější právě u nemocných s diabetem. Možným vysvětlením by mohla být zvýšená exprese Niemann-Pick C1 like 1 proteinu (prostřednictvím kterého ezetimib inhibuje resorpci cholesterolu z GIT) na povrchu enterocytů v důsledku chronické hyperglykemie.
Nejpřesvědčivější důkazy o redukci KV rizika pomocí ezetimibu přinesla studie IMPROVE‑IT. Porovnávala efekt kombinace 40 mg simvastatinu a 10 mg ezetimibu vůči 40 mg simvastatinu podávaného samostatně u nemocných po akutním koronárním syndromu. Primárně sledovaný ukazatel zahrnoval úmrtí z KV příčin, nefatální infarkt myokardu, nefatální ischemickou CMP, nestabilní anginu pectoris vyžadující hospitalizaci nebo jakoukoli koronární revaskularizaci prováděnou nejméně 30 dní po randomizaci. Ve skupině pacientů užívajících kombinační léčbu byl zaznamenán signifikantní pokles KV příhod ve srovnání se skupinou léčenou pouze simvastatinem, a to o 6,4 %. Pokles v diabetické populaci dosáhl 15 %, což bylo dáno především významnou redukcí nefatálních infarktů myokardu a ischemických CMP.
Léčbu ezetimibem včetně jeho podávání se statiny pacienti velmi dobře tolerují. Dostupnost fixních kombinací s ostatními hypolipidemiky (simvastatinem, atorvastatinem, rosuvastatinem, nově také s kyselinou bempedoovou) činí tuto terapii ještě jednodušší a zlepšující adherenci nemocných. Vzhledem k tomu, že ezetimib (na rozdíl od statinů) nezvyšuje riziko diabetu, může být u jedinců s prediabetem podání ezetimibu s menší dávkou statinu bezpečnější (s ohledem na progresi diabetu) než intenzivní monoterapie statinem. Recentně publikovaná studie RANCING navíc ukázala, že v redukci KV příhod byla kombinace ezetimibu se střední dávkou rosuvastatinu stejně účinná jako vysoce dávkovaný rosuvastatin, přičemž byla lépe tolerovaná a více jedinců dosahovalo cílových hodnot LDL-C.
Kyselina bempedoová by měla být v ČR dostupná od prosince 2023. Jedná se o proléčivo, které se může aktivovat jen v hepatocytu navázáním na koenzym A (CoA) pomocí enzymu acyl-CoA-syntetázy. Aktivní metabolit pak inhibuje ATP citrát lyázu, což (podobně jako statin) snižuje endogenní syntézu cholesterolu. To je spojeno s větší expresí LDL receptorů na povrchu hepatocytů a poklesem koncentrace LDL-C v séru. Kyselina bempedoová snižuje v monoterapii LDL-C asi o 15–25 %, v kombinaci s ezetimibem pak až o 40–45 %. Aktivace kyseliny bempedoové vazbou s CoA neprobíhá v myocytech, a tak nedochází k potenciálnímu poškození svalů. Proto je její podávání spojeno s menším výskytem nežádoucích účinků a lze ji využít zejména u jedinců statin intolerantních, kteří trpí svalovými obtížemi. Kyselina bempedoová není spojena se zvýšeným rizikem vzniku diabetu. Mezi její nejčastější nežádoucí účinky patří hyperurikemie (včetně dnavého záchvatu), anémie, cholelitiáza, zvýšení jaterních transamináz, urey i kreatininu a pokles glomerulární filtrace. Kyselina bempedoová zvyšuje plazmatické koncentrace statinů. V průběhu souběžné léčby je třeba sledovat výskyt nežádoucích účinků spojených s užíváním statinů, zejména příznaky možné statinové myopatie.
Recentně byla publikovaná studie CLEAR Outcomes, která prokázala u statin intolerantních jedinců s vysokým KV rizikem, že přidání 180 mg kyseliny bempedoové denně vede vůči placebu k 13% redukci čtyřbodového složeného KV endpointu (4-MACE): KV úmrtí, nefatálních infarktů myokardu, nefatálních CMP a koronárních revaskularizací. Tříbodový MACE (3-MACE = 4-MACE mimo revaskularizace) byl redukován o 15 % a například výskyt fatálních a nefatálních infarktů myokardu byl snížen o 23 %. Signifikantní redukce KV příhod byla patrná taktéž u nemocných s diabetem. Z prostředků veřejného zdravotního pojištění bude možné předepsat kyselinu bempedoovou u statin intolerantních nemocných, kteří nejsou vhodní pro léčbu PCSK9 inhibitory nebo inklisiranem, jako další lék ke stávající léčbě ezetimibem, pokud se bude jednat o nemocné s vysokým KV rizikem a jejich LDL-C ≥ 2,6 mmol/l, nebo o nemocné s velmi vysokým KV rizikem a jejich LDL-C ≥ 1,8 mmol/l.
PCSK9 inhibitory představují další možnost hypolipidemické léčby. Máme k dispozici monoklonální protilátky, které snižují cirkulující hladiny PCSK9, anebo inklisiran, který specificky tlumí tvorbu PCSK9 v játrech (vede v cytoplazmě hepatocytů k potlačení produkce PCSK9 inhibicí translace genetické informace pomocí cílené degradace specifické mRNA). Obojí je provázeno zvýšenou recyklací LDL receptorů na povrch buněčné membrány. Díky tomu se akceleruje clearence apoB obsahujících lipoproteinů (zejména LDL částic) a klesá jejich plazmatická koncentrace. Monoklonální protilátky proti PCSK9 snižují hladinu LDL-C asi o 50–65 %, inklisiran v průměru redukuje hladinu LDL-C okolo 50 %. Z hlediska diabetické dyslipidemie je důležitý také účinek PCSK9 inhibitorů na hladiny non-HDL-C a apoB. U nemocných s diabetem vedlo podávání alirokumabu či evolokumabu k poklesu non-HDL-C o 40–55 % a apoB o 30–50 %.
Inhibitory PCSK9 významně snížily výskyt MACE v podskupinách pacientů s diabetem a aterosklerotickým KV onemocněním, kteří byli zařazeni do studie FOURIER s evolokumabem či ODYSSEY OUTCOMES s alirokumabem. Vzhledem tomu, že výskyt KV příhod byl u diabetiků vyšší než u ostatních jedinců, byl v obou studiích zaznamenán větší pokles absolutního rizika KV příhod než u nediabetiků. Podávání PCSK9 inhibitorů nevedlo ani v jedné studii ke zvýšené incidenci nového diabetu či nárůstu glykemie a léčba byla velmi dobře tolerovaná. Také inklisiran je z hlediska úpravy lipidového spektra u diabetiků stejně účinný jako u nediabetiků. Zatím však nemáme k dispozici výsledky klinických hodnocení, které by sledovaly výskyt KV příhod (ORION-4, VICTORION-2P). Lze je očekávat asi za 2–3 roky.
Hlavní limitací podávání PCSK9 inhibitorů zůstává jejich cena. Z prostředků veřejného zdravotního pojištění je léčba monoklonálními protilátkami (evolokumabem či alirokumabem) v současné době diabetikům hrazena, pokud mají aterosklerotické KV onemocnění, jsou na maximální tolerované dávce statinů v kombinaci s ezetimibem a hladina jejich LDL-C ≥ 2,5 mmol/l. Stejná kritéria platí, pokud nemocní léčbu statiny či ezetimibem netolerují. V případě léčby inklisiranem úhradové podmínky také vyžadují přítomnost manifestního aterosklerotického KV onemocnění, hypolipidemickou léčbu maximálně tolerovanou dávkou statinu v kombinaci s ezetimibem a hladinu LDL-C ≥ 2,0 mmol/l. Tato kritéria platí i pro úhradu pacientům, u kterých je léčba statinem prokazatelně kontraindikována či netolerována. Nevyužití ezetimibu v rámci stávající hypolipidemické terapie musí být medicínsky zdůvodněno.
Fibráty jsou léky dominantně snižující hladinu TG (o 20–50 %). Koncentraci LDL-C mohou snížit o 5–15 % a HDL-C zvýšit o 5–20 %. Fenofibrát může ovlivnit výskyt některých mikrovaskulárních komplikací, zejména diabetické retinopatie. Ovlivnění makrovaskulárních komplikací a KV rizika u nemocných s diabetem je limitované. Fenofibrát ve studii FIELD sice signifikantně snížil výskyt některých KV příhod (zejména nefatálních infarktů myokardu a revaskularizací), nevedl však k poklesu CMP, KV ani celkové mortality. A ve studii ACCORD pak přidání fenofibrátu k simvastatinu nebylo provázeno poklesem KV příhod. Subanalýza jedinců s aterogenní dyslipidemií (TG > 2,3 mmol/l a HDL-C < 0,9 mmol/l) sice ukázala na určitý význam při redukci KV rizika, nicméně nedávno předčasně ukončená studie PROMINENT s pemafibrátem nezaznamenala ani u těchto jedinců (diabetiků 2. typu s aterogenní dyslipidemií), že by jeho podávání vedlo k poklesu incidence KV příhod.
Aktuální doporučení zmiňují v případě přetrvávajících zvýšených hodnot TG možnost doplnění stávající statinové léčby ještě o etylester kyseliny eikosapentaenové. Tento preparát vedl ve srovnání s placebem ve studii REDUCE-IT k poklesu KV příhod o 25 %. Metodologicky je však studie kritizovaná, protože jako placebo byl použit minerální olej, který zvyšoval hladinu LDL-C a C reaktivního proteinu, což mohlo ovlivnit příznivý efekt testované látky. Z praktického hlediska se jedná o preparát, který není u nás běžně dostupný a v zahraničí je poměrně drahý. Nemá stanovenu úhradu, spadá spíše do kategorie potravinových doplňků a jeho podávání provází řada nežádoucích gastrointestinálních účinků.
Závěr
Diabetická dyslipidemie představuje závažnou komorbiditu diabetu, která se významnou měrou podílí na KV riziku nemocných. Kromě vlastní léčby diabetu a nefarmakologických opatření směřujících k ovlivnění inzulinové rezistence (redukce hmotnosti, pohybová aktivita a dietní opatření) je u převážné většiny pacientů indikována farmakoterapie, včetně využití kombinace několika hypolipidemik. Samozřejmostí by mělo být komplexní ovlivnění KV rizika včetně adekvátní léčby hypertenze, zanechání případného kouření a využití antidiabetické terapie spojené s kardiovaskulární a renální protektivitou.
prof. MUDr. David Karásek, Ph.D.
III. interní klinika – nefrologická, revmatologická a endokrinologická LF UP a FN Olomouc
