Stillova nemoc dospělých se řadí mezi vzácné choroby. K jejím projevům patří vysoké horečky, muskuloskeletální postižení, kožní manifestace a vysoké počty leukocytů s převahou neutrofilů. Závažnou manifestací je syndrom aktivovaných makrofágů. Glukokortikoidy, methotrexát a inhibitory IL-1 a IL-6 představují základní kameny její léčby.
Stillovu nemoc dospělých (adult onset Still’s disease – AOSD) popsal jako samostatnou nozologickou jednotku počátkem 70. let 20. století Eric Bywaters. Jedná se o chorobu prakticky totožnou se systémovou formou juvenilní idiopatické artritidy (SJIA), zvanou také Stillova choroba dětí. Přesné patogenetické mechanizmy vzniku dětské i dospělé formy této nemoci nejsou zcela známy, ale jedná se o prototyp nedědičné, sporadické formy systémového onemocnění na pomyslné křižovatce mezi autoinflamatorními a autoimunitními chorobami. Autoinflamatorní procesy vycházejí z poruch vrozené imunity, jsou spojeny s dysregulací makrofágů a neutrofilů při odpovědi na vnější či vnitřní signály. Autoimunitní procesy jsou naproti tomu charakterizovány zejména silnou rolí poruchy adaptivní imunity mediované dendritickými buňkami, T a B lymfocyty a jsou spojené s přítomností autoprotilátek, které se mohou podílet na jejich patogenezi a slouží často jako diagnostický či prognostický biomarker. AOSD patří mezi vzácné choroby, incidence choroby se udává 0,16–0,4/100 000 osob s prevalencí 1–34 postižených na milion osob. Poměr pohlaví je téměř vyrovnaný jen s lehkou převahou žen. Nemoc se objevuje převážně u mladých dospělých (16–35 let), jsou ale i případy manifestující se v pozdějším věku.
Patogeneze choroby
Patogeneze AOSD není zcela prozkoumaná a na jejím vzniku se podílí porucha vrozené i adaptivní imunity. Choroba je charakterizovaná vznikem aberantních proinflamatorních dějů, které ústí v typickou klinickou manifestaci.
Klinický obraz
Mezi základní klinické projevy patří horečky, artritidy, myalgie a artralgie a kožní manifestace. Existují dva navzájem se prolínající fenotypy choroby: systémový typ, manifestující se zejména horečkou, vyrážkou a postižením vnitřních orgánů, a artikulární typ podobný více revmatoidní artritidě.
Vysoká horečka se objevuje prakticky u všech nemocných s febrilními špičkami přesahujícími 39 °C. Typ horečky připomíná infekční či přímo septické stavy. Horečka může být prvním příznakem nemoci.
Artritidy nebo artralgie jsou častým projevy choroby, postihují především zápěstí, kotníky či kolenní klouby a zpočátku mohou být mírné a přechodné. Při chronickém průběhu choroby se však často objevuje symetrická, destruktivní polyartritida, která vede k ankylózám postižených kloubů, predilekčně v oblasti zápěstí. Choroba se projevuje také bolestmi svalů, které nejsou doprovázeny nárůstem svalových enzymů. V rámci choroby se může objevit růžový exantém na trupu i na končetinách, je často prchavý a mívá charakter makulopapulózní vyrážky. U těžších forem choroby vyrážka přetrvává i několik týdnů. Mezi manifestace AOSD patří také lymfadenopatie, splenomegalie, hepatomegalie a elevace jaterních enzymů, faryngitida s bolestmi hrdla, serozitida s projevy pleuritidy či perikarditidy. Mezi vzácné projevy se pak řadí plicní fibróza či infiltráty, pankreatitida, aseptická peritonitida, intersticiální nefritida, glomerulonefritida, amyloidóza ledvin, neurologické postižení ve formě parézy hlavových nervů či aseptické meningitidy.
Laboratorní leukocytóza: Často bývá detekovaná výrazná leukocytóza (> 10 000/mm3) s převahou (> 80 %) neutrofilů. U závažných komplikací choroby může počet leukocytů rychle klesat až k projevům cytopenie (syndrom aktivovaných makrofágů).
Laboratorní nálezy: Pro AOSD neexistuje specifický diagnostický test. Mimo výrazné neutrofilní leukocytózy se u akutního vzplanutí AOSD nacházejí prakticky vždy vysoké hladiny reaktantů akutní fáze (CRP, sedimentace erytrocytů, fibrinogen, imunoglobuliny). Časté jsou rovněž elevace hladin jaterních enzymů. Analýza přítomnosti autoprotilátek (revmatoidní faktor, antinukleární protilátky, ANCA), která se provádí z diferenciálnědiagnostických důvodů, je negativní.
Poměrně charakteristickým, byť opět nespecifickým nálezem bývá vysoká hladina sérového feritinu, která je indikátorem aktivace makrofágů. Z pohledu diferenciální diagnózy zvýšené hladiny feritinu se vyskytují také u syndromu aktivovaných makrofágů, katastrofického antifosfolipidového syndromu, septického šoku či závažných forem infekce SARS-CoV-2 (COVID-19).Ostatní dnes rutinně používané biomarkery nepředstavují pro diagnostiku AOSD výrazný přínos. Často výrazně zvýšené hladiny kalprotektinu či IL-6 postrádají specificitu, prokalcitonin může být u velmi aktivní formy AOSD zvýšený, což komplikuje spolehlivé vyloučení sepse.
Diferenciální diagnostika
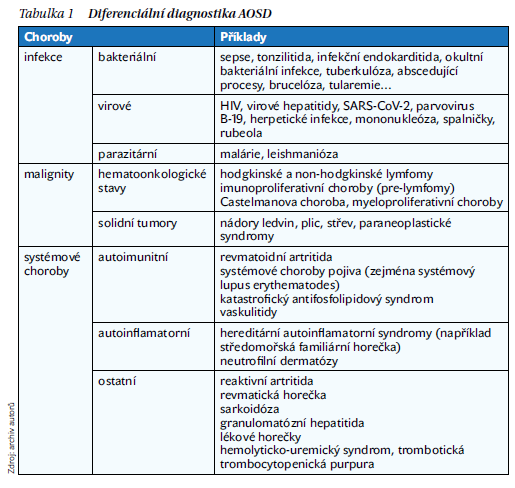
Diferenciální diagnostika AOSD je někdy složitá a zahrnuje řadu stavů (tabulka 1).
Klasifikační kritéria choroby a hodnocení léčebné odpovědi
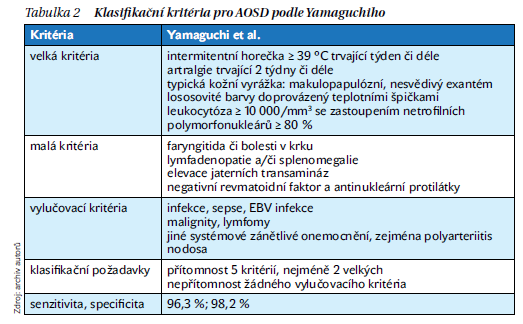
Existuje několik klasifikačních přístupů k AOSD, všechna kritéria jsou založena na určité kombinaci klinických a laboratorních nálezů. Je třeba si uvědomit, že jsou vyvinuta spíše pro výzkumné účely než pro diagnostiku. Do určité míry však mohou být užitečná i v klinické praxi. Nejčastěji jsou zmiňována a používána kritéria Yamaguchiho (tabulka 2).
Prognóza a komplikace
Choroba může probíhat monofázicky s nástupem remise po několika týdnech či měsících pod obrazem intermitentních vzplanutí choroby s remisemi mezi jednotlivými atakami či jako chronická či perzistentně aktivní choroba s rizikem destrukce postižených kloubů. Posledně jmenovaný průběh choroby je nejčastější.
Chronický průběh bude nyní méně častý díky dostupným cíleným léčivům navozujícím remisi choroby u většího procenta nemocných.
Choroba může probíhat velmi těžce. Relativně častou příčinou závažného orgánového postižení či úmrtí může být syndrom aktivovaných makrofágů (macrophage activation syndrom – MAS), zvaný také hemofagocytující lymfohistiocytóza či hemofagocytární syndrom, na který je třeba pomýšlet u pacientů s vysokou perzistující horečkou a rychle se snižujícími počty polymorfonukleárů a dalších krevních elementů vedoucích až k leukopenii, anemizaci a trombocytopenii.
Klinicky se stav manifestuje lymfadenopatií, hepatosplenomegalií, petechiemi, urtikou či purpurou a multiorgánovým postižením (plíce, CNS, GIT, ledviny). V laboratoři lze sledovat velmi rychlý pokles leukocytózy, snížení rychlosti sedimentace erytrocytů, vysoké hladiny LDH, transamináz a triglyceridů, hyperferitinemii, alteraci aPTT a známky hemofagocytózy v kostní dřeni.
Mezi další emergentní komplikace AOSD patří diseminovaná intravaskulární koagulace s kombinací krvácivých i trombotických manifestací a/nebo či trombotická mikroangiopatie s postižením CNS se zmateností, epizáchvaty či kómatem, gangrénami, mechanickou hemolytickou anémií s přítomností schistocytů a se selháním ledvin. Oba stavy rovněž vedou k multiorgánovému selhání.
Mezi vzácnější komplikace AOSD pak patří hepatální selhání, kardiopulmonální manifestace (perikarditida, myokarditida, pleuritida, intersticiální pneumonie, ARDS či difuzní alveolární hemoragie, plicní arteriální hypertenze) či amyloidóza.
Léčebné cíle
Cílem léčby je navodit remisi a ovlivnit příznivě klinické a laboratorní příznaky zánětu, minimalizovat riziko závažných manifestací a komplikací, zabránit progresi kloubního a orgánového postižení, zamezit podle možností nežádoucím efektům léčby. Přístup závisí na závažnosti choroby (lehká, středně závažná, život ohrožující forma) či převládající symptomatologii (systémový vs. artikulární typ). Optimální vedení léčby je v současnosti stále předmětem diskuze, ze které však vyplývá, že mnozí pacienti mohou mít prospěch z časně nasazené, a dokonce i glukokortikoidům předřazené biologické léčby.
Strategie léčby AOSD
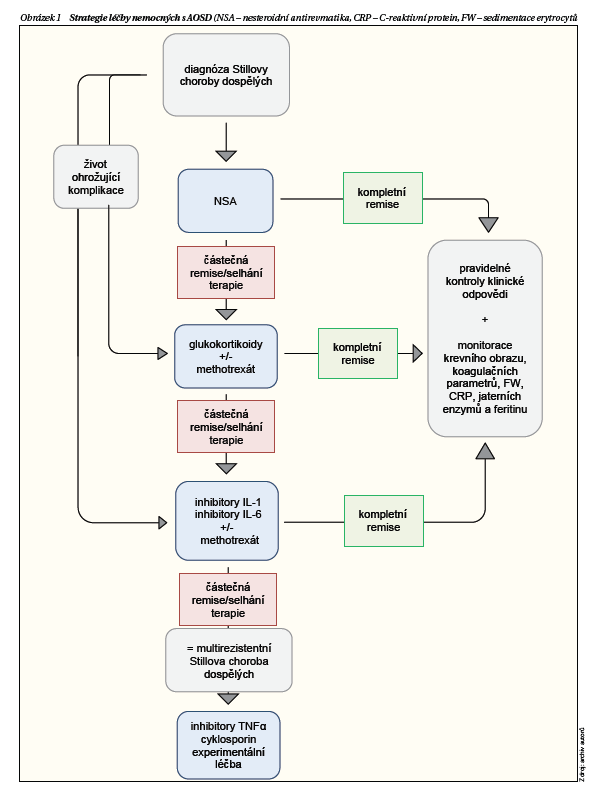
Léčba AOSD je v současnosti především empirická. Údaje z prospektivních, dvojitě slepých a randomizovaných studií jsou sporadické a v případě těžkého průběhu choroby jsou tyto studie z medicínského i etického hlediska těžko proveditelné. Takto koncipované prospektivní studie jsou schopny zahrnout jen malé počty nemocných, větší kohorty jsou zpravidla retrospektivními analýzami či případovými studiemi. Absence biomarkerů či klinických prediktorů odpovědi na jednotlivé typy léků neumožňuje výběr léčby na základě klinické či biologické charakteristiky choroby. V jednotlivých případech mohou artikulární projevy reagovat lépe na inhibici IL-6 (případně TNFα), systémové projevy pak na inhibitory IL-1. Neplatí to však všeobecně, řada případů AOSD s kloubními projevy je dobře kontrolovaná inhibitory IL-1, blokáda IL-6 častokrát velmi úspěšně ovlivní systémové manifestace. Nabízí se možnost extrapolace výsledků klinických hodnocení u SJIA, což se v současnosti často děje, zda je to však všeobecně akceptovatelný postup, není zcela jasné.
Jako racionální se v současnosti jeví užití NSA během diferenciální diagnostiky stavu následované podáním glukokortikoidů, které se mohou kombinovat s MTX. U velmi závažných forem choroby s hrozbou orgánového poškození a rozvoje komplikací je možné sáhnout po inhibici IL-1 ještě před podáním či současně s podáním glukokortikoidů (obrázek 1).
Nesteroidní antirevmatika (NSA)
Používají se zejména v počátku nemoci či při jejím relapsu, poskytnou prostor pro diagnostiku choroby. Lze použít například indometacin v dávce 100–150 mg denně.
Glukokortikoidy
Glukokortikoidy byly u AOSD dosud považovány za lék první volby. Jejich nasazení vede k dobré klinické odpovědi asi u 60 % nemocných během několika dní. Léčba se zahajuje odpovídajícím ekvivalentem prednisonu (0,5–1,0 mg/kg/den). U závažných forem AOSD (viscerální postižení, rozvíjející se MAS) se upřednostňuje jejich vysokodávkované intravenózní podání. U pacientů s monoartikulárním postižením může mít dobrý efekt intraartikulární aplikace. Ke snižování dávky glukokortikoidů se přistupuje po 4–6 týdnech, kdy jsou již normalizovány parametry systémového zánětu.
Methotrexát (MTX) a jiné chorobu modifikující léky (DMARDs)
MTX je nejčastěji podávaným chorobu modifikujícím lékem u AOSD, a to zejména pro svůj glukokortikoidy šetřící efekt. Dávkování MTX je stejné jako u pacientů s revmatoidní artritidou, dávka je nejčastěji 7,5–25 mg týdně v závislosti na aktivitě onemocnění, věku a komorbiditách. Přítomnost hepatopatie související se základní chorobou není kontraindikací jeho nasazení. Alternativu podání MTX při jeho kontraindikaci či neúčinnosti představují DMARDs, jako je cyklosporin A, hydroxychlorochin či intravenózní imunoglobuliny.
Inhibice IL-1
Koncept inhibice IL-1 je nyní v léčbě autoinflamatorních chorob často primární volbou. Tato léčba je účinná také v případě AOSD.
Anakinraje rekombinantní antagonista receptoru IL-1. Jeho použití u AOSD se opírá o přesvědčivé údaje, byť z převážné většiny pocházející z nekontrolovaných studií a observačních kohort. Aplikuje se denně v dávce 100 mg s. c. Je popisováno jasné a trvalé zlepšení systémových i kloubních projevů choroby, přičemž zejména systémové projevy reagují na léčbu velmi rychle. Metaanalýza 8 případových studií a 3 národních kohort ukazuje navození remise u cca 80 % a snížení dávky kortikoidů u 35 % léčených. Retrospektivní analýza 141 nemocných s AOSD z Itálie přinesla další důkazy o dobrém efektu na klinickou i laboratorní aktivitu choroby bez ohledu na věk, pohlaví, komedikaci či typ manifestace choroby. Skandinávská 24týdenní, otevřená, randomizovaná a multicentrická studie porovnávala efekt anakinry (n = 12) a syntetických DMARDs (n = 10). Primárního cíle, remise, dosáhlo numericky 6 z 12 nemocných léčených anakinrou a 2 z 10 léčených sDMARDs, což sice vzhledem k malým počtům zařazených nedosáhlo statistické významnosti, ale anakinra vedla k výraznějšímu zlepšení fyzického zdraví a měla lepší efekt na udržení remise v extenzi této studie. Jelikož AOSD je prakticky totožnou chorobou se SJIA, lze čerpat údaje o účinnosti léčby i u dětských forem. Bezpečnost a účinnost anakinry byla prokázána například v randomizované, kontrolované studii s 24 pacienty se SJIA léčenými po dobu až 1 roku. Další randomizovaná, dvojitě slepá, placebem kontrolovaná multicentrická studie hodnotící efekt dvou dávkovacích schémat anakinry (2 mg/kg a 4 mg/kg) proti placebu prokázala jednoznačnou superioritu léku proti placebu, ačkoliv byla předčasně ukončena pro pomalý nábor pacientů.
Kanakinumab je prvním biologikem registrovaným po použití u AOSD.Jedná se oplně humánní protilátku proti IL-1β. Jeho účinnost je extrapolovaná z randomizovaných a observačních studií u dětí se SJIA, v případě léčby AOSD jej lze použít v dávce 4 mg/kg 1× měsíčně. Kanakinumab je rovněž schválenou léčbou pro středomořskou familiární horečku, SJIA, refrakterní dnu a další autoinflamatorní choroby. Efektivitu kanakinumabu v léčbě AOSD prokázala také placebem kontrolovaná, multicentrická studie CONSIDER, která, byť rovněž ukončena předčasně pro nedosažení cílových počtů zařazených pacientů, vedla k evropské registraci léčiva.
Rilonacept, dimerní fúzní molekula obsahující receptor pro IL-1,je účinný u některých forem autoinflamatorních chorob, jeho efekt u AOSD je dokumentován sporadickými kazuistikami.
Bezpečnost inhibitorů IL-1 je velmi dobrá, nežádoucí efekty zahrnují především zvýšené riziko infekcí. Otazníky panují ohledně charakteristické systémové manifestace AOSD, syndromu aktivovaných makrofágů. Inhibitory IL-1 vykazují efektivitu v jeho léčbě, ale zvažuje se i možný paradoxní efekt inhibice IL-1 v jeho vyvolání. Z těchto důvodů se doporučuje zahájení podávání inhibitorů IL-1 v léčbě MAS až po dosažení určitého stupně kontroly stavu glukokortikoidy.
Blokátory IL-6
Inhibice signalizace IL-6 je možná dvojím mechanizmem: blokádou jeho receptoru (tocilizumab, sarilumab) či přímou neutralizací cytokinu (siltuximab). Zatím komerčně dostupné léky používané v léčbě revmatických chorob využívají první mechanizmus. Tocilizumab a sarilumab postrádají pro léčbu AOSD vlastní prospektivní kontrolované studie, použití se opírá o retrospektivní analýzy a série kazuistik a jejich efekt může být extrapolován z dostupných klinických údajů u SJIA.
Tocilizumab je humanizovaná monoklonální protilátka proti receptoru IL-6 a byla použita v léčbě refrakterních nemocných s AOSD v dávce 5–8 mg/kg i. v. 1× za 4 týdny nebo v dávce 162 mg týdně s. c. Pacienti na léčbu reagují velmi dobře. Lze jej považovat za alternativu inhibitorů IL-1 u nemocných s kloubními i systémovými projevy AOSD. Lék je registrován pro léčbu SJIA.
Efektní použití sarilumabu u AOSD je dokumentováno rovněž kazuisticky, lék zatím oficiální registraci pro AOSD ani pro SJIA nemá.
TNFα inhibitory
Infliximab, etanercept, adalimumab, později pak golimumab a certolizumab pegol, byly sice první biologické léky zkoušené a používané u AOSD, výsledky malých nekontrolovaných studií však nebyly konzistentní. Pozitivní efekt je popisován pouze u části nemocných, systémové projevy nejsou často kontrolovány dostatečně. V současnosti jsou považovány za lék třetí volby především u nemocných s chronickou polyartritidou.
Inhibice IL-18
Inhibice IL-18 má potenciál pro léčbu AOSD jako slibný směr dalšího výzkumu. Rekombinantní protein vážící IL-18 tadekinig α prokázal v otevřené studii schopnost výrazně snížit sérové hladiny IL-18 a současně kontrolovat aktivitu AOSD.
Závěr
V posledních letech dochází k výraznému pokroku v chápání AOSD a zvyšuje se i povědomí o ní. Mezi zásadní poznatky patří odhalení její autoinflamatorní povahy a role poruchy vrozené imunity v patogenezi. V návaznosti na to dochází k úspěšnému použití biologických léků ovlivňujících signalizaci IL-1 a IL-6 ke kontrole systémových i kloubních projevů choroby ve výzkumu role dalších cílených léků blokujících progresi AOSD.
Podpořeno MZ ČR RVO FNOL-0098892 a grantem IGA_LF_2022_03.
prof. MUDr. Pavel Horák, CSc.
MUDr. Martina Skácelová, Ph.D.
MUDr. Jakub Videman
III. interní klinika – nefrologická, revmatologická, endokrinologická, LF UP a FN Olomouc
