Stillova choroba se začátkem v dospělosti patří mezi polygenně podmíněná autoinflamatorní onemocnění charakterizovaná recidivujícími horečkami, typickými kožními projevy, bolestmi svalů a kloubů, lymfadenopatií a hepatosplenomegalií. Možným rizikem je rozvoj život ohrožujících komplikací, jako je syndrom aktivovaných makrofágů nebo sekundární amyloidóza orgánu. V následujícím textu jsou popsány informace týkající se současné farmakoterapie a novinek v léčbě tohoto onemocnění.
Stillova nemoc se začátkem v dospělosti (AOSD) je klinicky charakterizována recidivujícími febrilními stavy, typickými kožními projevy, nejčastěji charakteru lososovité vyrážky (salmon rash), muskuloskeletálními projevy (myalgie, artralgie až artritidy), hepatosplenomegalií a serozitidami. V začátku nemoci udávají někteří pacienti bolest hrdla. Diagnostický test chybí, laboratorními metodami lze prokázat nespecifické zvýšení reaktantů akutní fáze (CRP, FW, sérového feritinu), leukocytózu a elevaci hladin jaterních testů. Autoprotilátkový profil bývá negativní. V diferenciální diagnostice febrilních stavů je důležité vyloučit infekční etiologii, neoplastický proces či zánětlivá systémová onemocnění.
Patofyziologie onemocnění
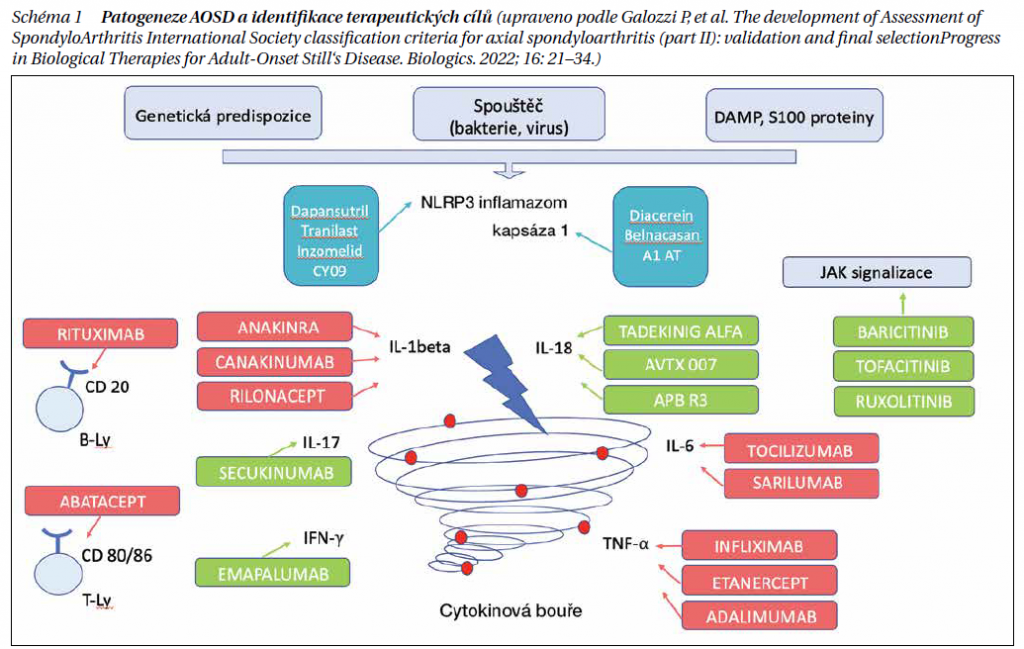
Patofyziologie AOSD zůstává nejasná. Předpokládá se však, že podstatou je dysregulace vrozené imunitní odpovědi s nadměrnou aktivací inflamazomu a nadprodukcí zánětlivých cytokinů. Základní charakteristikou patogeneze AOSD je aktivace neutrofilů odpovědná za indukci a regulaci zánětu, intenzivní aktivaci makrofágů a stimulaci nadměrné produkce některých prozánětlivých cytokinů. Zánětlivá odpověď je udržována prostřednictvím aktivace zánětlivých buněk inflamazomu NLRP3, což vede k aktivaci kaspázy a nadprodukci IL-1β a IL-18. Tyto prozánětlivé cytokiny pak vedou k amplifikaci zánětlivé kaskády prostřednictvím produkce zánětlivých mediátorů, jako je např. IL-6, IL-8, IL-17, TNFα a interferon γ (IFNγ). Nekontrolovatelné uvolňování cytokinů do systémové cirkulace může vést ke vzniku a udržování tzv. cytokinové bouře s hrozbou orgánového selhání až smrti (schéma 1).
Konvenční léčba
Léčba AOSD je zaměřena na potlačení klinických a laboratorních projevů zánětu, minimalizaci rozvoje závažných manifestací, prevenci vzniku syndromu aktivovaných makrofágů (MAS), zabránění progrese kloubního postižení a podle možností zamezení nežádoucím účinkům léčby. Terapeutický přístup závisí na závažnosti choroby (lehká, středně závažná, život ohrožující forma) a převládající symptomatologii (systémový vs. artikulární typ).
Nesteroidní protizánětlivé léky (NSA), systémová kortikoterapie (SKS) a konvenční syntetické chorobu modifikující léky (csDMARDs)
Lékem první volby jsou nesteroidní antirevmatika, hlavně v případě mírných projevů. NSA se dále používají jako podpůrná léčba během diagnostického procesu, zejména do doby definitivního vyloučení infekční a neoplastické etiologie horečnatých stavů, pokud to stav pacienta dovoluje. Nutné je myslet na možné vedlejší účinky související s dlouhodobým užíváním NSA, jako je gastrointestinální krvácení a u starších pacientů riziko renální nebo jaterní insuficience. Pokud teploty trvají déle než dva týdny bez jasné odpovědi na podávaná NSA, zpravidla se doporučuje přistoupit k léčbě systémovými kortikosteroidy.
Kortikoidy představují účinnou volbu u přibližně 80 % pacientů. U většiny pacientů zahajujeme systémovou kortikoterapii v úvodní dávce 0,5–1 mg/kg/den methylprednisolonu, u pacientů se závažnějšími projevy se podávají intravenózní pulzy. Dosažení odpovědi je obvykle rychlé jak u kloubních, tak u systémových projevů. Je však třeba se vyhnout dlouhodobé léčbě steroidy kvůli riziku vedlejších účinků a nežádoucích reakcí včetně hypertenze, diabetu, tachykardie, možnosti časného nástupu osteoporózy či přírůstku hmotnosti a vzniku katarakty. Během léčby SKS se doporučuje profylaktické podávání vápníku a vitaminu D, inhibitoru protonové pumpy, monitorace krevního tlaku a glykemie.
Pokud pacient neodpovídá dostatečným zlepšením na léčbu NSA a SKS, je běžnou praxí přidat ke stávající terapii csDMARDs jako kortikoidy šetřící léky. V klinické praxi volíme methotrexát (MTX) v dávce 7,5–25 mg/týden. MTX umožňuje snížení dávek až vysazení systémových kortikosteroidů, a redukuje tak riziko rozvoje závažných komplikací spojených s jejich užíváním.
Současně používané biologické léky v léčbě AOSD
Při nedostatečném efektu MTX je vhodné zahájit biologickou léčbu, uplatňují se především inhibitory IL-1 a IL-6. V praxi volíme mechanizmus účinku zahajované biologické léčby podle toho, zda u pacientů s AOSD převažují kloubní nebo systémové projevy.
U pacientů s převažujícími systémovými rysy se zdá být vhodnější léčbou podávání inhibitorů IL-1 anakinry, případně kanakinumabu. Pokud u pacienta dominují projevy kloubní, pak volíme podávání inhibitoru IL-6 – tocilizumabu, který má vliv na kloubní i systémové manifestace.
Inhibice IL-1
Anakinra je rekombinantní antagonista lidského receptoru pro IL-1, jeho účinnost je vyšší na systémové projevy AOSD než na artritidu. Anakinra se podává jednou denně v dávce 100 mg/kg v podkožní injekci. Vzhledem ke krátkému poločasu eliminace a rychlému nástupu terapeutického účinku jsou rizika, zejména s ohledem na případnou diagnostickou nejistotu v začátku onemocnění (infekce, malignity), považována za minimální. U velmi závažných forem choroby, s rizikem orgánového poškození a rozvoje MAS, je možné sáhnout po léčbě anakinrou před podáním či současně s podáním kortikosteroidů.
Kanakinumab je humanizovaná monoklonální protilátka, která se specificky váže na IL-1β, blokuje jeho interakci s receptorem IL-α a brání následné zánětlivé odpovědi. Jde o dlouhodobě působící přípravek, podává se v dávce 4 mg/kg (až do maximální dávky 300 mg) jednou za 4 týdny jako podkožní injekce. Kanakinumab může být podáván v monoterapii nebo v kombinaci s methotrexátem. V této indikaci byl kanakinumab schválen agenturou EMA (European Medicines Agency) a FDA (Food and Drug Administration) v roce 2016 (registrační studie CONSIDER). Kanakinumab má v ČR schválenu indikaci, nicméně dosud nebyla stanovena úhrada, proto je léčba podmíněná souhlasem revizního lékaře (žádost na paragraf 16). Výhodou kanakinumabu ve srovnání s anakinrou je zejména prodloužený biologický poločas eliminace a prolongované aplikace léčiva. Nevýhodou je vysoká cena tohoto přípravku ve srovnání s jinými biologiky. Bezpečnostní profil přípravků blokujících IL-1 je všeobecně příznivý. Z pozorovaných nežádoucích účinků byly zaznamenány převážně infekční komplikace.
Inhibice IL-6
Tocilizumab
Tocilizumab je humanizovaná monoklonální protilátka proti receptoru IL-6. Může být podáván jako monoterapie, nebo v kombinaci s MTX, používá se formou infuzí v dávce 5–8 mg/kg i. v. 1× za 4 týdny, nebo v subkutánních injekcích v dávce 162 mg týdně s. c. Obvykle již po prvním podání dochází k ústupu horečky a k rychlé normalizaci laboratorních zánětlivých parametrů. Obvykle je velmi dobře tolerován a má přijatelný bezpečnostní profil. Jeho relativním rizikem je maskování laboratorních projevů případných infekčních komplikací. U pacienta léčeného tocilizumabem není možné závažnost infekce posuzovat na základě míry vzestupu nespecifických laboratorních parametrů, jako je C-reaktivní protein (CRP) nebo sedimentace erytrocytů. Antibiotická léčba by měla být zahájena vždy na základě pečlivého klinického a mikrobiologického zhodnocení. Z vážnějších nežádoucích účinků byly zaznamenány případy elevací transamináz, neutropenie a urtiky. V případě léčby inhibitory IL-6 se jedná o „off-label“ podávání a je nutné schválení revizním lékařem zdravotní pojišťovny (žádost na paragraf 16).
Další léky v léčbě AOSD
Inhibice IL-1
Rilonacept
Rilonacept je nejnovějším dostupným blokátorem IL-1. Jedná se o solubilní receptor, který neutralizuje především IL-1β, v menší míře také IL-1α a podává se subkutánně 1× týdně. Jeho účinnost byla zkoušena zejména u pacientů s nedostatečnou odpovědí na anakinru. Bezpečnostní profil se podobně jako u anakinry jeví jako velmi příznivý. V současné době je rilonacept schválen FDA pro léčbu rekurentních perikarditid.
Gevokizumab
Stejně jako kanakinumab je gevokizumab monoklonální protilátka (blokující IL-1β). Mechanizmus účinku se liší, gevokizumab snižuje afinitu IL-1β k jeho signalizačnímu komplexu IL-1RI (IL-1R typu 1): IL-1RAcP (IL-1 receptor accessory protein).
Inhibice IL-6
Sarilumab
Sarilumab (anti IL-6Rα) je plně humánní monoklonální protilátka proti receptoru pro IL-6 (IL-6Rα), která váže membránově vázaný a rozpustný lidský IL-6Rα s vysokou afinitou. Účinnost sarilumabu u AOSD byla dosud publikována pouze u jednoho pacienta v rámci kazuistického sdělení, který byl sarilumabem úspěšně léčen po selhání léčby tocilizumabem. Hypotéza použití sarilumabu u refrakterních případů se opírá o skutečnost, že u systémové AOSD mohou vysoké hladiny IL-6 převýšit neutralizační schopnost tocilizumabu, a proto přímá inhibice receptoru IL-6 může pomoci lépe snížit prozánětlivou aktivitu IL-6.
Ve světle nových poznatků o patogenezi AOSD došlo k intenzivnímu výzkumu nových léčebných modalit v terapii AOSD. Slibnými se jeví inhibice IL-18, IFNγ, inflamazomu NLRP3 a inhibice JAK signalizace.
Inhibice IL-18
Blokáda prozánětlivého cytokinu IL-18, člena rodiny IL-1, představuje další slibný terapeutický přístup v léčbě pacientů s AOSD. V současné době jsou testovány tři inhibitory IL-18: tadekinig α, AVTX 007 a molekula APB R3.
Tadekinig α
Tadekinig α je rekombinantní lidský protein vázající IL-18. Data ohledně účinnosti a bezpečnosti přineslo klinické hodnocení fáze II, ve kterém bylo 23 pacientů s refrakterní AOSD (u více než 50 % pacientů došlo k selhání csDMARDs a více než třetina byla dříve léčena biologickými agens bez dostatečného efektu) léčených dávkou 80 mg nebo 160 mg 3× týdně po dobu 12 týdnů. V klinickém hodnocení se sledovalo ovlivnění počtu oteklých a citlivých kloubů a poklesu zánětlivých parametrů, včetně CRP a feritinu. Terapeutické odpovědi (snížení počtu citlivých a oteklých kloubů minimálně o 20 %, redukce CRP o 70 % nebo normalizace hladin feritinu) bylo dosaženo u přibližně 50 % pacientů ve 3. a 12. týdnu, při všeobecně příznivém bezpečnostním profilu. Nejčastěji hlášenými nežádoucími účinky byly lokální reakce v místě vpichu, mírné respirační infekce a artralgie. Udržení klinické remise a poklesu sérového IL-18, při prolongované léčbě tadekinigem α (v řadě několika měsíců), bylo následně reportováno stejnou skupinou autorů u dvou léčených pacientů.
AVTX 007
AVTX 007 je plně humánní monoklonální protilátka proti IL-18 s potenciálním využitím v léčbě autoinflamatorních chorob včetně AOSD. Fáze I klinického hodnocení probíhajícího v USA si dává za cíl prozkoumat bezpečnost a efektivitu AVTX 007 na vzorku 12 pacientů. V plánu je podat prvním šesti pacientům AVTX 007 v dávce 7 mg/kg ve formě intravenózní infuze. Na základě bezpečnostních dat bude dalším 6 účastníkům podána navýšená nebo redukovaná dávka léčiva.
APB R3
APB R3 je dlouhodobě působící rekombinantní fúzní protein složený z IL-18BP fúzovaného přes peptidový můstek k Fab fragmentu proti lidskému sérovému albuminu (SAFA). SAFA je platformová technologie určená pro výrobu dlouhodobě působících terapeutik modifikací antisérového albuminu Fab, čímž se zabrání lysozomální degradaci a prodlouží se poločas eliminace molekuly. V současnosti probíhá teprve velmi časné stadium výzkumu s APB R3 v léčbě Stillovy nemoci.
Inhibice IFNγ
IL-18 je významným induktorem produkce IFNγ, jehož zvýšené sérové hladiny byly pozorovány u dětských pacientů se syndromem aktivovaných makrofágů jako komplikací systémové formy juvenilní idiopatické formy – sJIA (Stillova nemoc se začátkem v dospělosti je dnes považována za kontinuum sJIA – poznámka autorky). Recentní práce hodnotící efektivitu emapalumabu (protilátka proti IFNγ) u pacientů s MAS syndromem vzbudila velká očekávání ohledně potenciální účinnosti tohoto terapeutického agens.
Emapalumab
Emapalumab je plně humánní monoklonální protilátka neutralizující solubilní a na receptor vázaný IFNγ. K dispozici máme limitovaná data ohledně účinnosti emapalumabu u pacientů s AOSD, omezená konkrétně na jedno kazuistické sdělení, ve kterém došlo k promptnímu zlepšení stavu mladé pacientky s AOSD, komplikované rozvinutým MAS syndromem.
Inhibice JAK signalizace
JAK inhibitory
Na rozdíl od selektivní inhibice jednotlivých cytokinů pomocí výše prezentovaných cíleně působících agens, blokují inhibitory Janusovy kinázy (JAK) větší množství prozánětlivých molekul, a to prostřednictvím kompetitivní interakce s oblastí JAK, která je nezbytná pro signalizaci dráhy JAK/STAT. JAK inhibitory zabraňují působení IL-6, IL-10, IFNγ, IFNα a faktoru stimulujícího kolonie granulocytů a makrofágů (GM-CSF), které se podílejí na patogenezi AOSD. Baricitinib a ruxolitinib jsou selektivnější vůči JAK1/2, zatímco tofacitinib působí vůči JAK1/JAK3. V současné době probíhá intenzivní výzkum na poli JAK inhibitorů v různých indikacích, včetně heterogenních poruch, jako je AOSD. Údaje týkající se účinnosti a bezpečnosti inhibitorů JAK při léčbě AOSD zatím zůstávají omezeny na sporadická kazuistická sdělení.
Baricitinib
Baricitinib, inhibitor JAK1/2, byl účinný v léčbě 2 pacientů s AOSD refrakterních na csDMARD a předchozí léčbu biologickými agens. Velmi recentní publikace potvrdila účinnost baricitinibu (denní užívání 4 mg tbl p. o.) u 7 pacientů s refrakterní AOSD sledovaných během 6 měsíců. Jako nežádoucí účinky byly reportovány mírné abnormality v lipidovém profilu.
Tofacitinib
Tofacitinib, inhibitor JAK1/3, byl nedávno schválen FDA pro polyartikulární JIA a v současné době je hodnocen (5 mg 2× denně) ve dvojitě zaslepené studii pro sJIA. Použití tofacitinibu u Stillovy choroby komplikované MAS syndromem podporují zatím pouze kazuistická sdělení, stejně jako studie na zvířecích modelech HLH. Kromě toho novější práce rovněž potvrdila úspěšné použití tofacitinibu u 14 pacientů s AOSD.
Ruxolitinib
Je známo, že inhibitor JAK1/2 ruxolitinib významně snižuje proliferaci a aktivaci IFNγ a dalších cytokinů na experimentálních myších modelech HLH. Proto lze ruxolitinib zvážit u pacientů se sekundární hemofagocytující lymfohistiocytózou (HLH). Pilotní studie u 12 dětí se sekundární HLH prokázala dobrou klinickou odpověď po 28 dnech perorální léčby. Částečná odpověď byla také dokumentována u dvou pacientů s AOSD léčených současně kortikosteroidy.
Inhibitory zánětu NLRP3
Velká pozornost byla nedávno věnována blokádě zánětlivého NLRP3 a jeho složek, o kterých je dobře známo, že se podílejí na autoinflamatorních procesech. Dosud byly zkoumány různé sloučeniny schopné vázat NLRP3 a následně uvolňovat IL-1.
Dapansutril
Dapansutril je perorální přímý inhibitor NLRP3 a v současné době je testován u dny. Zaznamenáno bylo významné snížení citlivosti a otoku kloubů a navíc také redukce tvorby prozánětlivých cytokinů, zejména IL-6. Kombinace jeho účinnosti, dobrého bezpečnostního profilu a perorálního podávání činí z dapansutrilu slibnou terapeutickou možnost, nejen pro pacienty s dnou, ale také u pacientů s AOSD, zejména těch s převažujícím kloubním postižením.
Jiné inhibitory inflamazomového komplexu NLRP3
V současné době jsou zkoumány i další blokátory NLRP3 nebo jeho složek. Ve zkratce lze zmínit MCC950 (snižuje produkci IL-1β), dále CY09 (ovlivňuje aktivitu NLRP3 ATPázy bránící sestavení samotné NLRP3), studuje se role inzomelidu a diacereinu. Uvádí se, že sloučenina antrachinonu může snížit regulaci jak NLRP3/kaspázy-1/IL-1β, tak osu IL-6/pSTAT3, zatímco belnacasan a A1-AT cílí přímo na složku kaspázy i blokující uvolňování IL-1β.
TNFα inhibitory
Pro komplexnost problematiky je vhodné zmínit, žeblokátory TNFα – infliximab, etanercept, adalimumab, golimumab a certolizumab pegol – jako vůbec první biologické léky zkoušené v léčbě AOSD nemají na systémové projevy dostatečný účinek a jsou považovány za lék třetí volby především u nemocných s chronickou polyartritidou.
Závěr
V posledních letech došlo k lepšímu pochopení patogeneze AOSD a vývoji nových biologických léků. Kromě specifické inhibice IL-1 a IL-6, která se osvědčila jako bezpečná a účinná, jsou v terapii AOSD zkoušeny zejména inhibitory IL-18, IFNγ, inflamazomu NLRP3 a blokátory JAK signalizace. Strategie léčby, včetně použití biologické léčby, ještě před nasazením kortikoterapie u pacientů se závažným orgánovým postižením a také otázka detrakce či vysazení léků u pacientů v remisi, nadále zůstává předmětem diskuze.
Podpořeno projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 00064203 FN Motol.
MUDr. Jana Hurňáková, Ph.D.
doc. MUDr. Rudolf Horváth, Ph.D.
Oddělení revmatologie dětí a dospělých, 2. LF UK a FN Motol v Praze
