Předmětem článku je zhodnocení účinnosti a bezpečnosti IL-17A inhibitoru sekukinumabu ve skupině spondyloartritid, konkrétně u ankylozující spondylitidy (AS), non radiografické axiální spondyloartritidy (axSpA) a psoriatické artritidy (PsA). U každé klinické jednotky je stručně podán popis konvenční i biologické léčby, jak je rozebírána evidence o účinnosti sekukinumabu u jednotlivých diagnóz, a to v randomizovaných, kontrolovaných studiích a jejich otevřených extenzích. Dále pak jsou prezentovány výsledky kohortových studií a registrů včetně českého národního registru ATTRA.
Sekukinumab se jeví stejně účinným jako anti TNF na skeletální projevy, ale je výrazně účinnější na kožní syndrom. Naopak nebyla prokázána jeho účinnost u pacientů se současným idiopatickým střevním zánětem. Tolerance sekukinumabu je přijatelná a podobná jako u jiných biologických chorobu modifikujících léků (bDMARDS) s mírně zvýšeným rizikem nezávažných kandidových infekcí.
Spondyloartritidy
Spondyloartritidy (SpA) představují heterogenní skupinu zánětlivých revmatických onemocnění, která ale mají některé společné rysy. Patří mezi ně zánětlivá onemocnění páteře (sakroiliitida a spondylitida), která se manifestují bolestmi v zádech, dále periferní artritidou, entezitidou a daktylitidou. Mezi extraskeletální projevy pak patří častý výskyt uveitidy, psoriázy či dalších kožních a slizničních lézí, idiopatických střevních zánětů a tzv. komorbidit.
Společným znakem SpA je také nepřítomnost revmatoidních faktorů, různě silně vyjádřená přítomnost antigenu HLA B 27, familiární výskyt a vztah k infekci, který je jasný u reaktivních artritid a spíše předpokládaný u AS. Do skupiny SpA patří axSpA – radiologická forma a tzv. non radiografická axSpA, dále PsA, jedna z forem juvenilní idiopatické artritidy, reaktivní artritida a artritida při idiopatických střevních zánětech. Podle novějších členění je vhodnější SpA dělit podle převažující lokalizace na axiální (AS a nr ax SpA) a periferní (např. PsA).
Sekukinumab v léčbě ankylozující spondylitidy
Ankylozující spondylitida (AS) je chronické, zánětlivé onemocnění, které je typické postižením axiálního skeletu a sakroiliakálních kloubů. Je asociována se zánětlivými bolestmi v zádech, ztuhlostí a někdy i periferní artritidou. AS může vést ke zhoršení funkce a invaliditě. AS postihuje 1,4 % populace celosvětově a je významnou příčinou nejen disability a morbidity, ale i zvýšené mortality (obrázek 1).
Pro léčbu AS byla publikována četná doporučení, z nichž nejdůležitější jsou Doporučení amerického kolegia revmatologů (ACR), evropské ligy proti revmatizmu (EULA), akademické nezávislé skupiny ASAS a také České revmatologické společnosti, jejichž nová verze byla publikována v roce 2021. Všechna tato doporučení navrhují v první linii léčby AS kombinaci nefarmakologické léčby (cvičení, edukace, fyzikální a lázeňská léčby) a nesteroidních antirevmatik (NSA), přičemž toto platí především u převážně axiálních forem AS. U periferních forem má určitá data o účinnosti sulfasalazin. Žádné z konvenčních, syntetických forem DMARD včetně sulfasalazinu a methotrexátu však není účinné na axiální příznaky. Slabé je také ovlivnění entezitidy a nejsou data o zpomalení rentgenové progrese.
Revoluci do léčby AS přinesly až biologické léky, konkrétně anti TNF blokátory před 20 lety. Mají výrazný protizánětlivý a imunosupresivní účinek, působí rychle a robustně a ovlivňují všechny domény AS, včetně extraskeletálních manifestací. Limitací anti TNF léčby je fakt, že selhává až u 30–40 % pacientů, a to buď primárně, nebo sekundárně. Příčinou může být jak primární neúčinnost, tak i ztráta účinku následkem vzniku protilátek proti léku nebo nežádoucích účinků. Bylo tedy logické hledat nové biologické léky pro léčbu AS s jiným mechanizmem účinku než blokádou anti TNF.
Prvním bDMARD, který byl úspěšně zkoušen a uveden do klinické praxe, byl sekukinumab. Cíleně byl připraven na základě teoretických poznatků o důležitosti osy IL-23/IL-17 v patogenetickém mechanizmu AS. Sekukinumab je plně humánní monoklonální protilátka anti IL-17A, která prokázala účinnost v léčbě AS, PsA a psoriázy.
Výsledky studií MEASURE 1–4
Sekukinumab (SEC) byl po úspěšné fázi II. klinického zkoušení u AS dále testován v rozsáhlém programu fáze III, a to konkrétně ve studiích MEASURE 1–4, dále v jejich otevřených extenzích. Data z běžné klinické praxe přinesly registry biologické léčby.
Ve studii MEASURE 2 byli pacienti randomizováni do skupiny SEC 150 mg nebo 75 mg týdně s. c. v tzv. nasycovací fázi v týdnech 0, 1, 2, 3, 4 a dále v udržovací fázi 75 mg nebo 150 mg s. c. po 4 týdnech (schéma 1). Ve studii MEASURE 3 byl v nasycovací fázi aplikován SEC formou intravenózní, a to v dávce 10 mg/kg v týdnu 0 a 2 a následovalo subkutánní podání. Zde byly použity dávky 150 mg a 300 mg s. c. po 4 týdnech. Ve studii MEASURE 4 pak nasycovací fáze nebyla vůbec použita. Protože nebyl zjištěn rozdíl v účinnosti mezi nasycovacím režimem intravenózním a subkutánním, byl do běžné praxe doporučen nasycovací režim subkutánní 150 mg s. c. v týdnu 0, 1, 2, 3 a dále po 4 týdnech.
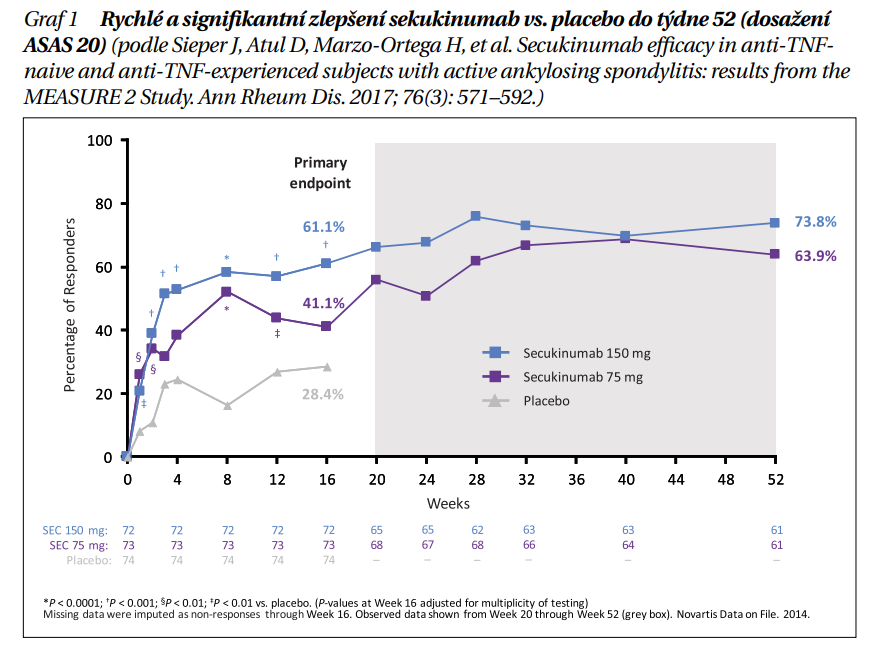
Primárním cílem studie MEASURE 2 byla odpověď ASAS 20 v týdnu 16, které bylo dosaženo (SEC 61,1 % vs. placebo 28,4 % < 0,01) (graf 1). Signifikantního zlepšení bylo docíleno i u všech sekundárních ukazatelů (ASAS 40, hs CRP, BASDAI, SF 36, ASQol, ASAS parciální remise). Aplikace SEC 150 mg s. c. tedy potlačovala ukazatele zánětu (CRP, MRI SI kloubů), zmírňovala bolest, zlepšovala funkci a kvalitu života. Klinický benefit byl prokazatelný již po 2. týdnu a přetrvával do týdne 52, v otevřených extenzích až do 5 let. SEC byl účinný jak u TNF naivních pacientů s AS, tak u pacientů s již selhavším anti TNF. Zde byla účinnost mírně nižší, ale stále signifikantně vyšší než po placebu.
Výsledky studie MEASURE 1 v podstatě potvrzovaly výsledky studie MEASURE 2. Studie MEASURE 3 se zásadně odlišovala od MEASURE 1, 2 dávkováním. V nasycovací fázi byl použit intravenózní režim (10 mg/kg v týdnu 0 a 2) a v udržovací fázi pak dávky 150 mg s. c. à 4 týdny a 300 mg à 4 týdny. Primárním cílem bylo ASAS 20 v týdnu 16, kterého bylo dosaženo u obou dávek SEC oproti placebu (60,5 % vs. 58,1 % vs. 36,8 %; p < 0,01). Splněna byla i řada sekundárních cílů (ASAS 40, hs CRP, BASDAI, ASAS 5/6, ASAS parciální remise). Výsledky byly obdobné pro anti TNF naivní i anti TNF selhávající. Výsledky dosažené v týdnu 16 přetrvávaly do týdne 52. Studie v zásadě neprokázala vyšší účinnost dávky 300 mg s. c. oproti 150 mg s. c. à 4 týdny u AS, což může být určitý rozdíl proti psoriáze, kde je efekt vyšší dávky jasný.
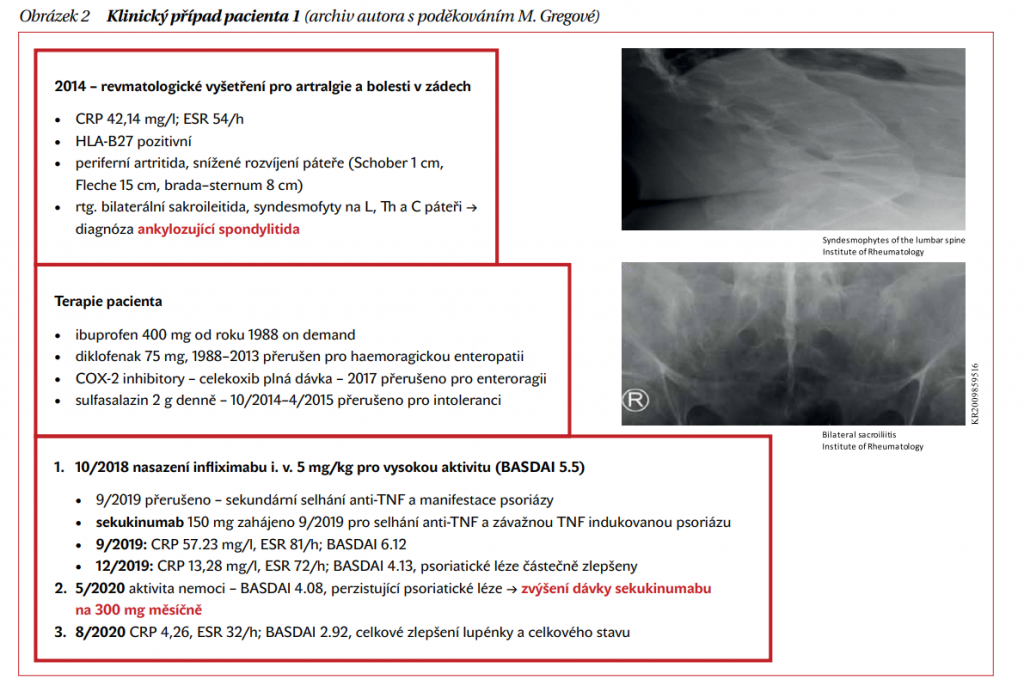
Nicméně i ve studii MEASURE 3 se ukázalo, že v některých přísnějších ukazatelích (ASAS 40, ASAS 5/6) může být dávka 300 mg s. c. i u AS účinnější. Rozdíl byl také patrný ve skupině pacientů s již TNF selháním. Proto je u těchto pacientů možné eskalaci dávky doporučit a úspěch této eskalace je možné demonstrovat na kazuistice našeho pacienta (obrázek 2).
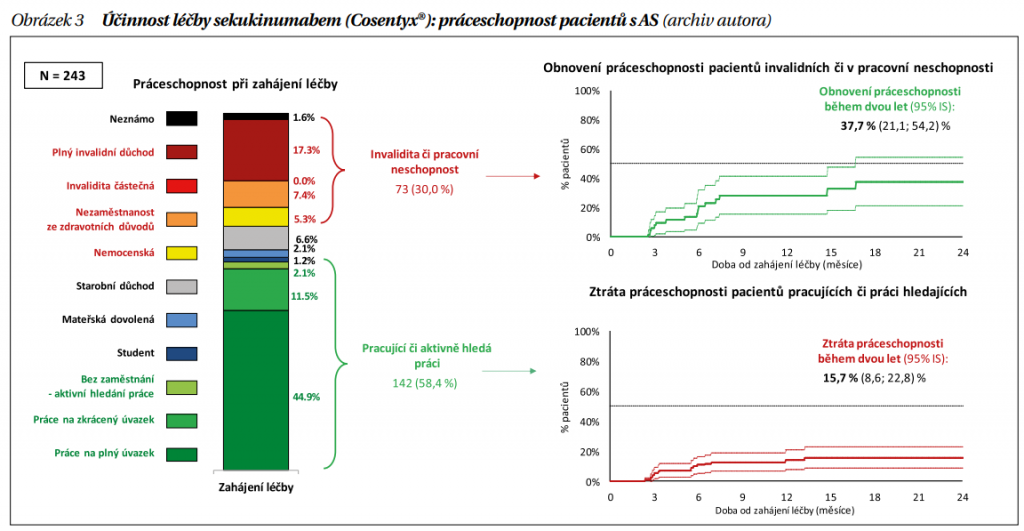
Nejdůležitější údaje o účinnosti a bezpečnosti léků přinášejí randomizované, placebem kontrolované studie, ale cenná jsou také data z registrů biologické léčby, která reflektují běžnou klinickou praxi neselektovaných pacientů. V Česku jsou pacienti s AS léčeni v centrech biologické léčby a jsou zařazováni do národního registru biologické léčby ATTRA. Zjistili jsme na vzorku 243 pacientů, že po 2 letech léčby nastal stav nízké aktivity, BASDAI < 4/ u 77,1 % pacientů, průměrné ASDAS pokleslo z 3,8 + 1,0 na 2,3 + 0,9, klinicky významné zlepšení ASDAS bylo docíleno o 71,12 %, HAQ pokleslo z 1,3 + 6 na konečných 0,8 + 0,6. Zlepšily se i všechny aspekty kvality života hodnocené pomocí SF 36. Přežívání na léčbě bylo po 2 letech 63,5 % pacientů. Za nesmírně důležité považujeme fakt, že se zlepšila práceschopnost, když znovu začalo pracovat 37,7 % pacientů a práci ztratilo 15,7 % pacientů (obrázek 3). Zlepšily se i všechny komponenty práceschopnosti hodnocené pomocí skoré WPAI.
Účinnost sekukinumabu u nr-axSpA
Podle klasifikačních kritérií ASAS je možné určit diagnózu tzv. nr-axSpA. Jde o pacienty, kteří nemají nález sakroilietidy na plochém rtg. snímku, ale sakroilietida je průkazná na MRI SI kloubů. Klinické studie prokázaly na jedné straně určité rozdíly v kohortách radiografických a non radiografických forem, nicméně ze strany aktivity a vlivu na kvalitu života pacienta jsou obě formy stejně závažné. Z těchto důvodů vyplývá také pozdější schválení biologické léčby pro nr-axSpA formy až na základě provedených studií.
SEC byl zkoušen v indikaci nr-axSpA ve dvojitě zaslepené, randomizované, placebem kontrolované studii PREVENT. Primárním kritériem bylo dosažení ASAS 40 v týdnu 16. Cíle bylo dosaženo ve 40 % u SEC 150 mg oproti 28 % v placebové skupině, nebyl rozdíl mezi skupinou na SEC, která měla nebo neměla nasycovací fázi léčby. Signifikantní rozdíl mezi SEC a placebem byl i ve všech sekundárních klinických ukazatelích, ale také bylo průkazné výraznější snížení intenzity zánětu na SI kloubech při použití tzv. Berlínského skóre hodnocení aktivity. Příznivé výsledky při léčbě SEC nr-axSpA byly získány i v registru ATTRA, kde ke klinicky významnému zlepšení ASDAS (> 1,1 ) došlo u 72,2 % pacientů.
Sekukinab v léčbě extraskeletálních projevů AS
Účinnost na prevenci uveitid u pacientů léčených SEC nebyla ve studii Shield prokázána. Sekukinumab také neprokázal účinnost na Crohnovu nemoc nebo ulcerózní kolitidu. Naopak byly zaznamenány ojedinělé případy exacerbace nebo vznik nového onemocnění IBD.
Postavení IL-17 inhibitorů v algoritmu léčby AS
Podle doporučení EULAR a ČRS jsou inhibitory IL-17 postaveny na úroveň TNF blokátorům. Prahové hodnoty aktivity pro indikaci biologické léčby jsou uvedeny v souhrnu na obrázku 4. IL-17 blokátor by měl být preferován u pacientů s přítomnou závažnější psoriázou, anti TNF blokátor, pokud je přítomná IBD nebo uveitida.

Sekukinumab v léčbě psoriatické artritidy
Psoriatická artritida (PsA) postihuje až 30 % pacientů s psoriázou. Jde o zánětlivé, revmatické, chronické, progresivní onemocnění, které může vést k výrazným deformitám, zhoršení funkce a kvality života. PsA je velmi heterogenní onemocnění, přičemž postiženými systémy jsou skelet (periferní i axiální), kůže (psoriáza), oči (akutní přední uveitida) a střevo (IBD). Projevy skeletální jsou také pestré a zahrnují periferní artritidu, entezitidu, daktylitidu a axiální projevy, kam řadíme sakroiliitidu a spondylitidu, které se projevují bolestmi v zádech. Při PsA se často vyskytují komorbidity, které jsou definovány jako onemocnění, která přímo nesouvisí s mechanizmem vyvolávajícím PsA, ale které se vyskytují u PsA častěji nebo se závažnějším průběhem než v běžné populaci a kam řadíme zvýšené kardiovaskulární riziko, obezitu, metabolický syndrom, osteoporózu a depresivní syndrom. PsA je tedy výrazně systémové onemocnění a někdy se též hovoří o psoriatické nemoci.
Předpokladem úspěšné léčby PsA je časná diagnóza, protože bylo prokázáno, že při zpoždění nasazení účinné léčby u aktivních forem se vyskytují eroze již po 6 měsících. Stejně důležitý je týmový přístup k posouzení možné manifestace PsA podle jednotlivých domén, jak je popsáno výše. Pro léčbu PsA byla v posledních letech publikována důležitá doporučení, z nichž za zvláště významné je možné považovat Doporučení EULAR a skupiny GRAPPA. Obě tato doporučení jsou vytvořena na základě vědecké evidence. Používají v širším kontextu podobný princip následných vzestupných kroků (step up) a používání jednotlivých léků sekvenčně. Doporučení je nutné chápat nikoliv jako povinný postup, ale spíše jako specifický instrument, který má pomáhat ošetřujícímu lékaři v optimalizaci algoritmu léčby. Výběr jednotlivých postupů a léků musí být individualizován u každého pacienta podle domény, která je nejzávažnější a pacienta nejvíce zatěžující. Prvotním cílem léčby je totiž maximální možné zlepšení kvality života pacienta.
Léčba PsA vždy začíná jednoduššími prostředky kontrolujícími bolest a zánět a eventuálně lokální léčbou psoriázy. NSA jsou doporučována u nemocných s periferní artritidou a axiálními projevy. Jejich dlouhodobé a pravidelné používání je vždy nutné u jednotlivého pacienta zvážit z hlediska rizika nežádoucích účinků, a to především kardiovaskulárních a gastrointestinálních. Glukokortikoidy jsou doporučovány univerzálně pro lokální léčbu (intraartikulární ev. intraentezitickou). Nicméně názor na systémové použití glukokortikoidů je u PsA spíše negativní. Důvodem je známý fakt exacerbace aktivity PsA při vysazení glukokortikoidů. Při nedostatečné účinnosti prvního kroku léčby je doporučováno podání tradičních či jinak konvenčních DMARD (csDMARD). Nejčastěji používaným je methotrexát (MTX), a to přes kontraverzní data o účinnosti a signifikantní i historická data o nežádoucích účinků MTX u pacientů s PsA, a to především hepatotoxicity, která může být u pacientů s PsA i vyšší než u revmatoidní artritidy. Sulfasalazin má u PsA podle Cochranské analýzy jen slabý efekt. Významnější evidenci o činnosti u PsA má leflunomid. Podobně jako sulfasalazin však neovlivňuje leflunomid psoriázu. Žádný csDMARD však nemá evidenci o ovlivnění entezitidy a zpomalení rentgenové progrese PsA. Relativně menší účinnost u PsA prokázal také PDE4 inhibitor apremilast.
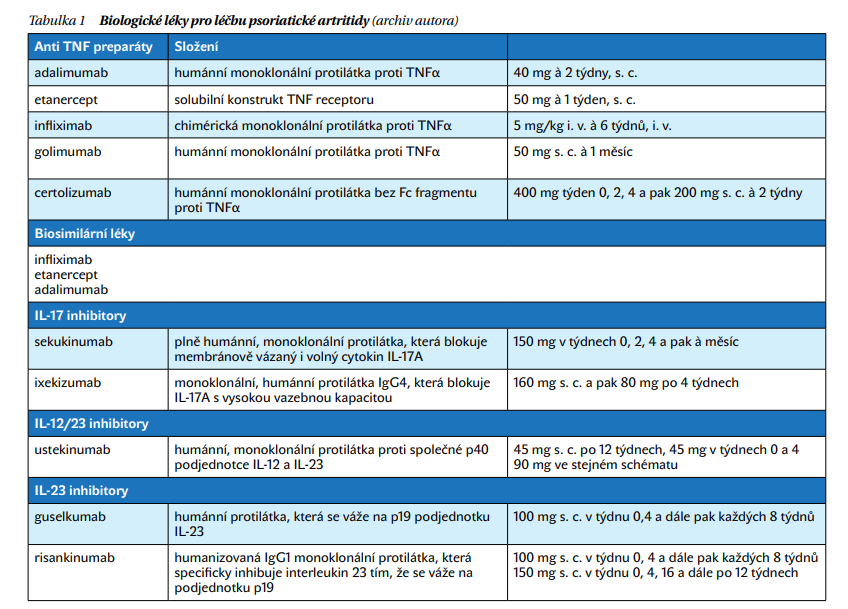
Zavedení biologické léčby PsA přineslo obrovský benefit, zvláště při limitech csDMARD zmíněných výše. Zásadní benefit anti TNF léčby byl nejen v mnohem účinnějším a rychlejším potlačení zánětu a s ním spojených symptomů (bolest, ztuhlost, zhoršení funkce), ale i v komplexním ovlivnění prakticky všech tzv. domén PsA skeletálních, kožních i systémových. Postupně bylo do léčby PsA uvedeno všech pět anti TNF preparátů (adalimumab, infliximab, etanercept, golimumab, certolizumab). Protože nebyly provedeny srovnávací studie, je možné prohlásit, že nejsou objektivní důvody pro preferenci jakéhokoliv anti TNF u PsA, s jedinou výjimkou již je neúčinnost etanerceptu na IBD a slabší účinnost na kožní syndrom. Pro známé limitace anti TNF, které byly obdobné jako výše zmíněné u AS, byly hledány bDMARD s jiným mechanizmem účinku. Prvním takovým bDMARD byl abatacept, který však neprokázal účinnost na axiální příznaky PsA. Dalším schváleným lékem pro PsA pak byl inhibitor IL-12/23.
Opravdový průlom do léčby PsA však přinesly inhibitory IL-17 sekukinumab a ixekizumab, a to především simultánním ovlivněním skeletálních a kožních příznaků, které je evidentně vyšší než u anti TNF. Nově je získávána evidence o účinnosti IL-23 blokátorů guselkumabu a risankizumabu u PsA. IL-23 inhibitory mají určitá data na ovlivnění artritidy a psoriázy, přičemž neprokázaly schopnost při schváleném dávkování zastavit radiografickou progresi PsA. Data o ovlivnění axiálních příznaků jsou zatím kontroverzní. Zcela recentně pak byla získána evidence o účinnosti JAK inhibitorů (tofacitinib, upadacitinib), jejich úhrada je zatím diskutována. Vede se také diskuze o bezpečnosti léčby JAK inhibitory u zánětlivých onemocnění.
Výsledky studií FUTURE 1–5
Sekukinumab byl hodnocen v několika tzv. pivotních studiích v indikaci PsA pod názvy FUTURE (1–5). Studie FUTURE 1 a 2 se lišily podáváním SEC v nasycovací fázi, v udržovací fázi pak byly podávány dávky 300 mg, 150 mg, 75 mg a placebo. Primárním cílem byla odpověď ACR 20 v týdnu 24, a toho bylo dosaženo, když obě dávky SEC byly účinnější než placebo (54 % vs. 51 % vs. 15 %; p < 0,0001). Signifikantní rozdíl byl u všech sekundárních kritérií, která hodnotila přísnější efekt na klouby (ACR 50,70, DAS 28-CRP, ovlivnění kůže, PASI 75, PASI 90), a kritérií hodnotících funkci a kvalitu života, HAQ, SF 36, únavnost. Nebyly signifikantní rozdíly mezi pacienty naivními na anti TNF a již selhavšími na anti TNF. Pacienti pak byli převedeni do dlouhodobé otevřené extenze a výsledky publikovány po 3 a 5 letech léčby SEC. Setrvalé zlepšení (ACR 20, 50) přetrvávalo u pacientů na léčbě u 80 %. Dlouhodobé výsledky léčby SEC byly také vyhodnoceny ve španělském registru BIOBADASER. Retence na léčbě SEC, pokud byl podáván v první linii, byla 67 %. Přetrvával efekt hodnocený pomocí DAS 28 CRP, DAPSA, BASDAI, počtem oteklých a citlivých kloubů. V národním registru Česka ATTRA byla na vzorku 426 pacientů retence po 3 letech léčby u 64 % pacientů a stavu nízké aktivity dosahovalo 75 % pacientů stále na léčbě SEC.
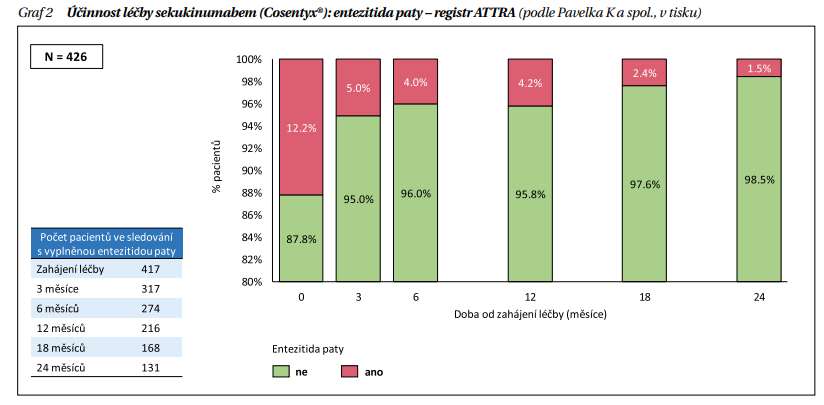
Část pacientů s PsA má výraznou entezitidu, někdy dokonce jako dominantní projev. Signifikantní zlepšení entezitického indexu při léčbě SEC oproti placebu bylo prokázáno ve studii FUTURE 2, ve studii FUTURE 5 pak byl efekt SEC 300 mg větší než po placebu a větší podíl pacientů docílil úplného vymizení entezitidy (61,4 % vs. 34,4 %). Entezitida paty byla v registru ATTRA přítomna na začátku léčby ve 12 % a po 2 letech léčby pak u 1,5 % pacientů (schéma 2). Specifickým příznakem PsA je daktylitida a studie FUTURE 2 a 5 prokázaly vymizení daktylitid po léčbě SEC častěji než po placebu. V registru ATTRA se výskyt z iniciálních 22 % snížil na 4,7 % po 2 letech léčby.
Část pacientů s PsA má formu nemoci, která se velmi blíží klinickým projevům AS. Vliv SEC na axiální příznaky PsA byl hodnocen ve studii MAXIMASE. Primárním kritériem byla odpověď ASAS 20 v týdnu 12, kterého bylo dosaženo po SEC oproti placebu a také u všech sekundárních kritérií (BASDAI 50, ASDAS, HAQ, FACIT, ASAS HI). Byl také podán objektivní důkaz o protizánětlivém účinku SEC, když došlo k signifikantnímu poklesu aktivity sakroiliitidy na MRI hodnocené pomocí SPARCC skóre.
Žádoucí vlastností bDMARD používaných v léčbě zánětlivých artritid je zpomalení rentgenové progrese. Studie FUTURE 5 byla zatím největší randomizovaná klinická studie v léčbě PsA, která potvrdila účinnost na zmírnění klinických projevů, ale také velmi malou míru rentgenové progrese.
Kromě skeletálních projevů PsA je samozřejmě důležité i ovlivnění kožního syndromu. SEC prokázal významné a setrvalé zlepšení psoriázy u PsA při použití PASI 75 a 90 v týdnu 24/63 % vs. 16 placebo. Při použití vyššího skóre PASI 90 bylo ve studii FUTURE 2 dosaženo PASI 90 u 70 % pacientů s přetrvávajícím efektem. Při přímém srovnání ve studiích FIXTURE a CLEAR byl SEC v kritériích PASI 90 A 100 účinnější než ustekinumab a etanercept. Mezi srovnávanými přípravky byla zaznamenána srovnatelná bezpečnost.
. V systematickém přehledu a metaanalýze účinnosti dostupných bDMARD a tsDMARD bylo simultánní dosažení kloubního skóre ACR 70 a kožního skóre PASI 100 nejpravděpodobnější při aplikaci IL-17 inhibitorů.
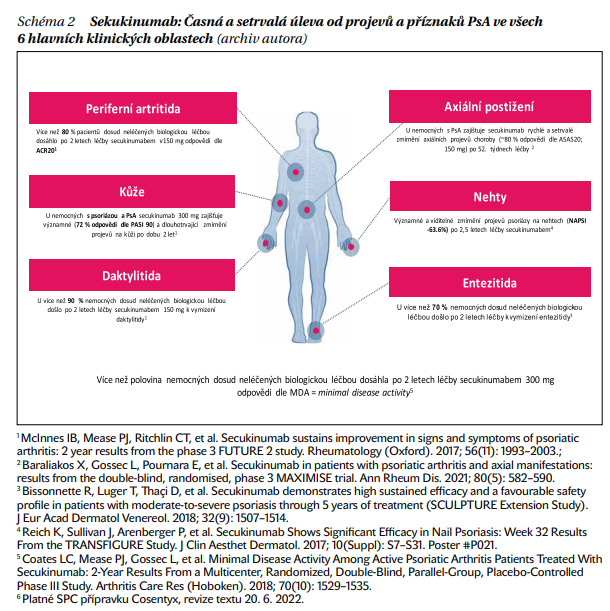
Na základě evidence lze zhodnotit, že SEC ovlivňuje všech 6 hlavních klinických domén PsA, a to periferní artritidu, entezitidu, daktylitidu, axiální příznaky, nehtovou psoriázu a kožní syndrom (schéma 2).
Postavení sekukinumabu v algoritmu léčby PsA
Biologická léčba PsA je podle Doporučení EULAR indikována u pacientů s periferní artritidou a se selháním alespoň jednoho csDMARD. Na rozdíl od starších doporučení z roku 2015 novější doporučení z roku 2019 dávají na stejnou úroveň použití anti TNF a anti IL-17 inhibitorů. Tato změna byla učiněna na základě jednak srovnávacích studií anti TNF s anti IL-17 a dále na základě získání většího množství bezpečnostních dat IL-17 inhibitorů. Protože studie prokázaly větší účinnost IL-17 než anti TNF na psoriázu, je relevantní doporučit IL-17 především u pacientů s PsA s výraznou psoriázou. Naopak u pacientů s recidivující uveitidou jsou vhodnější anti TNF monoklonální protilátky. IL-17 inhibitory nejsou také vhodné pro pacienty s PsA a souběžným IBD.
U pacientů s entezitickou nebo axiální formou PsA je možné aplikovat bDMARD i dříve, protože je známá neúčinnost csDMARD na tyto domény PsA. Byla provedena také úspěšná studie u entezitické formy juvenilní idiopatické artritidy.
Pokud dochází k primárnímu či sekundárnímu selhání SEC u PsA, je vhodné switchovat léčbu na anti TNF, anti IL-12/23, anti IL 23 a u pacientů, kde není vhodná léčba bDMARD, pak JAK inhibitor.
Bezpečnost léčby sekukinumabem
Dlouhodobá tolerance léčby SEC je přijatelná. Je to ale na druhé straně biologický lék a spektrum nežádoucích účinků po SEC je podobné jiným biologikům. Souhrnnou analýzu bezpečnosti SEC ve studiích fáze III publikoval Deodhar. Hodnoceno bylo celkem 794 pacientů, kteří reprezentovali 1 706 pacientoroků. Nejčastějšími nežádoucími účinky byly infekce – konkrétně nazofaringitida, infekce horního dýchacího traktu, dále pak bolesti hlavy a průjmy. Závažné nežádoucí účinky se vyskytly v 6 %, z toho závažné infekce v 1,1 %. Z tzv. nežádoucích účinků se zvláštním zájmem byl sledován výskyt kandidových infekcí, který byl nízký, ale některé další studie mírné zvýšení rizika lokálních kandidových infekcí zjistily. Ve zmíněné souborné analýze byly také zaznamenány jen ojedinělé případy exacerbace IBD, nicméně další analýzy zvýšené riziko exacerbace IBD zjistily. Nebyl zjištěn vyšší výskyt malignit ani závažných kardiovaskulárních příhod (MACE). Výskyt protilátek proti SEC je nízký a vznik autoimunitně vyvolaných onemocnění po léčbě SEC je extrémně nízký.
Závěr
Inhibitor IL-17A sekukinumab prokázal dobrou účinnost a bezpečnost v terapii širšího spektra spondyloartritid. V současné době je indikován k léčbě ankylozující spondylitidy, nr axSpA a PsA. Mezi jeho komparativní výhody patří podávání v měsíčních intervalech, nízká imunogenicita a především velmi dobrý efekt na kožní syndrom.
Vypracováno za podpory MZ ČR 00023728.
prof. MUDr. Karel Pavelka, DrSc.
Revmatologický ústav Praha
