Revmatoidní artritida je nejčastější autoimunitní onemocnění postihující pohybový aparát polyartritidou a projevující se četnými mimokloubními manifestacemi. V posledních více než 20 letech se léčebný repertoár rozrostl o několik cíleně působících přípravků, konkrétně biologických léků zasahujících proti cytokinům nebo imunitním buňkám, ale také na úrovni nitrobuněčné signalizace. Změnily se terapeutické strategie, kdy bez ohledu na použitý lék platí, že by měla být léčba nasazena co nejdříve od prvních příznaků nemoci a měla by být vedena k cíli.
Revmatoidní artritida (RA) postihuje 0,5–1 % populace a projevuje se ranní ztuhlostí s bolestivými otoky nejčastěji malých kloubů. Většinou vzniká u lidí v produktivním věku, zhruba třikrát častěji postihuje ženy a má obvykle týdny trvající začátek s postupným rozvojem polyartritidy. Onemocnění je spojeno s vysokým rizikem morbidity a mortality v důsledku předčasného rozvoje kardiovaskulárních a plicních onemocnění. Celkové projevy jsou vzácné, ale téměř v polovině případů se v průběhu onemocnění vyskytují nějaké extraartikulární manifestace, typický je např. syndrom suchého oka, anémie chronických onemocnění, fibromyalgický syndrom, osteoporóza, revmatické uzly nebo postižení srdce a plic, sekundární vaskulitida nebo postižení dalších vnitřních orgánů jsou méně časté.
Důležitým aspektem úspěšné léčby je včasná diagnostika onemocnění a správně zvolená léčebná strategie uplatňující princip léčby k cíli, tedy snaha navodit remisi nebo alespoň nízkou aktivitu onemocnění. Je třeba zmínit, že se nyní remise stala dosažitelným cílem u řady pacientů, ale RA je v naprosté většině případů onemocnění nevyléčitelné a vyžaduje léčbu dlouhodobou. Významný průlom v terapii RA nastal s biologickou léčbou a cíleně působícími syntetickými přípravky. V této přehledové práci bude diskutován současný stav terapie RA, zejména s ohledem na princip včasné léčby, úlohu kortikoterapie, indikace biologické léčby, cílených syntetických léků, včetně problematiky vybraných nežádoucích účinků.
Aktuální léčebné přístupy
Základním lékem zůstává ve většině případů methotrexát. Glukokortikoidy je možné krátkodobě zvážit na počátku nebo při relapsu v dalším průběhu onemocnění. Pokud se glukokortikoidy nepodaří vysadit do tří měsíců, je nutné zavedenou léčbu změnit. Další postup záleží na přítomnosti nepříznivých prognostických faktorů (vysoká aktivita nemoci, pozitivní autoprotilátky a časné erozivní poškození kloubů). Pokud nejsou přítomny nebo pokud je kontraindikace či intolerance methotrexátu, lze zvážit další základní chorobu modifikující antirevmatické léky, a to buď leflunomid, nebo sulfasalazin.
Pokud jsou ale přítomny nepříznivé prognostické faktory, je po selhání základní léčby doporučeno nasadit biologickou léčbu.
Mezi jednotlivými léčivými přípravky nejsou podstatné rozdíly v účinnosti, většinou se první nasazují inhibitory tumor nekrotizujícího faktoru (TNF) (adalimumab, certolizumab pegol, etanercept, golimumab, infliximab, včetně biosimilárních přípravků), lze použít i inhibitor receptoru interleukinu 6 (IL-6) (tocilizumab nebo sarilumab), ale také inhibitor kostimulace T lymfocytů (abatacept) nebo inhibitor B lymfocytů (rituximab, včetně biosimilárních přípravků). V první linii je možné zvážit i cílené syntetické léky (inhibitory Janusovy kinázy (JAK) – tofacitinib, baricitinib, upadacitinib a filgotinib), u nichž je třeba vzít v úvahu relevantní rizikové faktory, především kardiovaskulární. V případě nutnosti monoterapie mají výhodu inhibitory receptoru IL-6 nebo JAK. U nemocných v setrvalé remisi (minimálně půl roku), kteří již nejsou léčeni glukokortikoidy, je možné zvážit redukci dávky biologického léku. V tomto přehledovém článku bude diskutováno postavení methotrexátu a glukokortikoidů, biologické a cílené syntetické léčby, včetně strategických postupů a terapie obtížně léčitelných pacientů.
Základem úspěchu je včasná diagnostika
Prvním předpokladem úspěchu je včasné určení diagnózy a rychlé zahájení účinné léčby. Diagnóza se v praxi opírá o klinický obraz artritidy, laboratorní nález a splnění klasifikačních kritérií. V současné době lze onemocnění diagnostikovat poměrně brzy, protože klinicky zjevná artritida jednoho nebo několika málo kloubů je již předpokladem pro použití kritérií, aniž by se vyčkávalo na rozvinutí polyartritidy nebo přítomnost typických kostních erozí. Často může pomoci bolest při testu příčného stisku metakarpofalangeálních kloubů. Na počátku je důležité odlišit projevy artritidy od mnohem častější osteoartrózy. Vyšetření revmatologem je nezbytné při otoku alespoň jednoho kloubu s ranní ztuhlostí trvající alespoň 30 minut, ideálně v ambulanci časné artritidy nebo na základě individuální domluvy s revmatologem, aby se neprodlužovala délka příznaků k nasazení léčby. Při včasném zahájení léčby lze u většiny nemocných navodit klinickou remisi nebo nízkou klinickou aktivitu, což vede k zachování hybnosti a zabránění vzniku nevratného poškození. Existují i některé doklady o tom, že včasná intervence může zabránit nebo alespoň oddálit rozvoj onemocnění i u jedinců s klinicky suspektními artralgiemi, tedy s bolestmi kloubů bez klinicky zjevné artritidy, které představují vysoké riziko vývoje RA (tabulka 1).

Methotrexát – je stále lékem volby?
Methotrexát (MTX) je stále lékem první volby. V léčbě RA je používán od konce 80. let minulého století, ale revmatologové se ho museli naučit správně dávkovat, zprvu se podávaly nízké dávky. V současnosti je MTX ve většině případů zahajován dávkou v rozmezí 10–15 mg týdně, která se podle tolerance navyšuje každé 2–4 týdny do maximální dávky 25–30 mg týdně. Den po užití MTX se podává substituce kyseliny listové, která snižuje potenciální nežádoucí účinky. Na rozdíl od antiproliferativních účinků MTX, které se projevují při mnohem vyšších dávkách, než jaké se používají u RA, nevyužívají protizánětlivé účinky folátové dráhy. Úplného účinku MTX bývá zpravidla dosaženo po 4–6 měsících. Používá se jako lék nejen pro iniciální léčbu, ale je vhodný i pro kombinaci s dalšími antirevmatickými přípravky. Při nedostatečném účinku nebo gastrointestinální intoleranci je doporučeno změnit aplikační formu na subkutánní přípravek. V případě kontraindikace léčby MTX (např. vážné onemocnění jater nebo ledvin), eventuálně při jeho časné nesnášenlivosti, je doporučováno jako lék první linie nasadit leflunomid nebo sulfasalazin. Je třeba ale uvést, že bezpečnostní rizika a kontraindikace jsou u zmíněných léků podobné. Antimalarikum hydroxychlorochin je možné v monoterapii nasadit pouze u velmi mírné formy onemocnění, častěji lze využít v kombinacích nebo jako sulfasalazin během gravidity a laktace. Akademickou otázkou stále zůstává, zda indukční léčba biologickými nebo cílenými syntetickými přípravky není v dlouhodobém horizontu proti intenzivně vedené léčbě MTX v kombinaci s glukokortikoidy prospěšnější. Zatím se ale zdá, že nasazení biologického léku s určitým zpožděním u nemocných, kteří na iniciální léčbu MTX neodpověděli dostatečně, nemá toto zpoždění podstatný vliv na další efekt léčby a osud nemocných.
Co je nového s glukokortikoidy?
V posledních letech byl kladen poměrně velký důraz na nasazení glukokortikoidů současně s MTX v počáteční fázi nebo při vzplanutí nemoci, ale zároveň bylo doporučováno glukokortikoidy postupně redukovat a podávat je co nejkratší dobu. Není pochyb o tom, že racionálně vedená léčba glukokortikoidy má rychlý protizánětlivý účinek a kromě zlepšení aktivity tlumí i strukturální progresi onemocnění. Na druhé straně ale existuje riziko vedlejších nežádoucích účinků kortikoterapie. V recentních doporučeních tak pro léčbu RA nastala změna a glukokortikoidy je doporučováno zvážit krátkodobě v případě zahajování nebo změny konvenční léčby a velký důraz je kladen na jejich vysazení do tří měsíců užívání, tzn. je využit pouze k překlenutí nástupu účinku chorobu modifikující antirevmatické léčby. Většinou se podávají nízké dávky, u velmi aktivního onemocnění lze podat dávky vyšší. Nejčastěji se využívají perorální přípravky, možné je někdy s výhodou podat i depotní glukokortikoid muskulárně nebo vzácněji intravenózně. Před zahájením kortikoterapie je ale vždy důležité zvážit všechny komorbidity nemocného, které predisponují k rozvoji nežádoucích účinků, a vysvětlit nemocnému cíl léčby a potenciální rizika.
Data z národních registrů běžné klinické praxe, ale i klinické studie ukazují, že stále přibližně polovina pacientů s RA je na chronické kortikoterapii. Na druhé straně ale většina studií, ve kterých je postupná redukce glukokortikoidu k vysazení dána předem definovaným protokolem, poukazuje na vysazení kortikoterapie u 90 % jedinců. Proto stávající doporučení pro léčbu RA silně podporují kortikoterapii ukončit tak rychle, jak je to jen možné. Podávání glukokortikoidů po dobu delší než čtyři měsíce by mělo být považováno za nedostatečný účinek souběžně podávaného MTX nebo jiného chorobu modifikujícího antirevmatického léku.
U pacientů, kteří jsou již nastaveni na chronické kortikoterapii nebo pokud se glukokortikoidy v některých případech zcela vysadit nedaří, je nezbytné, aby byla dávka přípravku co nejnižší – v klinické praxi mohou přispívat k udržení klinické remise nebo nízké aktivity i dávky nižší než 5 mg prednisonu. Dlouhodobá léčba samostatnými glukokortikoidy není doporučována a vždy by se mělo hledat lepší řešení, přičemž dlouhodobé podávání dávek vyšších než 5 mg prednisonu je pravděpodobně u většiny pacientů spojeno s převahou nežádoucích účinků nad potenciálním benefitem. Při vzplanutí onemocnění, obvykle při artritidě méně kloubů, je vhodné zvážit cílenou intraartikulární aplikaci glukokortikoidu, která je v potlačení zánětlivé aktivity postiženého kloubu velice účinná a vzhledem k převážně lokálnímu působení je spjata s nižším rizikem nežádoucích účinků.
Jak postupovat při selhání methotrexátu?
Pokud léčbou první linie, většinou MTX, nedosáhneme remise nebo nízké aktivity, pak je třeba zvážit přítomnost rizikových faktorů spojených s horší prognózou onemocnění, mezi které patří např. vysoká klinická aktivita, přítomnost kostních erozí nebo pozitivita autoprotilátek. U nemocných bez těchto rizikových faktorů je možné ve druhé linii nasadit leflunomid nebo sulfasalazin, případně, pokud není důvodem selhání nesnášenlivost, i kombinaci těchto léků s methotrexátem. Často se k překlenutí nástupu účinku nově nasazeného léčiva využívají glukokortikoidy.
U nemocných s nepříznivými prognostickými faktory je po selhání MTX vhodné nasadit biologickou léčbu nebo cílenou syntetickou léčbu – Janusovy kinázy (JAK). V současnosti je k dispozici devět biologických léků, pět přípravků ovlivňujících tumor nekrotizující faktor (TNF), čtyři léky s jiným mechanizmem účinku a čtyři inhibitory JAK (tabulka 2). Účinnost biologické a cílené syntetické léčby je velmi podobná, skoro všechny přípravky jsou tak dávány na stejnou úroveň. Antagonista receptoru pro interleukin 1 (anakinra) má ale ve srovnání s ostatními léky výrazně slabší účinek a v podstatě se v této indikaci u dospělých pacientů nepoužívá. Biologická léčba se většinou dává do kombinace s MTX, protože je takto prokazatelně v řadě případů účinnější. U nemocných s kontraindikacemi nebo intolerancí MTX je nejvhodnější léčba inhibitory IL-6 receptoru nebo JAK, které jsou nejčastěji využívány pro monoterapii.
Jaký biologický nebo cílený syntetický lék zvolit?
Přestože je možné po selhání konvenční léčby nasadit téměř jakýkoliv biologický lék nebo inhibitor JAK (tabulka 2), v praxi je ve většině případů dávána přednost inhibitorům TNF. Jsou s nimi nejdelší zkušenosti (více než 20 let) a cenově jsou nyní mnohem dostupnější. Iniciálně se často využívají biosimilární léky, jejichž účinnost a bezpečnost je srovnatelná s originálními přípravky a jejich zavedení do praxe významně snížilo vysoké ekonomické náklady na léčbu RA.
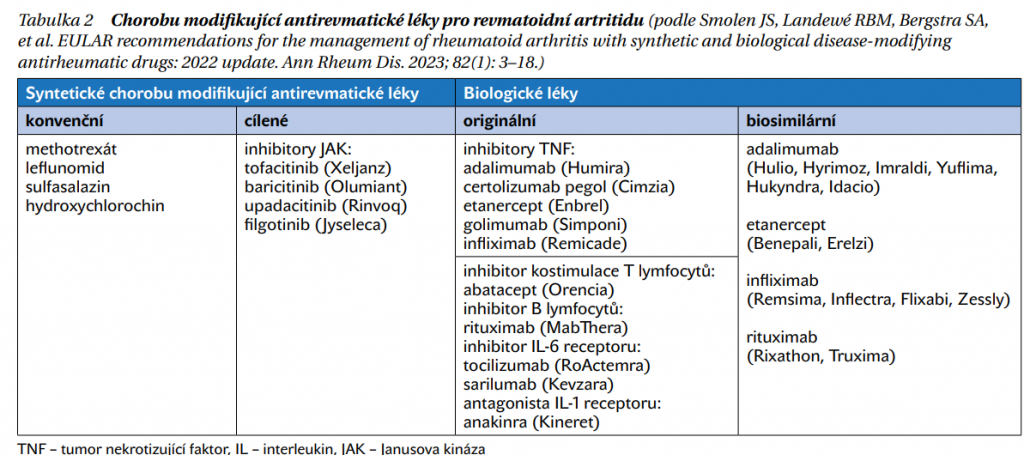
Zvolení konkrétního biologického nebo cíleného syntetického přípravku nelze opřít o specifické ukazatele, ale v praxi je možné využít některé charakteristiky onemocnění. Rituximab a abatacept mají např. lepší účinek v případě přítomnosti revmatoidních faktorů anebo protilátek proti citrulinovaným peptidům. Rituximab je většinou v praxi podáván nemocným, u nichž selhala předchozí biologická léčba, případně nemocným s kontraindikacemi jiné biologické léčby, jako je např. výskyt lymfomu či demyelinizačního onemocnění. Podávání abataceptu může mít další výhodu, v porovnání s inhibitory TNF je spojen s menším rizikem vážených infekcí. Pro inhibitory JAK existuje v současnosti nové podstatné omezení – jejich podávání jedincům starším 65 let a kuřákům, pacientům s kardiovaskulárními rizikovými faktory a s rizikovými faktory malignity je možné pouze, pokud nejsou k dispozici žádné další vhodné léčebné alternativy (https://www.ema.europa.eu/en/medicines/human/referrals/janus-kinase-inhibitors-jaki). Opatrné použití inhibitorů JAK se doporučuje také u pacientů se známými rizikovými faktory hluboké žilní trombózy.
Jak postupovat při selhání biologického léku?
V případě, že dojde k selhání biologické léčby nebo podávání inhibitoru JAK, je doporučeno zvážit náhradu jiným biologickým lékem nebo inhibitorem JAK. Pokud selhal inhibitor TNF nebo inhibitor IL-6 receptoru, pacienti mohou dostat lék s jiným mechanizmem účinku, ale je možné zvážit i druhý inhibitor TNF nebo inhibitor IL-6 receptoru. V praxi záleží na různých okolnostech. Čím více je selhavších předchozích léčiv, tím je účinnost následného přípravku horší. Biologické léky, nejčastěji chimérické nebo humanizované protilátky proti TNF, jsou imunogenní a mohou vyvolat protireakci organizmu ve formě tvorby protilátek proti biologickému léku, které mohou biologický lék neutralizovat. Současné užití methotrexátu tvorbu těchto protilátek výrazně snižuje. Výsledkem tvorby protilátek proti léku může být ztráta jeho účinku nebo vznik nežádoucích projevů.
Postup v případě obtížně léčitelného onemocnění
Jak je možné nejlépe charakterizovat obtížně léčitelnou RA? V minulosti se jednalo o synonymum pro polyartritidu s rozvojem erozí a kloubních deformit, s invaliditou a ztrátou nezávislosti, ale také se zvýšeným rizikem kardiovaskulárních onemocnění, malignit, infekcí a předčasného úmrtí. Tyto stavy jsou nyní spíše vzácné, ale podle nové definice je výskyt obtížně léčitelné RA odhadován na 5–20 % a je nyní charakterizován jako (1) selhání alespoň dvou biologických nebo cílených syntetických léků s různým mechanizmem účinku za předpokladu léčby podle doporučených postupů, (2) aktivní nebo progresivní onemocnění, které je možné charakterizovat jako přítomnost alespoň jednoho z následujících znaků: střední a vyšší aktivita onemocnění podle kompozitního indexu, klinické příznaky svědčící o aktivním onemocnění, neschopnost vysadit léčbu glukokortikoidy, rychlá rentgenová progrese nebo snížení kvality života, a (3) pokud je zároveň léčba vnímána revmatologem nebo pacientem jako problematická.
Pro léčbu obtížně léčitelné RA byly nedávno navrženy body ke zvážení, v první řadě je třeba vždy zvážit možnost chybné diagnózy nebo přítomnost koexistujícího napodobujícího onemocnění (fibromyalgie, osteoartróza, paraneoplastický syndrom nebo jiné systémové onemocnění). V případě pochybností o přítomnosti klinických známek zánětlivé aktivity lze zvážit ultrazvukové vyšetření. V případě přítomnosti komorbidit (např. obezity nebo fibromyalgie) je nezbytné kompozitní indexy a klinické vyšetření interpretovat s opatrností, protože mohou nadhodnocovat aktivitu onemocnění. Vždy je třeba s pacientem diskutovat adherenci k léčbě. Po selhání druhého (a dalšího) biologického a cíleného syntetického léku, zejména po selháních dvou inhibitorů TNF, by se měla zvážit léčba s jiným mechanizmem účinku. Měla by se také zvážit maximální dávka, která byla v příslušných klinických testech shledána jako účinná a bezpečná. Komorbidity často ovlivňují kvalitu života samostatně nebo omezují možnosti léčby RA, proto by měly být pečlivě zváženy a léčeny. Např. u pacientů se souběžným výskytem HBV/HCV infekce je třeba zvážit biologickou a cílenou syntetickou léčbu a souběžnou antivirovou profylaxi v úzké spolupráci s hepatologem. Vždy je třeba také zvážit nefarmakologické postupy – fyzioterapii, cvičení, psychologickou podporu, edukaci, programy „self-managementu“, které mohou optimalizovat zvládání funkčního postižení, bolesti a únavy.
Závěr
Revmatoidní artritida je chronické onemocnění vyžadující léčbu včasnou, ale zároveň dlouhodobou. Poměrně často již dosahujeme stavu nízké aktivity onemocnění, u některých pacientů se nám již daří navodit remisi, vzácněji trvalou, což by ale mělo být snahou u každého pacienta. Stále však neznáme příčinu onemocnění, abychom se mohli pokusit o její vyléčení, nebo dokonce prevenci. I když již máme poměrně dost léčebných možností – stávající biologické léky a cíleně působící syntetické přípravky zasahující na různé úrovni zánětlivé kaskády, nemalá část pacientů zdaleka nedosahuje stavu nízké aktivity, natož remise. Přestože nejlepší klinické zlepšení pozorujeme na počátku léčby, stále jsme odkázáni na metodu pokus-omyl. Výzvou do budoucna tak zůstává nejen potřeba nových cílených léků, případně strategických postupů, ale i schopnost stratifikovat nemocné podle klinické odpovědi a predikce nežádoucích účinků na konkrétní typ léku.
Podpořeno projektem Ministerstva zdravotnictví pro koncepční rozvoj výzkumné organizace 023728.
prof. MUDr. Ladislav Šenolt, Ph.D.
Revmatologický ústav
Klinika revmatologie 1. LF UK v Praze
