V posledním desetiletí byl zaznamenán významný pokrok v terapii maligního melanomu, zejména díky integraci imunoterapie do léčebných algoritmů. Tento pokrok se projevuje jak v adjuvantní, tak v paliativní sféře a je úzce spojen s objevováním klíčových molekulárních struktur, které regulují imunitní odpověď. Současně vynikají monoklonální protilátky cílící na CTLA-4 (ipilimumab) a PD-1 (nivolumab, pembrolizumab), zatímco v terapii metastatického onemocnění se prosazuje nově relatlimab, inhibující LAG-3.
Od zavedení moderní imunoterapie do onkologické praxe v roce 2011 jsme svědky jak rozšíření terapeutických indikací, tak i zvýšení počtu molekul ovlivňujících klíčové kontrolní body imunitní reakce, známé jako checkpoint inhibitory. Imunoterapeutická intervence v maligním melanomu začala s uvedením ipilimumabu, který cílí na CTLA-4 receptor. Tento byl brzy doplněn a částečně nahrazen inhibitory, které interagují s PD-1 receptorem, konkrétně nivolumabem a pembrolizumabem. Tyto látky se staly dlouhodobým standardem léčby jak metastatického a inoperabilního melanomu, tak i v rámci adjuvantní terapie pro lokálně pokročilá klinická stadia s uzlinovým postižením a v současné době i pro časná klinická stadia IIB, IIC.
Checkpoint inhibitory
Postupně se rozšiřuje naše pochopení imunitního systému a jeho interakcí s nádorem, což má významný dopad na efektivitu protinádorové odpovědi. Díky těmto poznatkům byly identifikovány další potenciální cíle pro checkpoint inhibitory, jako je LAG-3, což přispívá k dalšímu rozvoji této terapeutické strategie a vede k významnému zlepšení prognózy pacientů s melanomem.
Mechanismus účinku checkpoint inhibitorů je založen na narušení receptorové vazby, která při normálních okolnostech vyvolá inhibiční signál vedoucí k útlumu imunitní aktivity. Interakcí monoklonálních protilátek s těmito receptory dochází k odblokování tohoto signálu, což oslabuje inaktivaci a eliminaci cytotoxických T lymfocytů, a naopak posiluje specifickou imunitní odpověď proti nádoru.
Imunoterapie v adjuvantní léčbě maligního melanomu
Adjuvantní léčba maligního melanomu v lokálně pokročilých stadiích je motivována potřebou snížit riziko relapsu a prodloužit přežití u těchto pacientů. Pětileté přežití pacientů s klinickým stadiem IA dosahuje 97 %, zatímco u stadia IIIC je to pouze 40 %. S etablováním checkpoint inhibitorů a cílené terapie pro generalizovaná stadia melanomu se zvýšil zájem o jejich využití i v adjuvantní léčbě. Tyto inovativní léčebné přístupy prokázaly svou superioritu nad dosavadními standardními metodami, což se odráží ve snížení rizika relapsu onemocnění z 20 % na 50 %.
V současnosti jsou pro adjuvantní léčbu registrovány nivolumab a pembrolizumab, a to bez rozdílu na přítomnost mutace v genu BRAF. Pembrolizumab a nivolumab mají indikaci pro podání u pacientů po kompletní resekci maligního melanomu ve stadiu III na dobu jednoho roku. Nivolumab je možné podávat i u pacientů ve stadiu IV po radikální a kompletní resekci metastatického postižení. Pembrolizumab je nově registrován i pro stadium IIB a IIC.
Vzhledem k existenci možnosti podávat v adjuvantní terapii kombinaci dabrafenibu s trametinibem u pacientů s BRAF mutací vzniká dilema mezi preferencí cílené léčby nebo imunoterapie. K dispozici nejsou prospektivní studie, které by srovnávaly efektivitu obou přístupů, ani data o celkovém přežití. Přesto se ukazuje, že i přes relativní rozdíly v prvních 2 letech dochází u obou terapeutických modalit po 3 letech k dosažení plateau fáze pro míru relapsu.
Při výběru adjuvantní léčby je nutné zvážit biologickou povahu nádoru, komorbidity pacienta a jeho informované preference. Rovněž forma aplikace léčby a rizika spojená s nežádoucími účinky terapie jsou klíčové faktory. Imunoterapie může vyvolat imunitně podmíněné nežádoucí účinky (irAE), s nimiž se setká přibližně 15 % pacientů, zatímco ukončení léčby z důvodu toxicity dosahuje okolo 10 %. Tyto účinky jsou většinou léčitelné kortikoidy, avšak mohou mít dlouhodobé následky, zejména endokrinopatie, jako je hypotyreóza vyžadující celoživotní léčbu.
Vstup moderní adjuvantní léčby do klinické praxe vyvolává otázky, co dělat v případě selhání terapie. Aktuálně dostupná data nejsou dostatečná pro spolehlivé rozhodování v těchto situacích. Je nezbytné, aby pacienti byli hodnoceni multidisciplinárním týmem, který zváží všechny dostupné léčebné možnosti a stanoví optimální strategii léčby na základě konkrétního klinického kontextu pacienta.
Imunoterapie v léčbě generalizovaného maligního melanomu
V současné době představuje podávání checkpoint inhibitorů standardní léčbu pro metastatický melanom, přičemž přítomnost mutace BRAF genu neovlivňuje výběr terapie. Navzdory úspěchům v imunoterapii existují pacienti, u nichž monoterapie zacílená na PD-1 není účinná, nebo u nichž není možné aplikovat kombinaci PD-1 inhibitorů s CTLA-4 inhibitory. Z tohoto důvodu pokračuje výzkum nových terapeutických možností, jako je kombinace anti-PD-1 s anti-LAG-3, známá jako Opdualag.
Efektivita imunoterapie je prokázána bez závislosti na mutaci v genu BRAF. To vytváří dilema ohledně výběru mezi imunoterapií a cílenou terapií pro pacienty, kteří mohou být léčeni oběma přístupy. Z analýz prospektivních i retrospektivních studií se ukazuje, že v průběhu prvních 3 let dochází k ustálení křivky přežití, a to bez rozdílu použitého preparátu. Tříleté přežití se pohybuje u ipilimumabu kolem 20 % a pětileté kolem 18 %. V případě použití samotného anti-PD-1 preparátu jsou tříletá a pětiletá přežití opět o trochu zlepšena, a to opět bez rozdílu na použitý preparát na cca 52 %, respektive 44 %. Dosud nejlepšího výsledku v éře novodobé léčby nad 50 % přežívajících pacientů s generalizovaným onemocněním 5 let se dosahuje při použití kombinované terapie nivolumabem s ipilimumabem (tabulky 1 a 2).
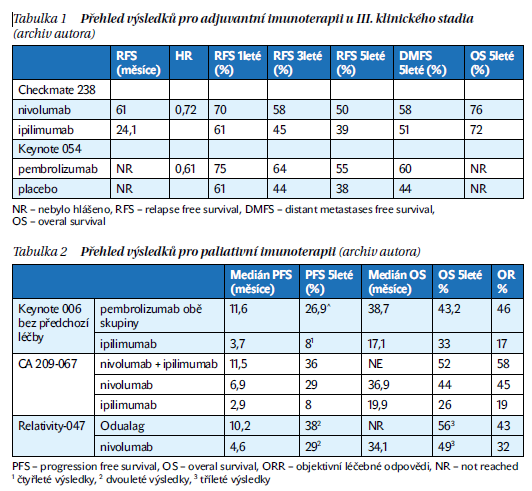
Dosud neexistuje randomizovaná klinická studie, která by jednoznačně určila preferovanou léčebnou strategii. Z dlouhodobého hlediska se však jeví imunoterapie jako preferovaná volba. Tento přístup je podpořen i dílčími výsledky klinických studií DREAMseq a SECOMBIT.
Posun v léčbě generalizovaného maligního melanomu nezahrnuje pouze kvantitativní zlepšení, ale také kvalitativní, přičemž profil nežádoucích účinků, ačkoliv má svá specifika, nevede primárně k ukončení terapie. Nicméně je důležité, aby lékaři měli vždy na paměti potenciální nežádoucí účinky a poskytovali pacientům adekvátní edukaci.
Přestože byly v terapii generalizovaného melanomu dosaženy významné úspěchy, výzkum a vývoj v této oblasti musí pokračovat, aby byly identifikovány optimální léčebné strategie pro všechny pacienty. Zároveň je nezbytné zajistit, aby byly tyto poznatky efektivně implementovány do klinické praxe a reflektovány v úhradových politikách.
Závěr
Posun v léčbě maligního melanomu doznal v posledních 10 letech významných změn. Tyto změny se projevují nejen v kvantitativním smyslu prodloužení délky života, ale dochází často i ke zlepšení jeho kvality s ohledem na snížení toxicity léčby, a to jak u generalizovaného onemocnění, tak i v adjuvantním podání. A tak hlavním úkolem současného výzkumu zůstává identifikace biomarkeru, který by nám pomohl v rozhodování při výběru toho nejlepšího léku pro konkrétního pacienta.
MUDr. Jindřich Kopecký, Ph.D.
Klinika onkologie a radioterapie LF a FN Hradec Králové
