V posledních třech letech došlo u kolorektálního karcinomu k významnému posunu v poznání zákonitostí jeho vzniku – v diagnostice i léčbě. Proto je v tomto článku souhrnně prezentujeme.
Adenokarcinom tračníku je druhým nejčastěji diagnostikovaným nádorem v Čechách – u mužů tvoří jeho podíl 13,7 % mezi všemi nově diagnostikovanými nádory po diagnóze karcinomu prostaty. U žen jde o 10,8% četnost ze všech výskytů malignit, kde následuje karcinom prsu. Souhrnně bylo u obou pohlaví v roce 2018 nově diagnostikováno 7 273 případů. Rozdělení podle stadií v době diagnózy se mezi pohlavími signifikantně neliší, distribuce činí po zaokrouhlení přibližně 23/23/25/19 % ve stadiích I/II/III/IV (zbývající podíl do 100 % znamená neurčené/nenahlášené stadium).
Data publikovaná Ústavem zdravotnických informací a statistiky ukazují zajímavý trend v incidenci. Počátkem osmdesátých let dosahovala evidence u diagnózy C18 – karcinom tračníku – kolem 13 osob na 100 000 obyvatel, kulminovala v roce 2002 incidencí 25/100 000 obyvatel a od té doby až na jednu výjimku setrvale klesá k úrovni 18/100 000 obyvatel. Podobně příznivý trend je pozorován i v druhém důležitém parametru, a to mortalitě. U ní byl nejméně příznivý údaj zaznamenán na přelomu tisíciletí, od té doby za 20 let klesla mortalita o téměř 40 %, pravděpodobně jako důsledek přesunu diagnózy do časnějších stadií.
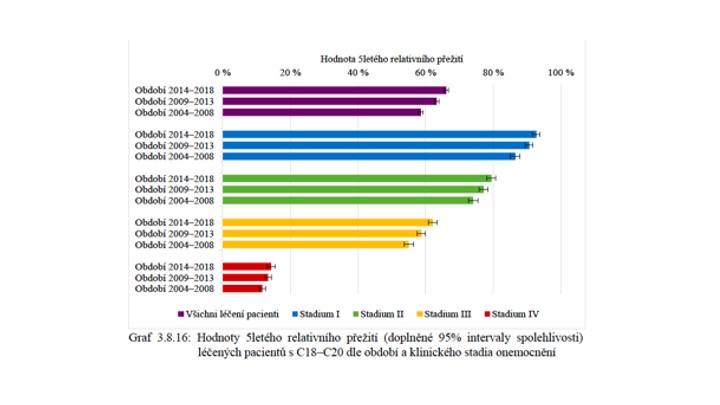
Jak dokládá graf 1 (převzatý z ročenky Novotvary v ČR 2018), v rámci stadií I–III je možné vypozorovat signifikantní trend ke zlepšování léčebných výsledků u jednotlivých stadií v průběhu času. Zajímavé je uvědomit si výsledky pro čtvrté stadium, tedy u osob s generalizací nádoru. Je zjevné, že ani přes velké nasazení finančních a technických prostředků do nových forem systémové i lokoregionální léčby nedochází k žádoucímu prodloužení přežívání pacientů. Proto je logické při alokaci omezených zdrojů plynoucích do zdravotnictví sázet především na primární i sekundární prevenci.
Prevence kolorektálního karcinomu
V rámci primární doporučení primární prevence jsem nezaznamenal žádný posun v obecných doporučeních. Je vhodné se vyvarovat negativních vlivů životního stylu, které zvyšují riziko vzniku kolorektálního karcinomu (KRK) (tabulka 1). Podobně bez nových poznatků jsou všeobecně popisované vztahy mezi zvýšeným rizikem vzniku KRK a jinými stavy, jako idiopatickými střevními záněty, předchozí radioterapií pánve pro jiný tumor, cystickou fibrózou, diabetes mellitus, pohlavím, rasou, akromegalií, orgánovými transplantacemi, hereditárními nádorovými syndromy.
Z pohledu chemoprevence se již více než 34 let diskutuje profylaktická účinnost kyseliny acetylsalicylové. Do amerických doporučení NCCN na základě výsledků observačních i intervenčních randomizovaných studií proniklo doporučení diskutovat 5–10leté podávání kyseliny acetylsalicylové v dávce 80 mg zdravým osobám od 45–59 let věku za přísného posouzení možných dalších benefitů (např. kardiovaskulárního) a naopak rizik (gastrointenstinálního krvácení apod.).
Tabulka 1 Rizikové faktory životního stylu pro vznik kolorektálního karcinomu
| Faktor | RR vzniku KRK |
| Kouření | 1,18× vyšší incidence 1,25× vyšší mortalita |
| Vyšší spotřeba červeného masa | každých 100 g denně zvyšuje riziko o 12 % |
| Alkohol | 1,21–4,0× vyšší incidence podle míry spotřeby alkoholu |
| Obezita | 1,23× vyšší incidence |
| Nízký příjem vitaminu D | 1,31× vyšší incidence při deficitu |
Nádorová genetika
Před několika lety bylo rozpoznání hereditárních nádorových syndromů technicky složité, a tak gastroenterologové a onkologové odesílali k vyšetření ke klinickým genetikům pouze omezené množství pacientů s KRK, kteří splňovali určitá arbitrárně stanovená kritéria, díky nimž bylo možné suspekci na hereditární původ nádoru vyslovit.
Pro Lynchův syndrom se jednalo o tzv. Amsterdamská kritéria II, u pacientů s vícečetnými polypy se primárně vyšetřovaly geny APC a MUTYH. Zavedení multigenových panelů a tzv. sekvenace nové generace jakož i nových imunohistochemických metod vedlo k tomu, že dnes již můžeme vyšetřovat všechny nemocné s KRK a dovodit tak, zda jejich nemoc vznikla na podkladě zárodečné mutace či náhodné shody mnoha okolností.
V případě přítomnosti KRK v terénu polypů vyšetřujeme i nadále geny APC a MUTYH. Pro poznání Lynchova syndromu je zavedeno stanovení mutací genu BRAF společně s imunohistochemickým stanovením (ne)přítomnosti proteinů MLH1, MSH2, PMS1, MSH6, které vznikají přepisem příslušných genů tzv. MMR – mismatched repair systému, tedy systému, který je zodpovědný za reparace špatného párování bází DNA.
Tento soubor vyšetření rozdělí pacienty na:
- nemocné s funkčním MMR systémem bez přítomnosti hereditární složky (všechny proteiny jsou detekovatelné, přičemž stav BRAF onkogenu se nezohledňuje),
- nemocné s Lynchovým syndromem, tj. díky vrozené mutaci nefunkčním MMR systémem (detekována je absence alespoň jednoho proteinu MMR a není přítomna BRAF mutace),
- nemocné s nefunkčním MMR systémem vzniklým v průběhu života, bez dědičného podílu (absence alespoň jednoho proteinu MMR a s BRAF mutací. Tato forma KRK vzniká na podkladě hypermetylace promotor MLH1 genu, což vede k výpadku syntézy MLH1 proteinu).
Vyšetření pomocí imunohistochemie je třeba považovat za screeningové a nález absence některého z proteinů MMR systému při BRAFwild typeby měl vést onkologa k odeslání pacienta na oddělení klinické genetiky k provedení definitivní molekulárněgenetické analýzy.
Mutace v genu APC vedou ke 100% jistotě, že nosič alterace během života onemocní KRK, a proto jsou zdraví nosiči kandidáti intenzivního screeningu a profylaktické (proto)kolektomie. Mutace v genu MUTYH mohou být homozygotní nebo heterozygotní a mohou se nacházet v různých částech genu, a tomu odpovídá riziko onemocnět KRK, které dosahuje od 1,3násobku populačního rizika až po několikanásobek.
Pro Lynchův syndrom je popisována penetrace genu kolem 60–80 %, přičemž záleží na typu alterovaného genu, pohlaví a dalších faktorech, zda se projeví kromě KRK též nádory pánvičky ledvinné, žaludku, děložního těla, mozku apod.
Nově s relativním rizikem 1,7 bylo popsáno zvýšené riziko onemocnět KRK u nosičů genové mutace v CHEK2.
Naopak dlouhodobě popisovány jsou v učebnicích další syndromy, jako Peutzův-Jeghersův (s alterací STK11), syndrom Cowdenův (alterace PTEN) nebo syndrom juvenilní polypózy, nicméně je třeba říci, že jejich incidence je na rozdíl od familiární adenomatózní polypózy a Lynchova syndromu zanedbatelná.
Diagnostika kolorektálního karcinomu
Definice nepodkročitelného minima pro zjištění charakteru a rozsahu nemoci zahrnuje CT hrudníku, břicha, malé pánve k popisu stadia podle TNM klasifikace, stanovení nádorového markeru v séru CEA a stanovení molekulárních prediktorů důležitých k vedení onkologické léčby.
Z patologického hlediska je třeba po operaci obdržet vyčerpávající popis rozsahu nádoru včetně vzdálenosti od okrajů resekátu ve všech směrech, (ne)přítomnosti lymfatické a vaskulární invaze, popis počtu a eventuální velikosti satelitních nádorových uzlů, nádorového grade a podíl mucinózní komponenty, je-li zastižena.
Za standardní panel imunohistochemických a molekulárněgenetických vyšetření, které klinik jednoznačně potřebuje, je pro stadia I–III vyšetření mikrosatelitové nestability a stavu BRAF onkogenu, pro vedení paliativní léčby nad výše uvedené potřebujeme i znalost mutačního stavu onkogenů NRAS a KRAS. Pro vedení eventuální imunoterapie je možné stanovit expresi PD-L1, ovšem v praxi se lze spokojit s vyšetřením MMR.
Zvláštním problémem je otázka zařazení PET-CT vyšetření. Z nedávno publikované metaanalýzy plyne, že změna léčebného přístupu nenastává u osob stadia I a II. Naopak u pokročilých stadií může zjištění dalších lokalizací metastáz s pomocí PET CT přispět ke změně léčebné strategie až u 24 % osob. Jde zejména o překlasifikování přístupu k plánované resekci jaterních metastáz poté, co PET-CT zobrazí chirurgicky neřešitelné mimojaterní postižení.
Současné terapeutické postupy
Adjuvance
Karcinom tračníku a sigmatu není po operaci ve stadiu I vzhledem k zanedbatelnému riziku vzniku recidivy léčen pooperační adjuvantní chemoterapií.
Stejné tvrzení platí pro většinu nemocných s nádory II. stadia. Jen malý podíl nemocných stadia II je léčen adjuvantní léčbou – jde o nemocné s nějakou další charakteristikou, která je spojována s vyšším rizikem vzniku recidivy, např. s nádory pT4, nádory s lymfatickou nebo vaskulární invazí, nádory prezentujícími se obstrukčním ileem, nádory vyššího grade. Nicméně toto už dnes neplatí. V rámci výše definované „rizikové“ skupiny jsme schopni vyčlenit osoby, které i přes tyto charakteristiky mají příznivou prognózu a nadto mají i primární chemorezistenci k fluoropyrimidinům (používaným v adjuvanci). Jde o pacienty s mikrosatelitovou nestabilitou. Jednoduchý test tedy dokáže pacienty potěšit tím, že jim může být sdělena informace o příznivé prognóze a o tom, že nemusí podstoupit chemoterapii s obávanými vedlejšími účinky.
Ve stadiu III je vhodné podat nějakou formu adjuvantní chemoterapie všem pacientům, kteří mají odpovídající předpokládané přežití a dobrou fyzickou kondici bez významnějších komorbidit. Účinnost adjuvantní chemoterapie je velmi vysoká a dokáže vyléčit přibližně 10–35 % dalších pacientů nad základní úroveň prognózy, která by nastala jen po operaci bez adjuvance (se samotnou operací bychom se pohybovali v pětiletém přežívání kolem 40–45 %). Pro odhad individuální prognózy pacienta je možné použít např. mobilní aplikaci ONCOassist. Základními léky pro adjuvantní léčbu jsou fluropyrimidiny, u rizikových pacientů doplněné o oxaliplatinu. Další přípravky cílené léčby (bevacizumab, cetuximab) nebo cytostatikum irinotekan sice testovány byly, avšak bohužel bez pozitivního účinku. Novinkou platnou od roku 2020 je poznatek, že nejsilnější možný adjuvantní režim XELOX je možné podat pacientům s nádory pT1-3N1M0 jako tříměsíční kúru (dříve jsme vždy léčili 6 měsíců). Jak se ukázalo nyní, pouze jsme u těchto nemocných zvyšovali toxicitu bez odpovídajícího zlepšení onkologických cílů léčby. Problém režimu XELOX je především výrazná periferní neuropatie po podání oxaliplatiny, která je trvalá až u 11 % osob a která způsobuje velké subjektivní obtíže a pokles celkové kvality života. Pro pokročilejší nádory III. stadia (pT1-4N2M0) však stále zůstává platné doporučení léčit 6 měsíců.
Ne zcela uspokojivě zodpovězenou otázkou je adjuvantní léčba karcinomu rekta. Zde obvykle extrapolujeme výsledky ze studií zařazujících pacienty s nádory tračníku, byť zřetelná klinická data nemáme.
Paliativní léčba
Metastatický KRK, který byl dříve chápán jako jedna jednotka, se nyní rozpadá na tři molekulárněbiologické typy odlišné chemosenzitivity a prognózy.
Nemocní s mutací genu BRAF mají velmi chemorezistentní nemoc. Průměrná doba trvání léčebných odpovědí je krátká, medián přežívání převyšuje jeden rok jen nepatrně. K chemoterapii druhé linie je indikováno méně než 40 % pacientů, a i ta po většinou rychle selhává.
Metastatický KRK bez BRAF mutace, ale s mutací genů KRAS nebo NRAS, tvoří intermediární prognostickou skupinu, u níž zabírá chemoterapie minimálně tří linií i léčba cílená proti VEGFR. Naproti tomu mutace KRAS a NRAS predikují neúčinnost EGFR inhibitorů, a proto se nepoužívají. Medián přežívání dosahuje kolem 25 měsíců.
Prognosticky nejpříznivější forma metastatického KRK je varianta, v níž všechny tři vyšetřované onkogeny nemají mutaci (BRAFwt, NRASwt, KRASwt). Podle klinické situace lze podávat chemoterapie třetí až čtvrté linie a cílenou léčbu proti EGFR. Medián přežití pacientů přesahuje 35 měsíců, počet léčebných odpovědí se pohybuje kolem 60 %.
Obecně, systémová léčba pro každý výše zmíněny typ byla ještě před přibližně pěti lety založena na podání kombinace chemoterapeutik 5-fluorouracil, leukovorin a oxaliplatina (režimy FOLFOX) nebo irinotekan (režim FOLFIRI). Podával se jeden režim, po jeho selhání druhý, na pořadí nezáleželo. Později se u osob bez mutací onkogenů BRAF, KRAS a NRAS začaly zařazovat k chemoterapii do první linie inhibitory EGFR panitumumab a cetuximab. Vývoj posledních let ukazuje, že klíčové pro získání delšího přežití pacientů s metastatickým KRK je právě časné nasazení inhibitorů EGFR již v první linii. V liniích pozdějších se totiž jejich efekt vytrácí.
Po selhání těchto režimů nebyl dlouhou dobu etablován režim třetí linie, který by měl odpovídající účinnost.
Zkušenosti s nástupem nových léků
Změna nastala v posledních letech poté, co byly publikovány výsledky dvou velkých randomizovaných studií s novými léky.
Regorafenib je nízkomolekulární orální inhibitor mnoha membránových tyrozinkináz. Ve studii CORRECT bylo 760 nemocných po selhání minimálně dvou linií léčby zařazeno k terapii regorafenibem nebo placebem. Medián přežití dosáhl statisticky signifikantního, klinicky však málo významného 6,4 měsíce pro nemocné aktivně léčené a 5,0 měsíce u nemocných na placebu. S ohledem na poměrně slabé efekty, toxicitu a omezenou dostupnost, není léčba tímto přípravkem rozšířena.
TS-102 neboli tiperacilin, firemně Lonsurf, je perorální derivát fluoropyrimidinu podávaný současně s inhibitorem thymidinfosforylázy tipiracilem. Tato kombinace se vyznačuje vyšší protinádorovou účinností. Ve studii RECOURSE byla podána léčba 800 pacientům po selhání konvenční léčby – dvě třetiny osob obdržely aktivní lék, třetina placebo. Léčbou bylo dosaženo statisticky významného prodloužení přežívání z 5,3 měsíce na 7,1 měsíce. Jak obecněji hodnotit tento mírný pokrok? Z křivky přežívání vyplývá, že velká část nemocných bohužel dále progreduje na nové léčbě, nicméně u menšího podílu pacientů dochází k dlouhotrvající stabilizaci nebo i léčebné odpovědi, a to při příznivém profilu toxicity. Setkáváme se tu s obecným problémem onkologie, totiž naší neschopností nalézt pomocí prediktivních faktorů ty nemocné, kteří budou na léčbu odpovídat dobře. Proto léčíme primárně všechny pacienty, a jen u malého podílu z nich nacházíme při restagingu nemoci benefit, který hovoří pro pokračování léčby.
O EGFR protilátkách jsem se již zmínil výše. Nepodat je způsobí u pacienta s BRAFwt NRASwt KRASwt nádorem zkrácení délky života o několik měsíců. Naproti tomu jsou v některých zemích včetně ČR upřednostňovány vysokomolekulární léky inhibující angiogenezi (bevacizumab a ramucirumab), které průkaz prodloužení přežívání oproti chemoterapii samotné nemají nebo ho mají jen marginální. Proto se v řadě států, např. ve Skandinávii, podávají jen výjimečně a ušetřené finanční prostředky se používají v oblastech, kde mohou dosáhnout hmatatelných efektů.
Koncept imunoterapie
Posledním a mnohem významnějším posunem než výše popsané podání dvou nových perorálních léků je u systémové nádorové nemoci koncept imunoterapie. Bylo zjištěno, že nemocní s mikrosatelitovou instabilitou (MSI) hromadí na membránách nádorových buněk neoantigeny, které mohou být účinně atakovány stimulovaným imunitním systémem. Ve studii Keynote 1647) byl podáván lék pembrolizumab, který inhibuje PD-L1 – receptor, receptor s inhibičními účinky na protinádorovou imunitu. Léčba probíhala u osob, jimž selhaly alespoň dvě linie chemoterapie a léčba biologická (kohorta A) nebo jen jedna chemoterapie (kohorta B) a jejichž nádor vykazoval MSI. Počet léčebných odpovědí dosáhl v obou skupinách 33 % a medián přežití (počítaný od dob randomizace) nebyl v kohortě B dosažen, v kohortě A činil (z pohledu paliativní medicíny) neuvěřitelných 31,4 měsíce. Nevýhodou zmíněného postupu je relativně nízký podíl pacientů s MSI na celé populaci pacientů s metastatickým KRK – jde asi o jednu pětinu, kteří jediní mají prospěch z nové terapie.
Nový koncept předoperační léčby u pacientů stadií II a III
Zaměříme-li se specificky na karcinom rekta, pak je třeba jako novinku zmínit nový koncept předoperační léčby u pacientů stadií II a III. Ten byl na řadě pracovišť v posledních dvou letech akceptován, ovšem aniž by mu předcházely důkladné klinické zkoušky konzistentně prokazující, že tento koncept má proti standardní léčbě prioritu. V čem panuje nejasnost?
Standardem byla zcela neoddiskutovatelně předoperační radioterapie, která trvala 5 týdnů, podávala se v 25 frakcích (1 dávka denně) a její účinnost se potencovala cytostatiky. Operace následovala po přibližně 6 týdnech, někdy následovaná adjuvantní chemoterapií.
Nový koncept vychází ze studií RAPIDO a PRODIGE23, které počítají s předoperační radioterapií i chemoterapií následovanou operací a adjuvantní chemoterapií podle potřeby. Ve studii RAPIDO byla podána pětidenní hypofrakcionovaná radioterapie a 18týdenní chemoterapie FOLFOX nebo XELOX s následnou operací a adjuvantní chemoterapií podle úvahy ošetřujícího lékaře nebo standardní pětitýdenní chemoradioterapie s operací a adjuvantní chemoterapií podle ošetřujícího lékaře. Na souboru 912 pacientů bylo pozorováno, že pravděpodobnost selhání léčby dosáhla ve 3 letech od randomizace ve skupině neoadjuvance signifikantně nižšího počtu 23,7 %; ve skupině konvenční činila 30 %. Také celkový podíl dosažených úplných patologických odpovědí v experimentální skupině byl zásadně vyšší než ve skupině se standardní léčbou (28 % vs. 14 %). Celkové přežití se mezi oběma skupinami nelišilo. Studie PRODIGE23 zařadila 461 pacienta v poměru 1 : 1 k podání pětitýdenní chemoradioterapie, operaci a adjuvantní léčbě nebo k tříměsíční chemoterapii, chemoradioterapii 5 týdnů, operaci a adjuvantní chemoterapii v trvání 3 měsíců.
Konzistentně se studií RAPIDO je zde pozorována vyšší četnost patologických kompletních odpovědí u experimentální léčby (27,5 % vs. 11,7 %) i vyšší podíl pacientů bez recidivy nádoru (75,7 % vs. 68,5 %), vše beze změny v přežívání nemocných. Dosažené pozitivní výsledky však mohou být zkresleny nesprávným designem studií, zejména tím, že k adjuvantní léčbě bylo přistupováno ad hoc a podstoupilo ji ve studii RAPIDO jen 46 % pacientů ve standardní větvi, přičemž ve standardním schématu by měli být léčeni všichni nemocní. Ve studii druhé byla též dysbalance ve smyslu vyššího podílu adjuvantně léčených pacientů v experimentální větvi. Tedy, přímý vliv nové strategie na léčebné výsledky je otazný, koncept neoadjuvance lze v běžné praxi provádět, na druhou stranou postupovat stále klasicky je též ospravedlnitelné.
Literatura u autora

doc. MUDr. Jan Novotný, Ph.D.
Institut klinické a experimentální medicíny, Praha
