Vědci se o mikroorganizmy žijící v úzkém kontaktu s člověkem zajímají již dlouhá desetiletí. Nicméně lidský mikrobiom se v posledních letech dostává do povědomí i laické veřejnosti. Z médií se stále častěji dozvídáme, že je důležité uchovávat jej zdravý a příslušně o něj pečovat. V tomto článku se pokoušíme přiblížit, proč je to tak zásadní, a popsat základní spojitost mezi lidským mikrobiomem a imunitním systémem. Z hlediska probíhající pandemie jde ostatně o velice aktuální téma.
V poslední době se stále více objevují důkazy o tom, že mikroorganizmy osídlující lidské tělo mají velice významný vliv na fyziologii a chování člověka. Je třeba si uvědomit, že všechny epitelové povrchy kůže a sliznic lidského těla jsou osídleny komenzálními mikroorganizmy, mezi které patří široká škála bakterií, virů, plísní, kvasinek a prvoků. Celkový počet těchto mikroorganizmů mírně převyšuje počet všech buněk lidského těla, a není tedy překvapivé, že v životě člověka hrají tak důležitou roli. Kromě toho, že nám pomáhají s trávením, nás chrání před patogeny, syntetizují různé vitaminy a jsou také velice důležité pro náš imunitní systém. Dříve se pojem „mikrobiota“ používal k popisu společenství mikroorganizmů v určitém prostředí a „mikrobiom“ jako soubor jejich genů. Dnes jsou však tyto pojmy chápány spíše jako synonyma. Změna přirozené mikrobioty v patologickou je pak popisována jako „dysbióza“. Ta se projevuje rozkvětem patobiontů, tj. komenzálních mikrobů s potenciálem stát se patogeny, ztrátou či snížením komenzálů či snížením bohatosti mikrobiálního zastoupení, tzv. diverzity. Vztah mikrobiomu a imunitního systému je symbiotický. Zatímco komenzálové „trénují“ imunitní systém a podporují regulační mechanizmy udržující systémovou i slizniční imunitu v rovnováze, imunitní systém podporuje, chrání a uchovává mikrobiom. Udržování tohoto dialogu umožňuje obranu proti patogenům a zároveň toleranci neškodných antigenů, což vyžaduje komplexní souhru mikrobů s vrozenou i adaptivní složkou imunitního systému (obrázek 1).
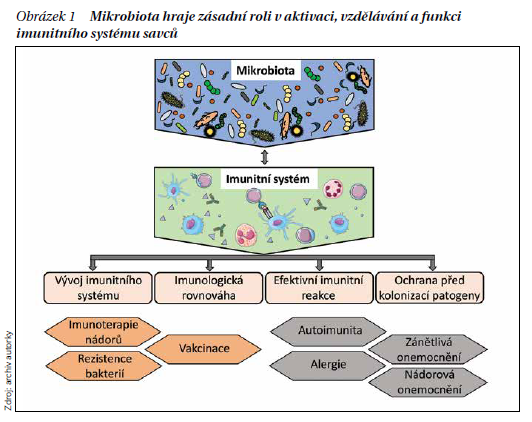
Obrázek 1 Mikrobiota hraje zásadní roli v aktivaci, vzdělávání a funkci imunitního systému savců. Mezi imunitním systémem hostitele a komenzální mikrobiotou existuje symbiotický vztah. Mikrobiota má vliv na vývoj imunitních systémů, udržuje imunologickou rovnováhu a toleranci k vlastním strukturám, umožňuje efektivní imunitní reakci proti patogenům a brání jejich kolonizaci. Komenzální mikroby hrají zásadní roli jak v tréninku imunitního systému, tak v jeho funkční aktivaci, kterou působí jako adjuvans imunitního systému jako celku. Narušení vzájemného vztahu mikrobioty a imunitního systému hostitele vede k vývoji chronických zánětlivých poruch, alergie, metabolickému syndromu, autoimunitních i nádorových onemocnění. Naopak, selektivní modulace mikrobioty představuje obrovský terapeutický potenciál pro posílení imunoterapie nádorů, vakcinace a pro léčbu onemocnění způsobených mikroby rezistentními na antibiotika.
Vývoj imunitního systému
Mikrobiální kolonizace tělních povrchů hraje velice významnou roli ve vyzrávání imunitního systému. Existuje několik důležitých faktorů rozhodujících o tom, jakými mikroby je novorozenec v časných fázích svého života kolonizován (obrázek 2). Mezi nejdůležitější patří způsob porodu či zda je dítě kojené nebo krmené umělou výživou. Zdá se, že u dětí narozených císařským řezem dochází k opožděnému vyzrávání imunitního systému, a to především s ohledem na rovnovážné nastavení vztahu mezi imunitním systémem a mikrobiotou, což může později vést k rozvoji alergií a různých zánětlivých onemocnění. Některé práce dokonce popisují přítomnost konkrétních bakterií již v placentě. To by znamenalo, že vyvíjející se plod je antigenně stimulován již před porodem. Imunita tak má možnost připravit se na explozivní kolonizaci, která se odehrává hned po porodu. Nicméně, zda se toto skutečně děje, ještě není věcí konsenzu.
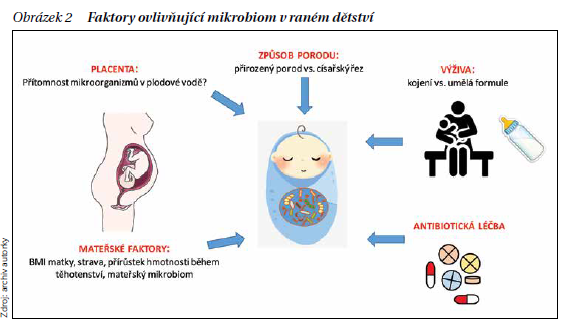
Nejvýznamnějším obdobím je potom první rok života, kdy je lidský mikrobiom velice variabilní, a imunita se tak setkává s množstvím antigenních struktur. Díky tomu se vytváří imunoregulační síť, zabraňující reagovat nepřiměřeně na neškodné látky, se kterými se člověk během svého života setkává. Význam vztahu mikrobiomu a hostitelského organizmu je velice dobře patrný u bezmikrobních zvířecích modelů, kde absence mikrobioty vede k různým odchylkám v uspořádání lymfoidní tkáně a k narušení imunitních reakcí. Mimo jiné je ve střevě těchto zvířat snížená produkce protilátek třídy IgA a také nejsou přítomny velmi důležité imunoregulační Th17 lymfocyty. Kolonizace potom vede k částečné nápravě fungování imunitních mechanizmů.
Pro vztah mezi imunitním systémem a mikrobiomem je tedy zásadně důležité období časného vývoje člověka, přičemž narušení tohoto vzájemného působení může mít dlouhodobý vliv na naše obranné reakce.
Přirozená imunita a mikrobiom
Zdaleka největší množství mikroorganizmů se vyskytuje v gastrointestinálním traktu, kde se popisuje koncentrace až 1012 bakterií v gramu obsahu tlustého střeva. Tyto bakterie jsou odděleny od ostatních tkání jednovrstevným epitelem, který je pokrytý vrstvou mukusu, který netvoří jen mechanickou bariéru, ale také obsahuje látky navozující imunitní toleranci vůči neškodným mikroorganizmům. Na druhou stranu sliznice dokáží velice rychle zareagovat na mikroorganizmy patogenní, což je zprostředkováno obousměrnou komunikací mezi mikrobiotou a přirozenou imunitou.
Základními mechanizmy této komunikace na úrovni přirozené imunity jsou antimikrobiální peptidy produkované především Panethovými buňkami v tenkém střevě, které mají výrazný vliv na složení mikrobiomu. Dalším důležitým faktorem jsou tzv. receptory rozpoznávající molekulární vzory (pattern recognition receptors), které byly původně popisované jako receptory selektivně rozpoznávající molekuly patogenních mikroorganizmů. Postupně se však ukázalo, že záběr těchto receptorů je širší. Jejich význam tkví nejen v obraně proti patogenům, ale také v regulaci zastoupení jednotlivých mikroorganizmů v mikrobiomu. Do této skupiny receptorů patří například Toll-like a NOD-like receptory.
Některé receptory přirozené imunity se shlukují do multiproteinových komplexů a vytvářejí v různých buněčných typech takzvané inflamazomy. Z hlediska regulace složení mikrobiomu je důležitý inflamazom NLRP6, který reguluje složení mikrobiomu a udržuje rovnováhu na sliznicích střeva aktivací prozánětlivých cytokinů. Kromě toho se také účastní antivirové ochrany ve střevě.
A konečně velice heterogenní skupina relativně nedávno objevených buněk nazvaných přirozené lymfoidní buňky (ILC), nacházejících se v respiračním a gastrointestinálním traktu, kůži a periferní krvi, se také podílí na vzájemné komunikaci mezi mikrobiomem a přirozenou imunitou. Tyto buňky postrádající antigenní receptory, svůj fenotyp přizpůsobují v závislosti na signálech získaných od mikrobioty. Zároveň jsou schopny velice rychle reagovat na přítomnost patogenního mikroorganizmu produkcí prozánětlivých cytokinů a následně cytokinů podílejících se na obnově tkání.
Adaptivní imunita a mikrobiom
Vedle přirozené imunity má velice významnou roli také vzájemná komunikace mezi mikrobiomem a adaptivní imunitou. Imunoglobulin A sekrečního typu (sIgA), produkovaný B lymfocyty a plazmocyty v submukózních vrstvách, je jeden z nejvýznamnějších humorálních faktorů chránících sliznice. Zároveň platí, že čím bohatší je spektrum sIgA, tím diverzifikovanější a stabilnější je složení mikrobiomu. To umožňuje expanzi FoxP3+ regulačních T buněk, napomáhajících udržení homeostázy na sliznicích. Produkce sIgA je na sliznicích regulována folikulárními pomocnými T lymfocyty (Tfh), přičemž pokud je tento mechanizmus narušen, dochází je snížení diverzity střevního mikrobiomu.
V posledních letech získáváme stále více informací o CD4+ T buňkách ve vztahu ke střevní mikrobiotě. U bezmikrobních myší nejsou tyto buňky ve střevě diferencované kvůli nepřítomnosti bakterií fermentujících vlákninu za vzniku mastných kyselin s krátkým řetězcem (short-chain fatty acids – SCFAs). Tyto SCFAs jsou významnými zdroji výživy pro buňky tlustého střeva. Schopnost reagovat na přítomnost mikrobioty na sliznicích vytvářením širokého spektra imunitních buněk je velice důležité z hlediska efektivní imunitní odpovědi namířené proti patogenním mikroorganizmům. Konkrétně Th17 buňky, produkující prozánětlivý cytokin IL-17, jsou v tomto směru intenzivně studovány proto, že hrají významnou roli v eliminaci škodlivých mikroorganizmů, ale zároveň se účastní patogeneze řady zánětlivých onemocnění, jako je lupénka, revmatoidní artritida, roztroušená skleróza, astma či nespecifické střevní záněty. Zajímavé je, že velice záleží na tom, proti kterému mikroorganizmu je reakce Th17 buněk namířena. Zatímco některé (jako například Citrobacter rhodentium, Escherichia coli O157) vyvolají v těchto buňkách produkci řady prozánětlivých cytokinů, u jiných (podle jedné studie například u segmentovaných filamentózních bakterií) k tomu nedochází.
Mikrobiální metabolity působící na imunitní systém
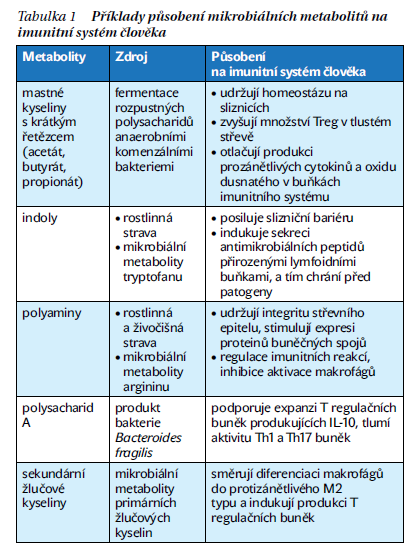
Mikroorganizmy jsou zdrojem velkého množství metabolitů důležitých pro lidské zdraví (tabulka 1). Patří mezi ně produkty fermentace polysacharidů a bílkovin, tvorba vitaminů, neurotransmiterů a také tvorba sekundárních žlučových kyselin. Jak již bylo zmíněno, zdaleka největší množství bakterií se vyskytuje na sliznicích gastrointestinálního traktu. Jedná se přibližně o 1 000 druhů patřících do šesti hlavních kmenů, z nichž dominují kmeny Firmicutes a Bacteroidetes.
Vliv stravy
Velice významný vliv na mikrobiální diverzitu, a tedy i na imunitní systém má strava. Existuje velmi výrazný rozdíl v mikrobiomu lidí stravujících se tzv. západním typem stravy bohatým na jednoduché cukry a živočišné tuky ve srovnání s lidmi živícími se středomořskou stravou, která se vyznačuje velkou rozmanitostí a vysokým obsahem vlákniny. Právě vláknina je důležitým zdrojem mastných kyselin s krátkým řetězcem, což jsou produkty mikrobiální fermentace v tlustém střevě. Ty jsou důležitým zdrojem energie pro různé lidské buňky, jako jsou enterocyty a hepatocyty, ale také podporují bariérovou funkci střeva. V neposlední řadě mají rovněž imunomodulační a protinádorové účinky. Mimo jiné zvyšují počet regulačních T lymfocytů ve střevě a tím pomáhají udržovat slizniční toleranci.
Indoly
Dalšími důležitými mikrobiálními metabolity z hlediska imunity jsou produkty metabolizmu aminokyselin tryptofanu a argininu – indoly, respektive polyaminy. Indoly zabraňují množení a potlačují invazivní vlastnosti některých patogenů. Kromě toho působí velice pozitivně na bariérovou funkci střeva podporou tvorby mucinové vrstvy. Celkově mají ve střevě protizánětlivé účinky. Vysoce reaktivní polyaminy také působí jak na buňky střevního epitelu, tak na buňky přirozené imunity, ve kterých selektivně inhibují lipopolysacharidem indukovanou produkci prozánětlivých cytokinů.
Primární a sekundární žlučové kyseliny
Mikroorganizmy v našem střevě sice netráví přímo tuky, nicméně především v tlustém střevě dochází k přeměně primárních žlučových kyselin, které nebyly zpětně resorbovány střevním epitelem, na sekundární žlučové kyseliny. Primární i sekundární žlučové kyseliny jsou rozpoznávány stejnými receptory přítomnými na buňkách přirozené imunity (monocytech, makrofázích a dendritických buňkách) a působí protizánětlivě. Nicméně při nerovnováze střevního mikrobiomu, například v důsledku nadměrného požívání tuků v potravě, může dojít k narušení imunitních regulačních mechanizmů. Tento stav bývá spojován s vývojem nespecifických střevních zánětů.
Trimetylamin
Dalším příkladem mikrobiálního produktu, který bývá spojován s patologickými stavy, je molekula trimetylaminu (TMA). Ta vzniká mikrobiální přeměnou karnitinu a cholinu, které konzumujeme společně se živočišnými proteiny. TMA je v játrech oxidován na trimetylaminoxid (TMAO), jehož zvýšené množství v krvi je spojováno s vývojem aterosklerózy a obezity.
Jakým způsobem působí mikrobiální metabolity na buňky (nejen) imunitního systému, je v poslední době předmětem intenzivního zájmu vědců a další roky budou bezesporu přinášet množství nových poznatků.
Mikrobiální dysbióza a její důsledky
V naší rozvinuté společnosti došlo v posledních desetiletích k výrazné změně životního stylu. Lidé změnili své stravovací návyky, zvýšilo se zastoupení jednoduchých cukrů a živočišných tuků v potravě a konzumují se průmyslově zpracované potraviny s množstvím stabilizátorů, konzervantů a umělých barviv.
Dalšími výraznými faktory jsou znečištění, nedostatečná spánková hygiena či fyzická aktivita, nadužívání léků a stres. Všechny tyto vlivy působí i na lidský mikrobiom a mohou vést k dysbióze, tedy stavu, kdy dochází ke změnám ve složení a funkci mikrobioty a k narušení rovnovážného stavu s hostitelem.
Souběžně se změnou životního stylu došlo k enormnímu zvýšení výskytu množství multifaktoriálních onemocnění, jako jsou různé autoimunitní, metabolické, zánětlivé či neurodegenerativní poruchy. Poslední dobou přibývá stále více důkazů o tom, že jedním z výrazných faktorů přispívajících k rozvoji těchto onemocnění je právě dysbióza střevní mikrobioty.
Z hlediska udržení homeostázy na sliznicích je zásadně důležitý „rozhovor“ mezi střevním mikrobiomem a imunitním systémem. Jak již bylo popsáno, přirozená a adaptivní imunita rozpoznávají mikrobiální složky a na základě správného rozpoznání dochází k příslušné imunitní reakci. V případě, že dojde k narušení této komunikace, může dojít k ovlivnění imunitní odpovědi, jejímž výsledkem je naopak udržování dysbiotického stavu střevní mikrobioty. Toto udržování je mimo jiné dáno tím, že v zánětlivém prostředí se více daří patobiontům, kteří dále přispívají k zachování zánětlivého prostředí vhodného pro jejich množení. Z různých studií také vyplývá, že přenosem dysbiotické mikrobioty z jednoho hostitele na druhého dochází k pozměnění imunitní odpovědi vedoucí k modulaci signalizace přes inflamazom, Toll-like receptory a také k degradaci sekrečního IgA. Tyto mechanizmy vedou ke stabilizaci dysbiotického nastavení na sliznicích.
Příkladem konkrétních onemocnění s výrazným vlivem střevního mikrobiomu jsou například nespecifické střevní záněty, celiakie, revmatoidní artritida, diabetes 1. typu, astma a roztroušená skleróza. U všech těchto onemocnění však není jasné, zda hraje pozměněné složení mikrobioty roli spouštěče onemocnění nebo je jejím důsledkem. Každopádně fenotyp těchto onemocnění je obvykle možné v myších modelech přenést pomocí fekální mikrobioty.
Možnosti manipulace mikrobiomu
Vzhledem k nastíněné souvislosti mezi různými onemocněními a dysbiózou střevního mikrobiomu existuje intenzivní snaha o nalezení možných terapeutických mechanizmů, které by dokázaly střevní mikrobiotu vrátit zpět do „zdravého“ stavu. V klinické praxi se již používá přenos fekální mikrobioty od zdravých dárců v případě recidivující kolitidy způsobené bakterií Clostridium difficile, který se ukázal být velice efektivní v léčbě tohoto onemocnění. V případě tohoto přenosu pacientům trpícím nespecifickými střevními záněty nebo kolorektálním karcinomem však takto nadějné výsledky zatím pozorovány nejsou, což může být způsobeno velkou komplexností těchto onemocnění.
Probiotika
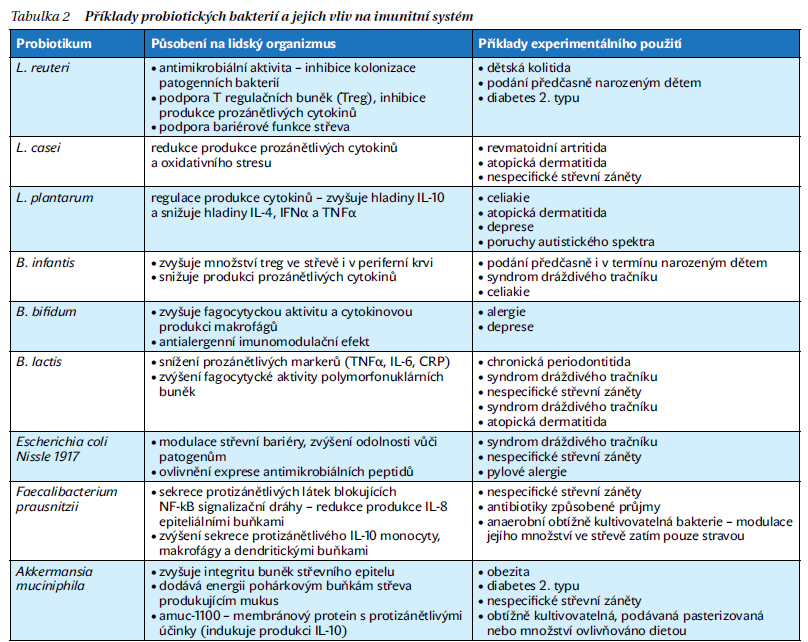
Další možností manipulace střevní mikrobioty je podání probiotik, tedy živých bakterií, které pokud jsou podané v dostatečném množství, vykazují zdraví prospěšné účinky. Takovými probiotiky jsou například bakteriální rody Lactobacillus a Bifidobacterium. Ačkoli je množství podávaných probiotických kultur v porovnání se střevní mikrobiotou velice malé, mohou i tak působit na složení mikrobiomu například prostou kompeticí o místo a živiny a také produkcí různých látek, jako jsou baktericiny (tabulka 2).
Prebiotika
Kromě změny složení mikrobioty probiotiky lze měnit střevní prostředí pomocí nutričních změn, a to podáním prebiotik nebo stravou jako takovou. Prebiotika jsou látky, které podporují množení zdraví prospěšných bakterií (např. inulin, oligofruktóza) a mohou být podávány společně s probiotickými bakteriemi, kdy potom hovoříme o synbiotikách. Velice významný důraz je v poslední době kladen na možný vliv probiotik a prebiotik na imunomodulační a protizánětlivé účinky.
Vliv stravy
Nejdůležitějším faktorem formujícím složení našeho střevního mikrobiomu v dospělosti je strava. Prospěšnost fermentovaných potravin (kvašená zelenina, kysané mléčné výrobky apod.) přirozeně obsahujících probiotické bakterie je prokázána v mnoha studiích, stejně jako význam konzumace vlákniny, která tvoří substrát umožňující růst například bakteriím produkujícím mastné kyseliny s krátkým řetězcem. Vzhledem k rychlé a reprodukovatelné schopnosti mikrobioty reagovat na dietní intervenci se v terapii různých (např. metabolických) onemocnění uvažuje o personalizovaných dietách.
Závěr
Dříve se chápání vztahu mikrobioty a imunitního systému omezovalo především na mechanizmus tolerování komenzálních mikroorganizmů a naopak vytvoření obranné reakce proti patogenům. V současné době chápeme, že vzájemná interakce mezi mikrobiomem a imunitou je výrazně komplikovanější a že narušení tohoto vztahu může vést k nerovnováze a k rozvoji různých patologických stavů. V současné době existuje množství studií ukazujících, že složení mikrobiomu a hlavně jeho funkční kapacita jsou z hlediska lidského zdraví velice důležité a že zdravá strava, stejně jako dostatek fyzické aktivity a spánku přispívají ke zdraví lidského těla jako celku, tedy i ke zdravé mikrobiotě.
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. NU20-04-00088.
RNDr. Radka Roubalová, Ph.D.
RNDr. Petra Procházková, Ph.D.
Laboratoř buněčné a molekulární imunologie, Mikrobiologický ústav AV ČR, v.v.i.
