Tématem 2. části virtuální Cardio Academy Sanofi (20. dubna 2022) bylo reziduální kardiovaskulární riziko. Příspěvky tří odborníků, tentokrát z Centra preventivní kardiologie 3. interní kliniky 1. LF UK a VFN v Praze, byly zaměřeny na lipidové příčiny přetrvávajícího rizika cévní příhody, způsoby dosahování cílových hodnot LDL cholesterolu (LDL-C) a intervence dalších zdrojů lipidového reziduálního rizika. Předsedajícím sympozia byl prof. MUDr. Michal Vrablík, Ph.D.
Jak vyplývá z recentních evropských statistik, Česká republika přes veškeré nesporné úspěchy na poli kardiovaskulární (KV) prevence a léčby zůstává na nelichotivých předních příčkách co se týče KV morbidity i mortality. Webinář se věnoval možnostem přístupu k managamentu dyslipidemie v každodenní praxi tak, aby došlo k požadovanému snížení přetrvávajícího vysokého KV rizika u pacientů s tímto problémem.
Méně časté příčiny trvajícího rizika cévní příhody
Definice reziduálního KV rizika není jednotná. Připomenul to v úvodu sympozia prof. Vrablík, který se ujal prvního příspěvku. Mezinárodní iniciativa pro zjišťování a snížení reziduálního rizika (R3i) jej definovala jako riziko aterosklerotických cévních příhod u osob, které jsou již léčeny hypolipidemiky a u nichž je koncentrace LDL-C – primární léčebný cíl – stlačena k požadované cílové hodnotě. Šířeji lze podle prof. Vrablíka pojímat kardiovaskulární reziduální riziko (RR) tak, že se skrývá v ostatních oblastech důležitých pro rozvoj aterotrombotického cévního postižení. Z tohoto pohledu lze hovořit o (a) lipidovém (cholesterolovém) RR skrývajícím se v nedostatečné supresi LDL-C, (b) zánětlivém RR odrážejícím elevaci zánětlivých parametrů, jako je hsCRP, a (c) trombotickém RR spočívajícím ve zvýšené aktivitě krevních destiček.
Problematikou ovlivnění RR aterosklerotických cévních příhod se zabývá přehledný článek Lawiera a kol., publikovaný v roce 2021 v European Heart Journal. Uvedená práce definovala hlavní oblasti, v nichž se toto RR skrývá, přičemž tři z těchto oblastí spadají do sféry dyslipidemie a managementu poruch lipidového metabolizmu (obrázek 1). Na prvním místě jde o nedostatečné dosahování cílové hodnoty LDL-C. Další RR se skrývá v metabolizmu částic bohatých na triglyceridy. Kromě toho nabývá v poslední době na důležitosti i RR spojené s elevací lipoproteinu (a) (Lp(a)) – mimo jiné i proto, že se očekává brzký vstup nových terapií ovlivňujících toto riziko na trh.
Obrázek 1 Zdroje reziduálního rizika ASKVO a možnosti jeho ovlivnění (podle Lawler et al. Targeting cardiovascular inflammation: next steps in clinical translation. Eur Heart J 2021; 42(1): 113–131.)
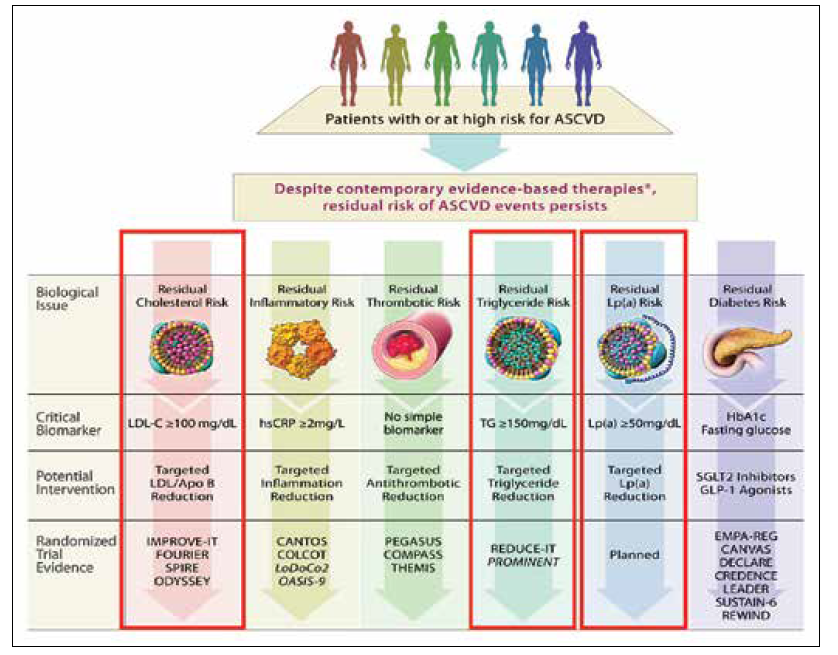
Prof. Vrablík dále uvedl, že s nárůstem rizika aterosklerotických cévních změn jsou spojeny všechny lipidové částice schopné dodávat cholesterol pro růst ateromu. Zajímavostí je i to, že i HDL cholesterol (HDL-C), dlouho považovaný za antiaterogenní agens, se rovněž může podílet na růstu ateromu. Dalším důležitým poznatkem je skutečnost, že aterogenicita krevních lipoproteinů je velmi proměnlivá a často odráží postprandiální stav. Osoby se zvýšenou koncentrací triglyceridů jsou pak ohroženy kumulací tzv. remnantních lipoproteinových částic (RLP), čili vysoce aterogenních lipoproteinů akcelerujících vznik cévních lézí. Aterogenní riziko je zde přitom vyšší než riziko spojené s LDL-C. Přímé stanovení koncentrace těchto remnantních částic je však obtížné a neumožňuje zavedení do klinické praxe.
Naopak zmíněný HDL-C, tradičně užívaný jako biomarker lipidového rizika, je měřitelný snadno. Rozhodně ale již neplatí, že jeho vysoké koncentrace jsou protektivní z hlediska aterosklerózy a jejích komplikací. Zvýšené riziko celkové mortality a KV příhod je vyšší jak u jedinců s nízkým HDL-C, tak u osob s vysokými hodnotami HDL-C. Za optimální se považují koncentrace 1,4–1,8 mmol/l, zatímco při hodnotách nad 2 mmol/l již celková mortalita a riziko cévních příhod narůstají. Vyšší hodnoty HDL-C jsou tedy důležitou komponentou reziduálního KV rizika, v současnosti však nemáme farmakologické možnosti prostřednictvím modifikace HDL cholesterolemie ovlivnit cévní riziko, vysvětlil prof. Vrablík.
Pozornost se v současnosti zaměřuje také na oblast lipoproteinu (a). Tato částice nemá jednoznačně určenou fyziologickou funkci, spekuluje se o její protiinfekční ochraně. Nárůst koncentrace Lp(a) je ovšem spojen s rizikem ischemické choroby srdeční (ICHS) a dalších aterotrombotických cévních příhod. Velmi vysoké koncentrace (nad 180 mg/dl) jsou pak z hlediska rizika rozvoje cévních příhod ekvivalentem heterozygotní familiární hypercholesterolemie. Doporučené postupy z roku 2019 uvádějí, že je vhodné alespoň jednou v životě hodnotu Lp(a) stanovit u každého a v případě zjištěné vysoké hodnoty zahájit patřičné intervence. Evidenci o vztahu Lp(a) a výskytu KV příhod, vycházející z epidemiologických dat, by měla přibližně za 3 roky přinést probíhající intervenční studie testující efekt nového léku snižujícího Lp(a).
Příčinou přetrvávajícího RR může být i nesprávná léčebná strategie. Data z genetických studií ukazují, že jedinci s optimálními hodnotami LDL-C a systolického krevního tlaku mají významně lepší prognózu než osoby s nepříznivými, a dokonce i normálními parametry. U osob s LDL-C nižším o 1 mmol/l a TK o 10 mm Hg, než je referenční rozmezí, je riziko ICHS o 80 % nižší! Důvodem je, že osoby s takto příznivým genetickým profilem žijí v tomto příznivém KV rizikovém prostředí desítky let, zatímco běžně se intervence zahajují po 50.–60. roce věku. RR se tak může skrývat i v pozdním načasování léčebné intervence. Preventivní léčebné strategie je tedy podle prof. Vrablíka vhodné zahajovat mnohem dříve a režimová opatření se doporučuje implementovat již v dětském věku.
Cílových hodnot lipidů se stále nedaří dosahovat. Již v dřívější studii Da Vinci se ukázalo, že česká kohorta léčená po infarktu myokardu dosahovala cílové hodnoty LDL-C pouze ve 14 % případů. Na vině jsou zčásti samotní lékaři. Data z registru PINNACLE ukazují, že třetina pacientů s aterosklerotickým KV onemocněním (ASKVO) nedostávala navzdory doporučením léčbu statiny a u dvou třetin pacientů, kteří nedosáhli cílových hodnot LDL-C, nebyla léčba intenzifikována.
Vedle této „terapeutické inerce“ se na nepříznivé situaci podílí také špatná adherence pacientů k léčbě. Překonávat ji lze například pomocí fixních kombinací léčiv, lepší komunikací s lékařem, ale i jejím sledováním a zaznamenáváním do lékařské dokumentace. Jak zdůraznil prof. Vrablík, je třeba si uvědomit, že non adherence zvyšuje cévní riziko a může být fatální.
Lze tedy shrnout, že kontrola dyslipidemie u nás není dostatečná. Příčin je více a je zde prostor pro zlepšení. Další informace o problematice lze nalézt například na stránkách České společnosti pro aterosklerózu (www.athero.cz).
Dosažení cílové hodnoty LDL-C je nejdůležitější
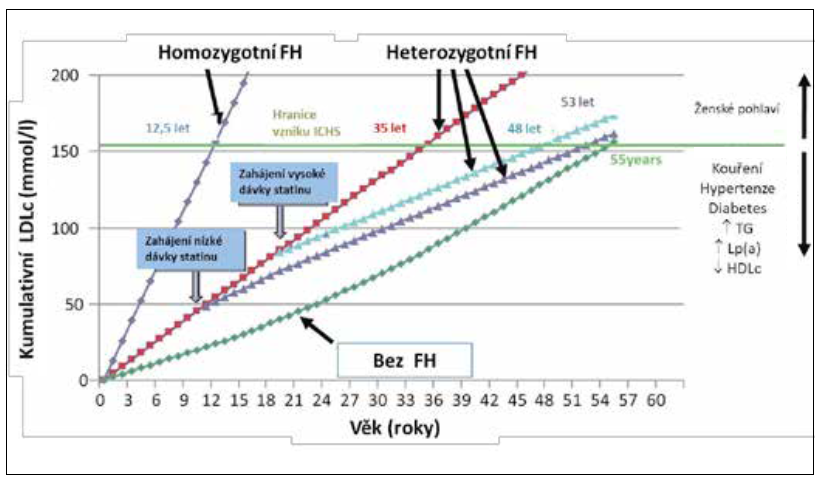
O tom, že cílových hodnot LDL-C dosáhnout lze, hovořila v dalším příspěvku MUDr. Tereza Altschmiedová. LDL-C je vnímán v poslední době jako klíčový kauzální faktor rozvoje aterosklerózy. Obrázek 2 znázorňuje průběh aterosklerotického procesu a kumulativní zátěž LDL cholesterolem. Je prokázáno, že k manifestaci aterosklerotické komplikace dochází typicky při kumulativní expozici LDL-C ve výši 150 mmol/l. Obvykle toto nastává kolem 55. roku věku, nicméně pacient, který má vyšší LDL-C již v mladším věku, dosáhne této koncentrace dříve. Včas zahájená a správně vedená léčba riziko aterosklerotické komplikace oddálí.
Obrázek 2 Kumulativní zátěž LDL cholesterolem (podle Nordestgaard BG, Chapman MJ, Humphries SE et al. Familial Hypercholesterolaemia is Underdiagnosed and Undertreated in the General Population: Guidance for Clinicians to Prevent Coronary Heart Disease: Consensus Statement of the European Atherosclerosis Society. Eur Heart J. 2013;34(45):3478–3490.)
Metaanalýza Ference et al. z roku 2017, která analyzovala asi 200 studií s 2 miliony účastníků, potvrdila, že nižší LDL-C je spojen s nižším KV rizikem. Platí přitom pravidlo „čím níže, tím lépe“. Potvrdily to rovněž studie CTT, IMPROVE-IT, FOURIER a ODDYSSEY-OUTCOME. Na podkladě těchto studií došlo ke změně doporučených cílových hodnot LDL-C. Doporučení EAS/ASC pro léčbu dyslipidemie z roku 2019 stanovují cílové hladiny podle KV rizika: pod 3 mmol/l u nízkorizikových pacientů a pod 1,4 mmol/l u vysoce rizikových pacientů.
Hypolipidemická strategie zahrnuje vícero léčebných možností. Základem zůstávají statiny. Ty snižují LDL-C v průměru o 25–50 %, přičemž jako nejúčinnější se v tomto ohledu ukazují rosuvastatin a atorvastatin. Pro dosažení cílových hodnot LDL-C je vedle volby účinnějších statinů třeba využít také co nejvyšší dávkování. Efekt intenzivní hypolipidemické léčby prokázaly například studie REVERSAL a ASTEROID, které současně potvrdily bezpečnost této intenzifikace ve srovnání s nízkými dávkami statinů. Při nedosahování cílových hodnot je možno přistoupit ke kombinované léčbě (přidání ezetimibu, případně PCSK9 inhibitorů). PCSK9 inhibitory jsou coby cílená léčba dostupné v centrech a vyhrazené pacientům v sekundární prevenci ASKVO a pacientům s familiární hypercholesterolemií splňujícím indikační kritéria (pacienti nedosáhli na maximální tolerované dávce statinu + ezetimibu stanovených cílových hodnot).
MUDr. Altschmiedová prezentovala také recentní data z reálné praxe z vlastního pracoviště. Do studie bylo zařazeno 201 pacientů, kteří užívali PCSK9 inhibitory. Efekt léčby byl v době sledování stálý, nejrizikovější pacienti v sekundární prevenci v průměru dosahovali cílových hodnot LDL-C. Ukázalo se také, že pacienti léčení maximální dávkou statinu měli pokles LDL-C větší než pacienti, kteří statin neužívali. Pacientům se proto doporučuje i v případě intolerance statinu podávat alespoň jeho minimální dávku. Nejrizikovější pacienti dosahovali v této studii nejpřísnějších hodnot LDL-C pod 1,4 mmol/l v 66 %. Po 1 roce léčby mělo LDL-C nad 3 mmol/l pouze 18 z nich (9 %).
Další zdroje lipidového reziduálního rizika
Možnostem intervence zdrojů reziduálního rizika se v posledním příspěvku věnoval MUDr. Martin Šatný. Připomeňme, že tyto zdroje zahrnují výše zmíněnou problematiku nedosažení cílových hodnot LDL-C, přítomnost remnantních lipoproteinů, aterogenní dyslipidemii a roli Lp(a).
Jak přednášející uvedl, základem intervence jsou režimová opatření. Patří sem zdravá výživa, pohybová aktivita, nekuřáctví, omezení konzumace alkoholu a BMI pod 25. Data z amerického průzkumu z roku 2006 sledujícího přes 50 tisíc respondentů léčených pro dyslipidemii ukázala, že u těch, kteří dodržovali doporučená režimová opatření, došlo k redukci rizika ICHS o 78 % oproti těm, kteří je nedodržovali. Režimová opatření pozitivně ovlivňují tělesnou hmotnost, krevní tlak a vedou ke kvantitativním i kvalitativním změnám lipidového spektra.
Reziduální lipidové riziko lze dále ovlivnit farmakologicky. Zde přednášející doplnil stávající spektrum léčby o možnost využití nutraceutik, a sice u jedinců s nízkým KV rizikem nebo u pacientů netolerujících či odmítajících farmakoterapii. Z účinných nutraceutik lze zmínit například rostlinné steroly snižující vstřebávání cholesterolu ve střevě. Nejvýznamnějším nutraceutikem je patrně fermentovaná červená rýže s obsahem monakolinu, jehož struktura je podobná lovastatinu. Komplexní účinek vykazují i berberin či omega 3 mastné kyseliny.
Významného snížení LDL-C u pacientů, kteří na předchozí hypolipidemické terapii nedosáhli cílových hodnot, lze dosáhnout pomocí alirokumabu ze skupiny inhibitorů PCSK9. Data potvrdila u 94,6 % pacientů léčených tímto lékem dosažení LDL-C pod 1,4 mmol/l. Slibná data jsou rovněž ze studie ORION s inklisiranem. Jedná se o první siRNA molekulu, u níž byl zaznamenán 50% pokles LDL-C u pacientů již léčených hypolipidemiky.
U pacientů s familiární hypercholesterolemií, kteří nedosahují cílových hodnot, lze ke stávající léčbě přidat lomitapid. Jde o inhibitor mikrosomálního triglyceridového transportujícího proteinu (MTTP). Ve studiích byl pozorován aditivní pokles TG a LDL-C o 50 %.
Management lipidového RR, jak připomenul MUDr. Šatný, ovšem není jen o ovlivnění LDL-C. Snahou odborníků je zacílit i na remnantní lipidové částice.
Studie ACCORD-LIPID, která sledovala efekt fenofibrátu přidaného k simvastatinu u pacientů s diabetes mellitus 2. typu ukázala, že tato léčba snižuje RR o 29 % a významně ovlivňuje též postprandiální lipemii. PPAR alfa agonisté, mezi něž patří fenofibrát, navíc mění kvalitu LDL částic, které se tak posunují do spektra méně denzních (méně aterogenních) lipidových částic.
K novým či experimentálním možnostem léčby dyslipidemie lze řadit pemafibrát, jehož slibný efekt se odvozuje z pilotní studie PROMINENT. U těžké smíšené dyslipidemie je pak možné u pacientů nedosahujících léčebných cílů využít evinakumab – monoklonální protilátku proti angiopoetin like proteinu (ANGPTL3).
Testována je také antisense terapie s využitím antisense oligonukleotidů. V Evropě je již registrován volanesorsenem, jehož efekt byl potvrzen u pacientů s familiární hyperchylomikronemií. Další možností ovlivnění LDL-C je využití kyseliny bempedové, která působí na stejnou metabolickou dráhu jako statiny. Tato látka je aktuálně testována v rámci studie CLEAR.
Možnosti ovlivnění Lp(a) jsou podle MUDr. Šatného v současnosti dvě: pomocí PCSK9 inhibitorů (snížení o 25–30 %) a prostřednictvím invazivní lipoproteinové aferézy, s níž lze dosáhnout snížení až o 80 %. Odborná veřejnost si podle MUDr. Šatného uvědomuje důležitost PCSK9 proteinu v patogenezi aterosklerózy. Proti tomuto proteinu je cílena řada látek – monoklonální protilátky, adnektin, kandidátní vakcína či orální cyklické inhibitorové molekuly. Vyvíjí se rovněž orální antisense oligonukleotidové terapie či malé interferující RNA, které ovlivňují translaci PCSK9 proteinu.
Potvrzen byl rovněž efekt mipomersenu, který vedl k signifikantní redukci Lp(a). Lék však není v Evropě registrován pro své četné nežádoucí účinky. Další lék ze skupiny antisense terapie, pelacarsen, je testován ve studii HORIZON.
Ovlivnění dyslipidemie jako vedlejší efekt léčby je typické rovněž pro řadu léků ze skupiny antidiabetik.
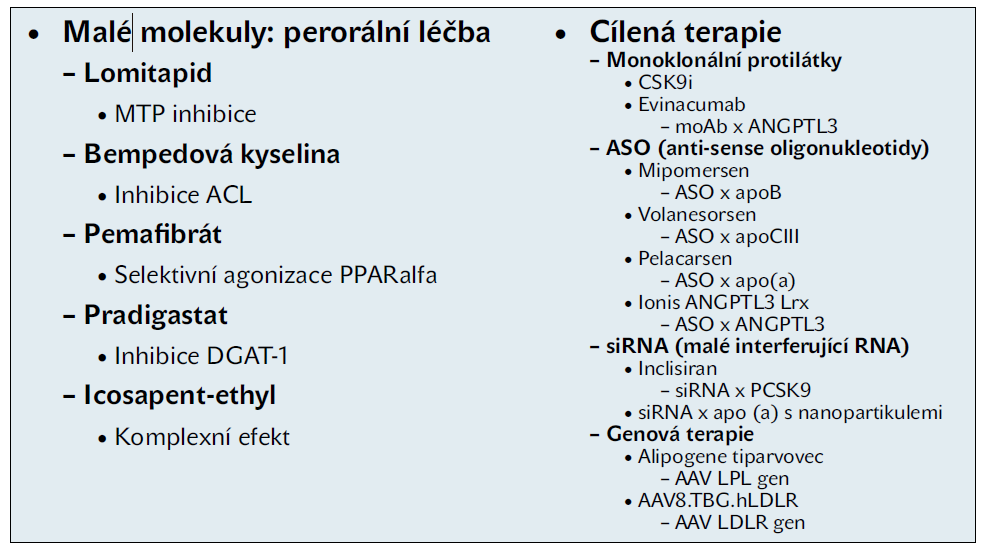
Přehled stávajících a potenciálních léčebných možností k ovlivnění lipidového RR ukazuje tabulka 1.
Tabulka 1 Přehled léčebných možností pro ovlivnění reziduálního lipidového rizika (podle Human Molecular Genetics 2019; 28(R1)
MUDr. Andrea Skálová
