Správného léčebného postupu lze v případě nemalobuněčného karcinomu plic (NSCLC) dosáhnout pouze multidisciplinární spoluprací. Specialisté tak určí specifickou kombinaci léčebných modalit podle charakteristik pacientova onemocnění a jeho celkového stavu. Terapeutické možnosti se v poslední době značně rozšířily především o cílenou léčbu. Právě aktuálním možnostem léčby lokálně pokročilého NSCLC je tento článek věnován.
Klinické stadium III NSCLC je velmi heterogenní. Zahrnuje skupinu pacientů s lokálně pokročilým onemocněním. Určení rozsahu postižení nitrohrudních, především mediastinálních lymfatických uzlin je nutností. Stejně tak se nelze obejít bez stanovení prediktivních markerů.
Doporučení ESMO (European Society for Medical Oncology) klasifikují lokálně pokročilé onemocnění jako stadium III NSCLC. V tomto klinickém stadiu je diagnostikována zhruba třetina pacientů. Pětileté přežití dosahuje téměř ke 40 % ve stadiu IIIA, kdežto ve stadiu IIIC se pohybuje lehce nad 10 %.
Bez precizní diagnostiky se nelze obejít. Zásadní je přesné určení rozsahu postižení mediastinálních lymfatických uzlin pomocí radiologického a invazivního stagingu. Invazivní staging lze zvolit chirurgický (většinou videoasistovanou mediastinoskopii – VAM) nebo nechirurgický (endobronchiální ultrasonografii – EBUS a endoskopickou jícnovou ultrasonografii – EUS). Nedílnou součástí diagnostického procesu je také stanovení prediktivních markerů, které probíhá reflexně.
Optimální management přístupu k lokálně pokročilému NSCLC vyžaduje multidisciplinární spolupráci. Terapie totiž bývá multimodální a podílí se na ní více specialistů. Využívána je chirurgická léčba, radioterapie, chemoterapie, imunoterapie a biologická léčba.
Léčba lokálně pokročilého operabilního NSCLC
Radikální chirurgická léčba je indikována multidisciplinárním týmem u nemocných s postižením uzlin N0, N1 a selektivně u některých jedinců s N2 postižením malého rozsahu. V drtivé většině jde o pacienty ve stadiu IIIA. Za radikální chirurgický výkon je považována minimálně lobektomie s lymfadenektomií plicního hilu a mediastina.
U všech pacientů v dobrém klinickém stavu ve stadiu III následuje po resekci plicního tumoru adjuvantní chemoterapie. Chemoterapie je v případě R1(R2) resekce nebo někdy při postižení N2 uzlin kombinována s radioterapií.
U vybraných pacientů ve stadiu III může být před radikálním operačním výkonem indikována neoadjuvantní chemoterapie s cílem zmenšit velikost tumoru. U nádorů horního sulku přichází v úvahu neoadjuvantní konkomitantní chemoradioterapie.
Řadu let nedošlo v adjuvanci a neoadjuvanci k zásadní inovaci. Nyní přišel průlom jak v biologické léčbě, tak v imunoterapii. Tyto nové léčebné modality se uplatňují i u nižších klinických stadií a nemají zatím úhradu z veřejného zdravotního pojištění.
Adjuvantní léčba osimertinibem
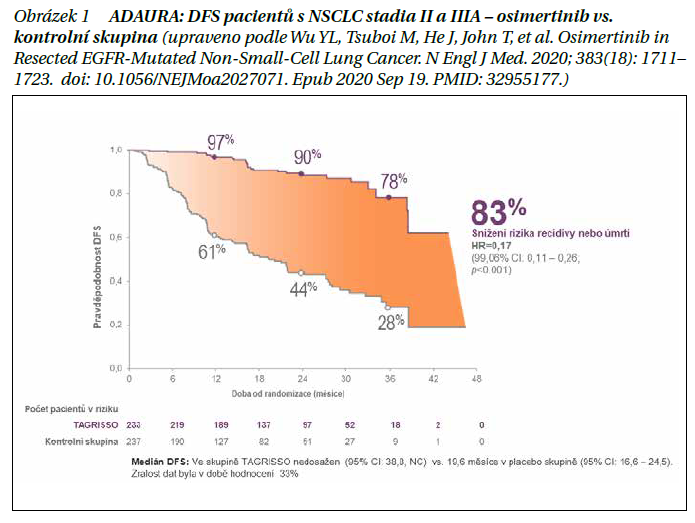
U pacientů ve stadiu IB–IIIA po úplné resekci, jejichž nádory mají deleci na exonu 19 receptoru epidermálního růstového faktoru (EGFR) nebo substituční mutaci exonu 21 (L858R), je indikována adjuvantní léčba osimertinibem v monoterapii. Indikace vzešla z přelomové studie ADAURA. Výsledky osimertinibu v adjuvantním podání byly natolik excelentní, že byla studie dokonce předčasně odslepena. Adjuvantní léčba osimertinibem významně snížila riziko recidivy onemocnění nebo úmrtí oproti placebu.
Benefit osimertinibu byl zaznamenán napříč všemi predefinovanými podskupinami (bez ohledu na stadium onemocnění, anamnézu kouření, etnickou příslušnost, pohlaví, věk, typ EGFR mutace) a nezávisle na tom, zda byla nebo nebyla podána předchozí adjuvantní chemoterapie. U pacientů s radikálně resekovaným EGFR mutovaným NSCLC stadia II a IIIA došlo při adjuvantním podávání osimertinibu k 83% snížení rizika recidivy nebo úmrtí (obrázek 1). Napříč všemi zkoumanými stadii NSCLC (IB, II a IIIA) snížil osimertinib riziko recidivy nebo úmrtí o 80 % oproti placebu [HR = 0,20 (99,12% CI: 0,14–0,30; p < 0,001)]. Doporučená dávka osimertinibu pro adjuvantní léčbu je 80 mg 1× denně, nalačno nebo po jídle, po dobu 3 let. Uvedenou léčbou se snižuje i riziko vzniku vzdálených metastáz, zejména metastáz do CNS. Osimertinib je v adjuvanci schválen FDA (Food and Drug Administration) i EMA (European Medicines Agency) a je doporučen v Modré knize ČOS (České onkologické společnosti). Úhrada z veřejného zdravotního pojištění by měla brzy přijít.
Pokud tumor nevykazuje aktivační mutace EGFR nebo přestavbu genu ALK (anaplastické lymfomové kinázy), lze v adjuvantní léčbě po úplné resekci a chemoterapii na bázi platiny indikovat imunoterapii. U pacientů ve stadiu II–III s PD-L1 expresí ≥ 50 % byl EMA jako monoterapie nedávno schválen atezolizumab. Schválení vychází ze studie IMpower010, ve které atezolizumab u vysokých expresorů v adjuvanci snížil riziko rekurence o 57 % oproti nejlepší podpůrné léčbě. Kromě atezolizumabu svou účinnost v adjuvantním podání prokázal např. i pembrolizumab (studie PEARLS/KEYNOTE-091).
Neoadjuvatní léčba nivolumabem
K zásadnímu průlomu došlo také v neoadjuvantní léčbě. Vůbec první molekulou, kterou schválila FDA, je nivolumab. Na základě výsledků studie CheckMate 816 je nivolumab v kombinaci s chemoterapií platinovým dubletem indikován ve Spojených státech amerických v neoadjuvanci u pacientů s resekabilním NSCLC (velikost tumoru ≥ 4 cm nebo pozitivní lymfatické uzliny). V této neoadjuvantní studii nivolumab v kombinaci s chemoterapií snížil riziko rekurence, progrese nebo smrti o 37 % oproti chemoterapii.
Léčba lokálně pokročilého inoperabilního NSCLC
U pacientů s inoperabilním lokálně pokročilým onemocněním (především stadia IIIB a IIIC) je standardem léčby konkomitantní chemoradioterapie s kurativním záměrem. Podstoupit by ji měli všichni vhodní pacienti v dobrém klinickém stavu, jelikož konkomitance přináší výraznější benefit než sekvenční léčba. Při konkomitanci je dosaženo lepší lokální kontroly nemoci i delšího OS (celkového přežití). Chemoterapie je podávána v počtu 4–6 cyklů a skládá se z platinového derivátu (ideálně cisplatiny) a jiného cytostatika. Při konkomitanci by radioterapie měla být zahájena nejpozději po druhém cyklu chemoterapie. Obvyklou radiační dávkou je normofrakcionace 60–66 Gy po dobu 6–7 týdnů.
Sekvenční chemoradioterapie by měla být indikována, pouze pokud nelze konkomitantní chemoradioterapii provést, ať již z důvodů na straně pacienta (např. komorbidity) nebo kvůli rozsáhlému nádorovému postižení, při kterém není vstupně radioterapie možná.
Konsolidační léčba durvalumabem
Zavedeným standardem léčby v Evropě je, že pokud nádor vykazuje expresi PD‑L1 ≥ 1 % a zároveň nedojde k progresi onemocnění po provedené chemoradiaci, následuje konsolidační léčba durvalumabem (pozn.: V USA jsou takto léčeni i pacienti s negativní PD-L1 expresí.). Durvalumab může být aplikován maximálně po dobu 1 roku, tak jak tomu bylo i ve známé studii PACIFIC. K dispozici máme aktualizovaná 5letá data. V rámci sledování bylo ve studii PACIFIC u pacientů s PD‑L1 ≥ 1% expresí dosaženo mediánu OS 63,1 měsíce na durvalumabu vs. 29,6 měsíce na placebu (HR 0,61, 95% CI: 0,44–0,85) (obrázek 2).
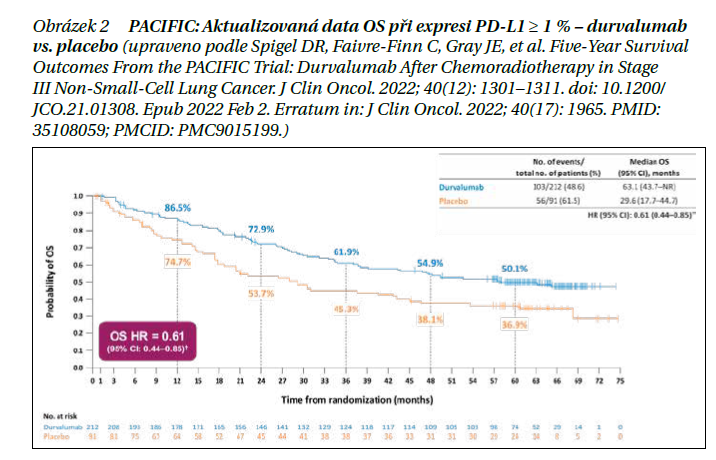
Přínos durvalumabu byl již dříve potvrzen napříč všemi podskupinami (otazný jen u podskupiny PD-L1 < 1 %). Navíc bylo prokázáno, že se u pacientů léčených durvalumabem vyskytlo méně nových lézí včetně metastáz v mozku oproti pacientům na placebu. Konsolidační léčba durvalumabem je hrazena z veřejného zdravotního pojištění již delší dobu i v České republice.
U pacientů, především u těch, kteří nejsou vhodní k radikální chemoradioterapii, přichází v případě pozitivity prediktivních markerů v úvahu nasazení příslušné biologické léčby.
Výsledky samostatných léčebných modalit, ať už radioterapie nebo paliativní chemoterapie, nejsou zdaleka uspokojivé a jsou indikovány zřídka.
Postavení cemiplimabu
Nutno zmínit, že u pacientů s inoperabilním lokálně pokročilým NSCLC, kteří nejsou vhodní k definitivní chemoradioterapii, se naskýtá nová možnost léčby cemiplimabem. Cemiplimab je na základě výsledků ze studie EMPOWER-Lung 1 indikován v monoterapii v první linii léčby u pacientů s pokročilým NSCLC exprimujícím PD-L1 ≥ 50 %, pokud je nádor bez aberací EGFR, ALK nebo ROS1. Cemiplimab u nás zatím hrazen není, ale již několik žádostí bylo úspěšných na tzv. paragraf 16.
Závěr a diskuze
Léčba lokálně pokročilého NSCLC představuje v plicní onkologii opravdovou výzvu. Především pacienti s N2 onemocněním jsou snad nejkontroverznější skupinou nemocných s NSCLC vůbec. Jak již bylo zmíněno, multidisciplinární přístup je k nemocným v tomto klinickém stadiu nezbytný a bez multimodální léčby se prakticky nelze obejít. Možnosti léčby se navíc rozšiřují. Z těchto důvodů by měli být pacienti léčeni v centrech, která mají dostatek zkušeností a dotyčnému poskytnou nejlepší možnou péči.
MUDr. Marie Drösslerová
Pneumologická klinika 1. LF UK a Fakultní Thomayerovy nemocnice
