Nemalobuněčný karcinom plic představuje cca 85 % případů karcinomů plic. Důvodem nádorové transformace jsou mutace klíčových genů (onkogenů a tumor supresorových genů), podílejících se na regulaci buněčného cyklů. Tyto mutace jsou částečně nahodilé, do značné míry jsou však ovlivněny faktory životního stylu, zejména kouřením (80–90 % případů má souvislost s kouřením, včetně kouření tzv. z druhé a třetí ruky), 10–15 % expozici radonu a jiným karcinogenům, 1–2 % případů jsou připisována znečištění ovzduší. V řadě případů nelze stanovit jednoznačnou kauzalitu (např. z důvodu kombinace rizikových faktorů). Genetická zátěž (nejčastěji v podobě zděděné ztráty heterozygotnosti některého z tumor supresorových genů) je přítomna v 8–14 %.
Karcinom plic (KP, LC – lung cancer) představuje celosvětově jednu z nejvýznamnějších příčin mortality (1,8 milionu úmrtí v roce 2020). V ČR je ročně nově diagnostikováno okolo 6 700 případů a okolo 5 300 nemocných na karcinom plic umírá (ÚZIS, 2020). Typický český případ s KP je muž ve věku 64–75 let, kuřák či bývalý kuřák. Průměrná incidence se podstatně nemění (2011–2020 okolo 65–67 případů / 100 000 obyvatel), lze však pozorovat pokles incidence u mužů (-12 %) i mortality (-15 %), kdežto u žen incidence i mortalita narůstají (+17,7 %, resp. 17,4 %). Relativně dobrou zprávou je narůstající prevalence: 2020 = 13 632 osob oproti 2011 = 10 182 osob. Vzhledem k neměnnému počtu nemocných, kteří přicházejí s lokálně pokročilou či metastatickou chorobou (v ČR okolo 70 % [2010–2020 podle ÚZIS]), lze toto zlepšení přičíst hlavně zlepšení (byť stále nedobré) prognózy pokročilých stadií nemoci. Snahu zlepšit pozdní diagnostiku KP představuje nový program časného záchytu karcinomu plic. Karcinom plic představuje nejčastější příčinu mortality z onkologických nemocí a celkově v roce 2020 představoval 5. nejčastější příčinu smrti vůbec, u mužů dokonce 3. nejčastější (ČSÚ, 2020).
Výše uvedená čísla platí pro nemalobuněčný (NSCLC) i malobuněčný karcinom plic (SCLC). Klinicky jde o dvě rozdílné entity prognosticky, molekulárně i terapeuticky. V dalším textu je proto budeme hodnotit odděleně.
Nemalobuněčný karcinom plic (NSCLC)
WHO klasifikace rozlišuje karcinomy plic na adenokarcinomy a jeho četné podtypy (ADCa či častěji nonSQCa – neskvamózní karcinom), spinocelulární (též skvamózní) karcinom (SQCa), neuroendokrinní karcinomy (malobuněčný (SCLC) a velkobuněčný (LCNEC) a dále vzácné jednotky adenoskvamózní karcinom, sarkomatoidní karcinom, karcinom ze slinných žláz (mukoepidermoidní a adenoidně-cystický) (WHO, 2021).
Klinicky má největší význam identifikace karcinomů malobuněčných a nemalobuněčných a následně subspecifikace NSCLC na adenokarcinom a skvamózní karcinom, případně NSCLC NOS (not otherwise specified), kdy nelze rozlišit ani náznaky skvamózní či neskvamózní diferenciace.
V průběhu let narůstá incidence adenokarcinomu a klesá incidence skvamózního karcinomu, v současnosti udávají autoři poměr 50 : 50, u žen již adenokarcinom převažuje. Incidenci jednotlivých podtypů NSCLC lze sledovat v čase, přičemž adenokarcinom má stoupající trend, zatímco spinocelulární karcinom a velkobuněčný karcinom mají spíše klesající trend.
S rozvojem molekulárněgenetických metod dochází k dalšímu rozdrobování podskupin NSCLC podle jejich aktivačních onkogenních mutací. Tento trend je již výrazný u neskvamózních NSCLC, u ostatních skupin je v počátcích. U non-SQ NSCLC nejčastěji dochází k aktivaci onkogenů KRAS (25–30 % ADCa), EGFR (10 %), ALK (5 %), ERBB2 (HER2/Neu) 2–3 %, ROS1 (1–2 %), MET (1–2 %), BRAF (1 %), RET (1 %), NTRK (1 %), popsána je ale i řada dalších mutací. Tyto podtypy se pak liší prognózou i možností cílené léčby (viz dále).
Diagnóza karcinomu plic
Projevy nemoci zahrnují jednak lokální příznaky, jednak symptomy způsobené metastázami.
V časném stadiu může být tumor zjištěn náhodně v rámci vyšetření z jiné indikace. Nejčastějším klinickým projevem je kašel či jeho změna (u kuřáka), dále hemoptýza, dušnost (či její zhoršení) na podkladě atelektázy, masy tumoru či pleurálního výpotku. Další, méně specifické příznaky zahrnují nechutenství, hubnutí, únavu a slabost. Okolo 10 % případů karcinomu plic doprovází paraneoplastické projevy, např. horečky, hyperkalcemie a její projevy (nejčastější u spinocelulárního karcinomu) či neurologické a endokrinní paraneoplastické projevy (nejčastější u SCLC), z nichž nejčastější je hyponatremie (na podkladě SIADH). Opomíjeným projevem je paraneoplastická hypertrofická osteoartropatie. Paraneoplastický žilní trombembolizmus se vyskytuje u 3 % nemocných s KP.
Menší centrální tumory se mohou projevit primárně postobstrukční pneumonií a představují diagnostické riziko, stejně jako lepidický (dříve bronchialveolární) adenokarcinom, který svým tapetujícím, málo invazivním růstem imituje na skiagramu plic zánětlivou infiltraci. Proto je třeba dosledovat resorpci pneumonických infiltrátů na skiagramu a v případě její neresorpce (či infiltrátu bez obrazu pneumonie) myslet na možnost malignity a odeslat nemocného na příslušné pracoviště.
Útlak mediastinálních či krčních struktur tumorem či lymfadenopatií pak může vést k projevům syndromu horní duté žíly, chrapotu při paréze rekurentu nebo Hornerově trias (mióza, ptóza, enoftalmus). Nádorové onemocnění se též může projevit symptomy vzdálených metastáz, které odvisí od topiky léze. Generalizace do mozku se může projevit např. bolestí hlavy, zmateností, vertigem, (hemi)paretickými symptomy, poruchami vizu aj.
Karcinom plic nejčastěji metastazuje do mozku, jater, skeletu, plic a nadledvin a samozřejmě lymfatických uzlin. Metastázy zejména mozku, ale též např. jater a skeletu jsou spojeny s horší prognózou a celkovým přežitím. SCLC metastazuje nejčastěji do mozku (47 %) a jater (35 %), NSCLC do kostí (39 %) a plic (22 %), zde již ale nelze zobecňovat, např. pro podskupinu ALK pozitivních ADCa je generalizace do mozku typická.
Klasifikační kritéria, staging
Na základě radiologických metod klasifikujeme karcinom plic do stadií podle TNM klasifikace. Nejnovější je TNM-8 klasifikace zhoubných novotvarů, která rozděluje karcinom plic do stadií IA1–IVB podle velikosti tumoru, jeho invaze do jiných struktur, postižení lymfatických uzlin a vzdálených metastáz. Podrobnosti TNM klasifikace jsou mimo rozsah toho článku. Obecně stadium IA–IIB představují malé tumory do 5 cm (T2b) bez či s postižením lymfatických uzlin plicního hilu. Tumory větší (5 cm) či s postižením mediastinálních uzlin představují lokálně pokročilé tumory stadia III, kde je postup vysoce individuální a měl by jej rozhodovat mezioborový tým. Stadium III členíme na stadium IIIA, IIIB a IIIC, kde stadium IIIA představuje tumory ještě potenciálně operabilní (T1x-2xN2M0 či T3-4N1M0).
Stadium IIIB a IIIC jsou pak tumory velké, s postižením stejnostranných (N2, vč. subkarinálních) či kontralaterálních (N3) mediastinálních, kde je operace již výjimkou a nejčastěji je indikována chemoradioterapie, pokud rozsah nemoci umožní zahrnout celé nádorové postižení do ozařovacího pole.
Ve zbylých případech, stejně jako u metastatického postižení, je zpravidla indikována systémová léčba. Výjimku představuje oligometastatické synchronní či metachronní postižení, kdy je někdy možno se pokusit o radikální přístup (např. primární tumor plic, bez postižení uzlin se solitární metastázou v nadledvině). Za standard kvality léčby NSCLC dnes již považujeme multidisciplinární přístup a rozbor na indikačním semináři, včetně analýzy prediktivních markerů.
Program časného přístupu
Vzhledem k vysokému výskytu pozdních stadií je od ledna 2022 v ČR dostupný program časného přístupu záchytu karcinomu plic. Podle ideálu organizace by měl praktický lékař motivovat a doporučit k vyšetření na pneumologické pracoviště kuřáky ve věku 55–74 let, kteří kouří 20 let cca 20 cigaret denně (či 10 let 40 cigaret denně). Pneumolog klienta vyšetří a rizikové nemocné odesílá na akreditované radiologické pracoviště k provedení nízkodávkového CT.
Prediktivní markery
Nezbytnou součástí léčby, pokud je jejich zisk alespoň trochu možný, je vyšetření prediktivních markerů. Podle doporučení České patologické společnosti, České onkologické společnosti a České pneumologické a ftizeologické společnosti jsou rutinně stanovovány následující markery: u SQCa exprese ligandu receptoru pro programovanou buněčnou smrt 1 (PD-L1) na nádorových buňkách, u non-SQ NSCLC je mandatorní stanovení markerů EFGR, ALK, ROS1 a PD-L1. Stanovení těchto prediktivních markerů přímo ovlivňuje výběr léčby a podmiňuje úhradu řady moderních léků.
Od května 2022 je v ČR hrazeno i prediktivní testování metodou NGS (next generation sequencing), které dokáže odhalit podstatně více molekulárních cílů, a přispět tak k volbě precizně cílené léčby nemocného s NSCLC, což se odráží ve zlepšené kvalitě i délce života. Podmínkou úhrady je indikace tohoto vyšetření mezioborovým indikačním seminářem.
Léčba NSCLC
Léčba NSCLC je volena na základě rozsahu nemoci (stadiem), umístění tumoru, ventilačních funkcí nemocného, jeho fyzického stavu, interních komorbidit a též preferencí. Fyzický stav hodnotíme podle ECOG (či též PS) skóre.
Chirurgická léčba
U časných a lokálně pokročilých, ale operabilních stadií (tj. zpravidla do stadia IIIA, s možností výjimek samozřejmě) je preferovanou metodou chirurgická resekce. Za standardní výkon je považována lobektomie s mediastinální lymfadenektomií, provedená otevřenou torakotomií, videoasistovanou torakoskopií (VATS) či roboticky asistovanou torakoskopií (RATS) podle uložení, velikosti tumoru a lokálních podmínek. Resekce menšího rozsahu, tzv. sublobární resekce (např. segmentektomie, trisegmentektomie, neanatomická resekce) v kombinaci s lymfadenektomií může být použita u nemocných s ventilační limitací či drobných tumorů do 2 cm včetně, uložených v zevní třetině plicního parenchymu. Před sublobární resekcí by měl být ověřen negativní status uzlin, při pozitivitě N1 etáže se nedoporučuje. Metaanalýzy ukázaly při dodržení výše uvedených srovnatelné výsledky s lobektomií (PFS 88,0 vs. 87,9 %) a jen mírně vyšší výskyt lokálních relapsů (11 vs. 5 %). Nejrozsáhlejším výkonem je pak pneumonektomie.
Chemoterapie
Po úspěšné radikální operaci je u stadií II a III doporučeno podání adjuvantní (pooperační) chemoterapie platinovým derivátem (cisplatinou či karboplatinou v kombinaci s vinorelbinem). Adjuvantní chemoterapie (CHT) sníží riziko recidivy nemoci o 4–5 %. U stadia IB není benefit jednoznačný (HR 0,93) a o chemoterapii uvažujeme hlavně při přítomnosti 2 či více rizikových faktorů (tj. angioinvaze, pleurální invaze, grade 3 histologie, sublobární resekce a neznámý statut uzlin).
V případě pozitivních resekčních okrajů by po chirurgickém výkonu měla následovat plnohodnotná chemoterapie, radioterapie či jejich kombinace, pokud stav nemocného dovolí.
V roce 2023 byly možnosti adjuvantní léčby rozšířeny o tyrosinkinázový inhibitor osimertinib (u EGFR mutovaných NSCLC, s či bez adjuvantní CHT) a monoklonální protilátku atezolizumab (při PD-L1 expresi ≥ 50 %, bez aktivačních mutací, po adjuvantní CHT). Oba léky snižují výrazně riziko recidivy nemoci: osimertinib dvouleté DFS 89 vs. 52 % s placebem, čtyřleté DFS 70 vs. 29 % s placebem a atezolizumab tříleté DFS 75 vs. 50 % s placebem. V individuálních případech může být použita chemoterapie v intenci zmenšit tumor a umožnit operabilitu (neoadjuvantní CHT).
Neoadjuvantní CHT je v současnosti na ústupu, je však možné, že tento trend zvrátí slibné výsledky probíhajících studií s neoadjuvantní chemoimunoterapií checkpoint inhibitory.
Radioterapie
Radioterapie (RT) s kurativním záměrem má své pevné místo v léčbě lokálně pokročilých, ale neoperovatelných tumorů, a též u nemocných neschopných podstoupit chirurgický výkon (ventilační limitace, komorbidity, biologické rezervy nemocného, odmítnutí). U tumorů do velikosti 30 mm lze uvažovat o cílené stereotaktické radioterapii (zpravidla 3× 18 Gy či 5× 10–12 Gy). V ostatních případech je indikována konvenční (klasická radioterapie). Za radikální dávku považujeme u NSCLC 45–66 Gy. Radioterapii stadií II–III kombinujeme s chemoterapií, která je podávána naráz s RT (konkomitantně) či sekvenčně.
Konkomitantní RT je účinnější (medián OS 17 vs. 14 měsíců, pětileté OS 16 vs. 10 %), ale zatížena větší toxicitou (zejména hematologickou (gr. 3–4 neutropenie 45 vs. 35 %, o cca 30 % riziko radiační ezofagitidy). Preferovanými režimy pro chemoradioterapii (CHTRT) jsou karboplatina s paklitaxelem, případně cisplatina s pemetrexedem. U nemocných bez progrese nemoci po konkomitantní CHRT je hrazena 12měsíční léčba durvalumabem (v rámci indikačních omezení, zejména PD-L1 ≥ 1 %, která podle studie PACIFIC výrazně prodlužuje dobu do progrese medián PFS 28,3 měsíce vs. 17,1 měsíce placebo, pětileté DFS 33 vs. 19 % placebo).
Radioterapie může být komplikována (po)radiační pneumonitidou – při špatných ventilačních a difuzních parametrech je indikace/kontraindikace radioterapie individuální. Definitivní slovo, zda je nález vhodný k radioterapii, má radiační onkolog. V některých případech může mezioborový tým indikovat jen samostatnou radioterapii (např. není-li předpoklad tolerance chemoterapie). Radioterapie má též významné uplatnění v paliativní léčbě KP.
Léčba metastatického stadia
V individuálních, vzácných případech nemocných s malým množstvím metastáz (zpravidla 1–3, ojediněle až 5) a dobrém klinickém stavu se lze pokusit o léčbu s potenciálně kurativním záměrem (např. kombinaci chirurgické, radiační léčby a zpravidla i systémové léčby). Typický pacient s NSCLC však přichází s pokročilou, mnohočetně metastatickou nemocí a léčba je vedena paliativně.
Chemoterapie
Množství dostupných a hrazených preparátů se stále rozrůstá. Volba je opět v rukou mezioborového týmu a je vedena s ohledem na prediktivní markery. Může být jednosložková či kombinační. Standardem chemoterapie zůstává platinový derivát v kombinaci s pemetrexedem (pouze non-SQ NSCLC), paklitaxelem, vinorelbinem nebo gemcitabinem (SQ-NSCLC). Docetaxelje standardem chemoterapie ve vyšších liniích léčby. Jsou-li splněna indikační kritéria, je možno u selektovaných nemocných v dobrém fyzickém stavu podávat chemoterapii v kombinaci s imunoterapií checkpoint inhibitory(pembrolizumab, nivolumab + ipilimumab, atezolizumab).
Imunoterapie
Checkpoint inhibitory jsou monoklonální protilátky, vážící se na imunoinhibiční molekuly na povrchu nádorových buněk či lymfocytů. Nejčastěji blokujeme signální pár PD-L/PD-L1 a molekulu CTLA4, další inhibitory jsou ve vývoji. Blokáda těchto molekul vede (ideálně) k aktivaci protinádorové imunity a destrukci nádorových buněk.
Podání je zatíženo nežádoucími účinky autoimunního spektra (nejčastěji hypotyreóza, ale teoreticky jakékoli autoimunní postižení, obávaná je zejména pneumonitida, kolitida), případně přehnanou cytokinovou aktivitou (cytokine release syndrom). Tyto nežádoucí účinky jsou léčitelné kortikoterapií aj. imunosupresivní léčbou, mohou však být důvodem ukončení terapie. U nemocných s vysokou PD-L1 expresí má srovnatelné či lepší výsledky podání samostatné imunoterapie a je preferováno s výjimkou rychle progredujících tumorů (důvodem je opožděný nástup účinku imunoterapie).
Některé checkpoint inhibitory lze podat i samostatně ve vyšších liniích léčby, pokud nebyly dosud použity. U nemocných s průkazem aktivačních mutací může být použita cílená léčba tyrosinkinázovými inhibitory EGFR (osimertinib či starší gefitinib, afatinib, erlotinib), inhibitory ALK (alektinib, lorlatinib, krizotinib*, ceritinib), ROS (entrektinib, crizotinib), BRAF (trametinib*, dabrafenib*), NTRK (entrektinib*), KRAS (sotorasib*, adagrasib*), RET (pralsetinib*), MET (tepotinib*, kapmatinib*). Jejich použití vyžaduje průkaz aktivační mutace a splnění úhradových podmínek (jsou-li v ČR stanoveny), případně žádost o mimořádnou úhradu zdravotní pojišťovnou (zatím nehrazené označeny hvězdičkou*).
Rozsah indikací přesahuje rámec tohoto článku. Do praxe pomalu proniká i drug-konjugát trastuzumab deruxtekan* (HER2 pozitivní NSCLC) a bispecifickou protilátku amivantanab* (účinný u NSCLC s EGFR inzercí v exon 20 a s duální mutací EGFR a amplifikací MET (jako mechanizmem sekundární rezistence).
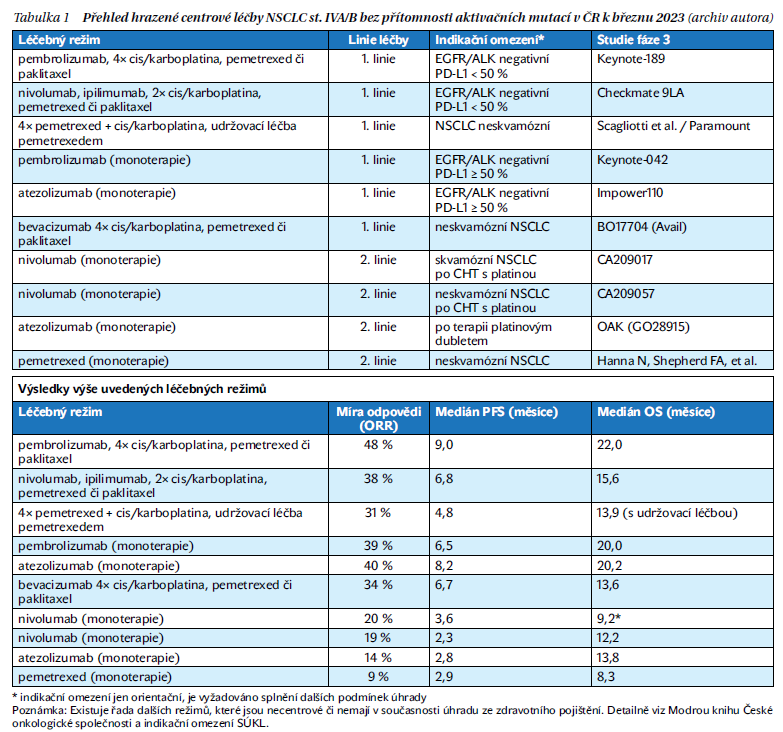
Vzhledem k extrémní rozvětvenosti současných možností léčby by dnes již vyšetření prediktivních markerů a konzultace mezioborové indikační skupiny měly být nepodkročitelným standardem. Pokroky a precizní medicína přinesly v průběhu posledních 20 let zlepšení pětiletého přežití nemocných se stadiem IV NSCLC z dříve udávaných 2–5 % na 15–16 %, přičemž jednotlivé molekulární podskupiny NSCLC mají prognózu diametrálně odlišnou – kompletní léčebné odpovědi po imunoterapii již nejsou raritní výjimkou, zejména u vysokých expresorů PD-L1, taktéž např. dlouhodobé přežití ALK+ NSCLC je řádově pravděpodobnější než např. u nemocného se současnou mutací KRAS a STK11. Stručný přehled nejčastějších možností léčby udává tabulka 1.
Malobuněčný karcinom plic (SCLC)
Malobuněčný karcinom plic představuje samostatnou nozologickou jednotku. Tvoří okolo 15 % případů KP. Jde o vysoce agresivní tumor se špatnou prognózou. Časně metastazuje, proto je operabilita doporučena jen u stadia I–IIA. U vyšších, nemetastatických stadií (IIB–IIIC) je indikována chemoradioterapie jako metoda volby, lze-li tumor zavzít celý do ozařovacího pole. Konkomitantní CHTRT má opět lepší výsledky než sekvenční (medián OS 27 vs. 20 měsíců), pětileté OS je však nízké (18 %).
U metastatického stadia podáváme systémovou chemoterapii, režimem volby je platinový dublet s etoposidem (ORR 61 %, medián PFS 4,3 měsíce, medián OS 8,6 měsíce). U nemocných v dobrém stavu (PS 0–1) má v ČR nově úhradu durvalumab v kombinaci se 4 cykly chemoterapie a následnou udržovací léčbou durvalumabem, což zlepšuje (ORR 68 vs. 58 % chemoterapie platina + etoposid, medián OS 12,9 vs. 10,5 měsíce, dvouleté PFS 11 vs. 3 %).
Při dobré léčebné odpovědi zvažujeme profylaktické ozáření neurokrania, což snižuje časný výskyt mozkových metastáz. Ve druhé linii volíme podle délky léčebné odpovědi buď stejný režim (PFS ≥ 3 měsíce), či topotekan, eventuálně starší režimy (např. cyklofosfamid, doxorubicin a vinkristin) či monoterapii paklitaxelem, ale se špatnými výsledky (pětileté OS jen 3–5 %). Úhradu zatím nemá nová molekula lurbinektibin, která vykazuje lepší výsledky než topotekan ve vyšších liniích, a řada dalších látek.
Objev molekulárních podtypů SCLC (SCLC-A, SCLC-N, SCLC-Y a SCLC-P) snad povede k lepšímu výběrů kandidátů pro dané léčby, tyto podtypy však zatím není možné stanovovat v klinické praxi. SCLC tak zůstává zatím prognosticky velmi špatnou jednotkou.
Literatura u autora.
MUDr. Ondřej Fischer
Klinika plicních nemocí a TBC LF UP a FN Olomouc
