V článku jsou shrnuty současné léčebné postupy u karcinomu mléčné žlázy, a to jak u nemetastatického, tak u metastatického nádorového onemocnění. Jsou uvedeny možnosti lokoregionální terapie (chirurgické postupy a radioterapie) a zejména možnosti systémové onkologické terapie (hormonoterapie, chemoterapie, cílené terapie a imunoterapie).
Karcinom mléčné žlázy je v současné době nejčastější zhoubné nádorové onemocnění u žen. Jeho incidence oproti předchozím rokům neustále stoupá, ale naštěstí jeho mortalita mírně klesá. Diagnostika a terapie tohoto onemocnění zaznamenala bouřlivý rozvoj. Současný pohled na toto onemocnění je takový, že se jedná o velmi heterogenní onemocnění systémového charakteru a jeho léčba vyžaduje maximálně individuální přístup, vybraný pro tu kterou konkrétní pacientku.
Etiologie zhoubných nádorových onemocnění je nejasná, a tak naše terapie není kauzální, je svým způsobem symptomatická, léčíme projevy, existenci onemocnění. Proto také nemůže být v současné době kurativní v pravém smyslu slova. Nádorové onemocnění je velmi sofistikovaný parazit, jehož největší předností pro jeho přežívání jsou zatím nepřekonatelné vlastnosti, kterými jsou heterogenita nádorových buněk a neuvěřitelná plasticita v chování nádoru a reakci na okolnosti prostředí, ve kterém se nacházejí.
Zhoubné nádory prsu dělíme z léčebného hlediska na dvě velké skupiny: lokalizované onemocnění, stadia I–III – onemocnění léčená s kurativním záměrem, a onemocnění generalizovaná, stadium IV – léčená se záměrem paliativním. Již samotná skupina lokalizovaného onemocnění představuje z logiky klasifikace onemocnění natolik různorodou skupinu onemocnění, která nutně vyžaduje další členění na skupiny s lepší a horší prognózou, byť jen ve světle tohoto hrubého, numerického dělení. Toto dělení vyhovuje, a to jen relativně, pohledu léčebného záměru.
Základem diagnostiky je histologická verifikace onemocnění získaná odběrem vzorku nádoru biopsií či diagnostickou excizí. Již dlouho nevystačujeme s dělením na zhoubné a nezhoubné podtypy onemocnění. Diagnostika je postavená na histopatologickém vyšetření a stanovení a posouzení molekulárních, imunohistochemických parametrů onemocnění: grading onemocnění, proliferační aktivita, stav hormonálních estrogenových a progesteronových receptorů, stav receptoru cerbB2 (HER2 receptoru). Na základě kombinace uvedených faktorů dělíme zhoubné nádory prsu na čtyři velké skupiny, které se od sebe liší, jednak procentuálním výskytem v populaci, jednak, a to hlavně, svými prognostickými charakteristikami a predikcí léčebných způsobů.
Získáváme tak pět skupin onemocnění:
- Luminální A: ER a PR pozitivní (≥ 20 %), Her2 negativní, nízké Ki67, grading 1.
- Luminální B HER2 negativní: ER pozitivní, HER2 negativní a nejméně jeden z následujících: vysoké Ki67, PR negativní nebo nízké (< 20 %), grading 2 a vyšší.
- Luminální B HER2 pozitivní: ER pozitivní, HER2 pozitivní, jakékoliv Ki67; jakékoliv PR,
- HER2 (neluminální): ER i PR negativní, HER2 pozitivní.
- Triple negativní: ER i PR negativní, HER2 negativní, který je možno ještě subtypizovat na basal like – ER negativní/HER2 negativní/EGFR pozitivní a/anebo cytokeratin 5/6 pozitivní a normal like – ER negativní/HER2 negativní/EGFR negativní/cytokeratin 5/6 negativní.
Jedním z technických a technologických problémů tohoto členění je to, že stanovení gradingu, exprese ER, PR a Ki-67 podléhá do značné míry technické a individuální variabilitě, lišící se u vyšetřovaných laboratoří. Navíc se vedou „spory“ o stanovení pozitivity hormonálních receptorů (nad 1 %, nad 10 %?), byť ve světle níže uváděného textu je i obecněji přijímaná hranice 10 % velmi hrubým ukazatelem. Co je ale důležitější a zásadní, tyto uvedené biomarkery již nejsou schopny blíže diferencovat biologickou povahu onemocnění.
Hrubý, do jisté míry překonaný, respektive dalšími ukazateli upřesněný model terapie vychází ze základní premisy: z hlediska systémové terapie hormonálně dependentní nádory (luminální A a B) léčíme hormonoterapií, HER2 pozitivní nádory léčíme anti HER terapií a triple negativní nádory léčíme chemoterapií.
Onkologickou léčbu zhoubných nádorů prsní žlázy dělíme na metody lokální (lokoregionální), kam patří chirurgické postupy a radioterapie, a na metody systémové terapie, kam patří hormonoterapie, chemoterapie, cílená terapie a nyní nově i imunoterapie.
Lokoregionální postupy
Lokoregionální postupy prodělaly obrovský vývoj, mají nezanedbatelnou hodnotu a nezastupitelné místo v komplexní terapii nádorů prsu a jejich vývoj lze shrnout do dvou klíčových bodů:
- ústup od radikality a agresivity výkonů (platí zejména pro chirurgii),
- snaha o minimalizaci toxicity terapie při zachování či zvýšení protinádorové efektivity (platí pro radioterapii, což umožňují moderní fotonové ozařovače a ozařovací techniky).
Systémová onkologická terapie
Systémová onkologická terapie nádorů prsu prodělala podobně jako radioterapie, a i podstatně výrazněji, obrovský kvalitativní a kvantitativní skok v léčebných možnostech, který ale zároveň otevřel řadu otázek, na které neznáme vždy odpověď. Dá se říci, že každý posun a nový objev léčebného postupu otevřel minimálně jedny, ne-li více dveří do chodeb, kde tápeme a nevíme, zda jdeme správným směrem.
Systémová terapie lokoregionálního negeneralizovaného onemocnění
Tato terapie je postavena na užití neoadjuvantní či adjuvantní terapie, případně kombinace obou postupů. Zde máme relativně jednoduchou situaci u nádorů HER2 pozitivních a triple negativních a luminálních A, zejména u klinických stadií I a II. U stadia III luminální A a u luminálního typu B HER2 negativního již mohou nastat rozpaky ohledně sekvence a volby systémové terapie.
U nádorů HER2 pozitivních stadia II a III je indikována neoadjuvantní chemoterapie založená na kombinaci antracyklinových režimů sekvenčně užitých s taxanovými režimy (paklitaxel, docetaxel, případně nab-paklitaxel) v kombinaci s anti-HER2 terapií – duální anti- HER blokáda užití trastuzumabu a pertuzumabu (případně preparát Phesgo) – tato jednoznačně efektivnější terapie proti monoterapii trastuzumabem vyžaduje ale aktuálně souhlas plátce zdravotní péče. Následná adjuvantní terapie po chirurgickém zákroku závisí na míře odpovědi na neoadjuvantní terapii. Při navození kompletní patologické remise je indikována adjuvantní anti-HER2 terapie trastuzumabem, při nádorovém reziduu je indikováno k adjuvantní terapii užití konjugátu anti HER preparátu s cytostatikem (mitotický jed) – trastuzumab-emtansin Kadcyla®. Léčba v obou případech znamená zhruba 14 aplikací, celková doba neoadjuvantní a adjuvantní terapie představuje a nesmí překročit rok aplikace léků. U nádorů HER2 pozitivních a zároveň hormonálně dependentních je součástí adjuvantní terapie i hormonální terapie s preferencí užití nesteroidních inhibitorů aromatáz (anastrozol či letrozol). U nádorů hormonálně dependentních ve vyšším riziku, tj. s pozitivním nálezem v axilárních lymfatických uzlinách – pN1 – nebo reziduem po neoadjuvanci lze protrahovat adjuvantní anti-HER2 terapii užitím neratinibu – Nerlynx – po dobu dalších 12 měsíců adjuvance za předpokladu, že nebyl k terapii použit pertuzumab. Je otázkou, jaké bude postavení dalšího anti-HER konjugátu trastuzumab-deruxtekan (inhibitor topoizomerázy) Enhertu v této indikaci.
U nádorů triple negativních s výjimkou stadia I je indikována neoadjuvantní a případně adjuvantní systémová terapie. Ve světle aktuálních poznatků v kombinaci chemoterapie založené na sekvenci antracyklinových režimů (odvislých od stadia onemocnění a dalších rizikových ukazatelů, zejména proliferační aktivity) v dose denzním režimu v kombinaci s taxanovým režimem (paklitaxel) v kombinaci s karboplatinou ve weekly schématu, eventuálně v kombinaci s pembrolizumabem (imunoterapie založená na anti-PDL1 terapii) – tato u pokročilejších stadií s pozitivním nálezem ve spádových lymfatických uzlinách – cN1. Kombinace s imunoterapií vyžaduje aktuálně souhlas plátce zdravotní péče, nevyžaduje však jednoznačně nutnost prediktivního testování pozitivity PDL1, v tomto případě testování CPS/TPS. V adjuvantní monoterapii pembrolizumabem, opět po souhlasu s plátcem zdravotní terapie, lze pokračovat, pokud neoadjuvantní terapií nebude navozena kompletní patologická remise onemocnění. V případě nenavození kompletní patologické odpovědi po samostatné neoadjuvantní chemoterapii je vždy indikována adjuvantní chemoterapie kapecitabinem 6–8 cyklů v třítýdenním standardním režimu. Souběžné užití adjuvantní chemoterapie a indikované pooperační radioterapie je možné a nevyžaduje oddálení provedení radioterapie až po skončení adjuvantní chemoterapie.
U nádorů luminálních B od stadia II a nádorů luminálních A stadia III je situace užití neoadjuvantní terapie problematická. U nádorů luminálních A se obecně preferuje primárně chirurgický zákrok, u nádorů histologického typu lobulární karcinom, případně neoadjuvantní hormonoterapie (délka trvání minimálně 6 měsíců). Komplikovanější může být problematika adjuvantní systémové terapie. U luminálního typu A je vcelku jednoduše indikována adjuvatní hormonoterapie v trvání pěti, lépe deseti let. I zde je ale několik možných terapeutických postupů odvislých od rizikovosti onemocnění (velikost nádoru, stav regionálních uzlin) a věku pacientky (premenopauzální a postmenopauzální status).
U premenopauzálních pacientek nízkého rizika onemocnění je metodou volby užití hormonální terapie postavené na tamoxifenu, u pacientek vyššího rizika je vhodné užití analogu gonadoliberinu (LH-RH analoga) k vyvolání chemické kastrace s následným užitím nesteroidního inhibitoru aromatázy, eventuálně tamoxifenu – tato léčba je aplikována po dobu pěti let. U postmenopauzálních pacientek nízkého rizika je lékem volby stále antiestrogen tamoxifen po dobu minimálně pěti a maximálně deseti let. U pacientek vyššího rizika může být prováděna terapie nesteroidním inhibitorem aromatázy po dobu pěti až sedmi let, nebo sekvenční terapie tamoxifenem po dobu dvou až tří let následovaných nesteroidním inhibitorem aromatázy na dalších pět let nebo časová sekvence tamoxifenu pět let následovaná dalších pět let, terapií nesteroidním inhibitorem aromatázy.
Luminální typ B představuje z hlediska adjuvantní systémové terapie jakousi šedou zónu mezi luminálním typem A a HER2 pozitivním či triple negativním typem. Ve světle snahy o individuální, osobě na míru ušité léčby je luminální typ B problémem adjuvantní systémové terapie. Dosavadní prognostické a prediktivní imunohistochemické ukazatele (grading, proliferační aktivita, hormonální receptory a stav HER2 receptoru) nepřinášejí další potřebné informace o směřování léčby. Zcela zásadní změnu přinesly komplexní prognostické systémy založené na metodicky jednotném, vysoce přesném stanovení a interpretaci několika biomarkerů pomocí metod molekulární genetiky. Jedná se o genomické testování zaměřené na klíčové řídicí geny procesů růstu, proliferace, angiogeneze, metastazování a apoptózy. S jednoznačným závěrem prospěšnosti či neprospěšnosti adjuvantní chemoterapie u luminálních typů B (hormonálně dependentní nádory, grade 2 a 3 a zároveň rozsahem velikosti tumorů stadia T2 a N1(1–3 pozitivní lymfatické uzliny) je toto vyšetření (Mammaprint) rozhodující pro indikaci adjuvantní chemoterapie. V historickém pohledu byla u všech pacientek většího rozsahu (T2) při pozitivitě nálezu v regionálních lymfatických uzlinách, a zejména u mladších pacientek s vyšším gradingem 2 a více indikována adjuvantní chemoterapie. Dostupnost a užití genomického testování vede ke změně postupu léčby, kdy zhruba 30 % pacientek je ušetřeno adjuvantní chemoterapie. Nedílnou součástí pooperační léčby je následná hormonální terapie, která je užita analogicky jako u luminálního typu A vyššího rizika.
U nádorů HER2 negativních s prokázanou germinální mutací BCRA1, 2je možná adjuvantní terapie PARP inhibitory – tato je možná po skončení neoadjuvantní a adjuvantní chemoterapie u triple negativních nádorů a je alternativou adjuvantní hormonoterapie či kombinace adjuvantní hormonoterapie s anti CDK4/6 inhibitory u hormonálně dependentních BRCA pozitivních nádorů.
Systémová terapie metastatického nádorového onemocnění
Mnohem problematičtější situace je u metastatického nádorového onemocnění. Jedná se vždy o léčbu paliativní. Nejsme schopni onemocnění vyléčit, ale na rozdíl od jiných maligních onemocnění v tomto stadiu jsme schopni nabídnout pacientkám řadu let kvalitního života. Léčba je postavena na systémové terapii s jasným odklonem od dříve preferované chemoterapie a příklonem k hormonální terapii v kombinaci s cílenou terapií (luminální nádory A a B). Chemoterapie si udržuje své postavení u nádorů HER pozitivních a triple negativních, a to zejména pro nutnost její kombinace s cílenou anti-HER terapií nebo imunoterapií. Velmi důležitým, neřkuli zásadním se jeví rebioptické vyšetření aktuálního metastatického onemocnění s určením současných imunohistochemických parametrů onemocnění a vyšetření dalších prediktivních faktorů – PI3K, PDL1, zárodečná mutace BRCA.
U metastatického hormonálně dependentního a HER negativního karcinomu (luminal A a B) je v I. linii indikována hormonoterapie v kombinaci s léčbou cílenou na klíčové body buněčného cyklu – inhibitory cyklin dependentních kináz 4 a 6 (abemaciklib, palbociklib nebo ribociklib). U výběru preparátu hormonoterapie existuje vcelku shoda, neboť postupujeme v sekvenci antiestrogen tamoxifen – nesteroidní inhibitory aromatáz (anastrozol či letrozol) – antiestrogen fulvestrant a volíme v rámci hormonálního preparátu vždy následující v uvedeném pořadí – i v případě obvykle předcházející adjuvantní hormonoterapie. Nesteroidní inhibitory aromatáz je vhodné preferovat před steroidním, protože steroidní inhibitor můžeme s výhodou použít v kombinaci v další postupné řadě terapie a jeho použití v I. linii terapie by nám tuto možnost uzavřelo. S výběrem inhibitoru CDK4/6 je situace komplikovanější, protože máme k dispozici tři stejné (?), nebo tři rozdílné (!?) preparáty ve světle toho, jak na ně budeme nahlížet. Ve světle efektivity vyznívají lépe abemaciklib a ribociklib, a to pro lepší výsledky dosažené ve studiích v kritériu celkového přežití. Ve světle toxicity – známá hematologická toxicita (neutropenie) a kardiální zátěž (prodloužení QTc intervalu) u ribociklibu, gastrointerstinální toxicita (průjmy) u abemaciklibu a proti oběma druhým preparátům méně vyznačená toxitita u palbociklibu – může být jiným kritériem volby.
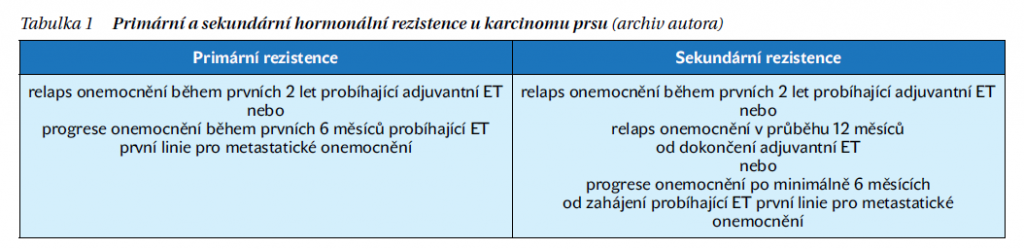
Do výběru preparátu můžeme zařadit i třetí hledisko, a to je fáze senzitivity či primární/sekundární hormonální rezistence, v jaké se aktuálně onemocnění pacientky nachází, s vědomím, že u hormonálně rezistentních onemocnění (zejména sekundární rezistence) lépe vyznívají výsledky ribociklibu a abemaciklibu. Tabulka 1 ukazuje dělení primární a sekundární hormonální rezistence u karcinomu prsu. Volba inhibitoru CDK tedy není jednoznačná, je jistě ovlivněná osobní zkušeností i subjektivním pohledem na preparáty. Aktuálně by se daly inhibitory seřadit v pořadí ribociklib, abemaciklib a palbociklib.
Další řadou hormonální terapie po selhání terapie inhibitorů CDK4/6 je kombinace exemestanu (steroidní inhibitor aromatáz) v kombinaci s cílenou blokádou zaměřenou na dysregulovanou m-TOR sigmalizaci – everolimus. Alternativou tohoto postupu, který může být za určitých okolností léčbou volby, a předejít tak v sekvenci tuto kombinaci, je kombinace fulvestrantu s alpelisibem při prokázané mutaci dráhy PI3K. Vyšetření této mutace je logickým a nutným krokem v diagnostice při selhávání I. linie paliativní hormonoterapie.
U metastatického HER2 pozitivního karcinomu je jako léčba volby indikována paliativní chemoterapie taxanovým cytostatikem (obvykle docetaxel) v kombinaci s duální anti-HER2 blokádou preparáty trastuzumab a pertuzumab. Podmínkou léčby je celkově dobrý klinický stav do PS1 a dobrá kardiální funkce vyjádřená hodnotou ejekční frakce levé komory srdeční nad 50 %. Léčba probíhá v tomto složení v aplikaci minimálně šesti cyklů kombinované terapie s možným následným přechodem na aplikaci samostatné cílené terapie, již bez cytostatika. Tato léčba probíhá do progrese onemocnění nebo toxicity onemocnění. Toxicitou bývá nejčastěji pokles zmíněné ejekční frakce, který ale bývá reverzibilní, a tak nejčastější příčinou ukončení terapie je progrese onemocnění. Cílená anti-HER2 terapie je indikována při progresi po I. linii léčby nadále, aktuálně je lékem volby konjugát anti-HER trastuzumabu s cytostatikem – trastuzumab-emtansin (Kadcyla). Podle posledních poznatků se výhodnějšími jeví užití konjugátu trastuzumab-deruxtecan (Enhertu) nebo kombinace tukatinib (anti-HER tyrosinkinázový inhibitor) v kombinaci s trastuzumabem a kapecitabinem. Zde je ale v současnosti nutný souhlas plátce zdravotní péče s léčbou. Tyto dvě varianty jsou jinak indikovány do III. linie terapie. Do dalších linií jsou indikovány kombinace lapatinib s kapecitabinem, nebo trastuzumabem, trastuzumab s chemoterapií (například vinorelbinem), vždy ale se souhlasem plátce zdravotní péče.
V případě, že je progrese onemocnění zaznamenána v centrálním nervovém systému, záleží na velikosti, lokalizaci a počtu mozkových metastáz. U nižšího počtu je preferován chirurgický zákrok, případně cílená radioterapie a u vyššího počtu metastáz ozáření celého mozku. Po této lokální terapii a prokázané stabilizaci CNS nálezu může být zahájena a prováděna systémová terapie II. či vyšší linie metastatického HER2 pozitivního karcinomu prsu.
Úloha a budoucí postavení konjugátů anti-HER preparátu a cytostatika v rámci individualizace léčby je i v oblasti rýsující se skupiny HER nádorových onemocnění (tzv. low-HER pozitivních nádorů), u kterých speciálně terapie konjugátem HER2 protilátky a cytostatika může být významnou léčebnou modalitou (cílené dopravení účinné látky).
U metastatického triple negativního karcinomu je základem léčby chemoterapie. Nezbytným předpokladem správně volené léčby v I. linii metastatického triple negativního onemocnění je stanovení pozitivity PD-L1 a znalosti stavu zárodečné BRCA mutace. U prokázané pozitivity PD-L1 se nabízí jako volba terapie kombinace chemoterapie (nab-paklitaxel) s imunoterapií (atezolizumab). Předpokladem užití této terapie je prokázání pozitivity PD-L1 na imunokompetentních buňkách nádorového mikroprostředí. Druhý preparát imunoterapie, který by bylo možno použít v této indikaci založené na anti PD-L1 léčbě – pembrolizumab, vyžaduje prokázání pozitivity PD-L1 v nádorových buňkách (kombinované skóre CPS/TPS). V principu se tedy nejedná o jeden typ vyšetření anti PD-L1. Vyšetření PD-L1 pozitivity musíme volit podle preparátu, který v léčbě plánujeme použít – aktuálně je preferován atezolizumab.
Při prokázané pozitivitě zárodečné mutace BRCA je indikována v I. linii terapie PARP inhibitory olaparib, případně talazoparib. Tato léčba je indikována za podmínky užití antracyklinů a taxanů v předchozí terapii (neoadjuvantní či adjuvantní linii terapie), což ale není vzhledem k jejich rutinnímu užití v této indikaci zásadním problémem.
Zajímavou situací, doufejme, že ne příliš častou, by mohl být nález současné pozitivity PD-L1 a gBRCA mutace. Onkolog by se tak dostal do pozice Sophiiny volby, protože v I. linii by mohl volit jednu cestu – anti-PDL-1 nebo BRCA – s tím, že druhou již nebude nikdy moci využít.
Při negativním nálezu PD-L1 a gBRCA je cestou léčebné volby samostatná chemoterapie, která je založena na užití platinového derivátu (obvykle karboplatina) v monoterapii nebo kombinaci s taxany.
V II. linii terapie jsme byli po dlouhou dobu odkázáni na další řadu chemoterapie (eribulin, gemcitabin, vinorelbin) s malým procentem odpovědi na léčbu. Aktuálně je dostupný a použitelný perspektivní preparát sacituzumab govitekan – Trodelvy, konjugát protilátky cílené na TROP receptory s cytostatikem – metabolit irinotekanu. Tato terapie přináší velké a zásadní naděje do II. a vyšší linie léčby metastatického triple negativního karcinomu. Lze jen s nadějemi nahlížet do budoucnosti tohoto preparátu v nižších liniích léčby karcinomu prsu, případně v jeho kombinaci s imunoterapií.
Závěrem lze konstatovat, že současná léčba karcinomu prsu je vzrušující a dobrodružnou cestou, založenou na individualizaci léčby vyplývající z rozdílných vlastností nemocné a z detailního poznání a rozlišení intracelulárních procesů a vlastností nádorového onemocnění.
MUDr. Milan Brychta
Onkologická klinika 3. LF UK a FNKV Praha
