V posledních letech dochází v možnostech léčby roztroušené sklerózy k významnému pokroku. Kromě nových léčiv prokazujících vysokou účinnost u pacientů s relaps remitentní roztroušenou sklerózou jsou k dispozici i léky pro formy roztroušené sklerózy, které byly ještě nedávno neovlivnitelné – okrelizumab pro primárně a siponimod pro sekundárně progresivní formu.
Pro relaps remitentní formu je nyní k dispozici 10 účinných látek modifikujících průběh onemocnění a další jsou ve fázi klinických studií. Onemocnění můžeme ovlivnit nasazením specifické léčby u velké části pacientů a v případech vysoce aktivní roztroušené sklerózy (RS) a/nebo při přítomnosti prognosticky nepříznivých faktorů zahájit léčbu vysoce účinnou terapií již v počátku, což může tuto aktivitu zastavit a zmírnit riziko trvalých nezvratných následků. Výběr léku ovlivňuje mechanizmus účinku, zvážení poměru benefitu a rizika léčby podle aktivity nemoci, komorbidit, ale i životní styl či plánování rodiny. Cílem článku je seznámit čtenáře s možnostmi zahájení léčby, ale i zmínit spektrum léků, které jsou v současné době k dispozici, a nastínit strategie a základní principy dlouhodobé léčby RS.
Patofyziologie onemocnění
RS je onemocnění postihující centrální nervový systém (CNS). Postižena je dominantně bílá hmota se ztrátou myelinu a následným postižením axonů – proto je řazeno mezi takzvaná demyelinizační onemocnění –, dochází ale
i k postižení šedé hmoty. K rozvoji onemocnění je předpokládanou podmínkou souběh zevních rizikových faktorů (hlavně prodělaná infekce virem Epsteina a Barrové, nízká hladina vitamínu D, kouření) a geneticky podmíněné susceptibility (např. určitý genotyp human leukocyte antigen). Přesná patogeneze není známa – zatímco v počátku onemocnění je hlavním mechanizmem zánět, v pozdější fázi jsou nastartovány neurodegenerativní děje, které pak již probíhají samostatně.
Podle průběhu onemocnění se RS dělí na formy relaps remitentní a progresivní. Přibližně 85 % pacientů trpí v prvních 10–20 letech právě relaps remitentní formou. V průměru po 19 letech dochází u části pacientů s původně relaps remitentní formou k přechodu do sekundárně progresivní formy, kdy již není dominující akutně vzniklé skokové zhoršení (ataky – synonymum relapsy)s následnou remisí příznaků,jako u formy relaps remitentní, ale dochází i k progresi, kdy se neurologický nález zhoršuje pozvolna, bez závislosti na eventuálních atakách a nedochází
k trvalému zlepšení a stabilizaci neurologického nálezu (remisi), jako je tomu u relaps remitentní formy. Přechod relaps remitentní v sekundárně progresivní formu je kontinuální proces, kdy dochází k „vyhasínání“ zánětu a spíše dominující neurodegeneraci. Asi 15 % pacientů trpí od počátku onemocnění formou primárně progresivní, u které nedochází k atakám, ale pozvolnému trvalému zhoršování neurologického nálezu.
Diagnostické přístupy
Diagnóza relaps remitentní RS se opírá o klinickou atakuonemocněnía potvrzení diseminace v čase a diseminace
v prostoru. V současné době používaná revidovaná McDonaldova diagnostická kritéria z roku 2017 vyžadují přítomnost nejméně jedné ataky – monofázické klinické epizody s pacientem uváděnými symptomy nebo objektivním nálezem typickým pro RS, odpovídající akutní zánětlivé demyelinizační příhodě v CNS (nejčastěji poruchy hybnosti, parestezie a/nebo hypestezie, jednostranná retrobulbární bolest s ipsilaterální poruchou zraku, porucha rovnováhy, dvojité vidění, ale i mnoho dalších).
Ataka se obvykle rozvíjí v řádu hodin až dnů a trvá alespoň 24 hodin.
Diseminace v prostoru je splněna jednou nebo více T2 hyperintenzními lézemi na magnetické rezonanci (MR) charakteristickými pro roztroušenou sklerózu ve dvou nebo více následujících oblastech CNS: periventrikulární, kortikální nebo juxtakortikální, infratentoriální, míšní.
Diseminace v čase je definovánapřítomností gadolinium vychytávající a gadolinium nevychytávající léze v kteroukoliv dobu nebo novou T2 hyperintenzní nebo gadolinium vychytávající lézí na další MR v porovnání s počáteční MR. Jako substituci pro požadavek diseminace v čase lze použít nález oligoklonálních pásů v likvoru (alespoň o dva více než
v séru). Tato nejnovější kritéria umožňují stanovit diagnózu již po prvním klinickém příznaku, což reflektuje snahu
o co nejčasnější určení diagnózy a nasazení léčby, na druhou stranu odlišuje RS jako chronické onemocnění od monofázických demyelinizačních onemocnění.
K posouzení neurologického postižení se užívá škála EDSS (Expanded Disability Status Scale), takzvaná Kurtzkeho škála. V té je škálován stupeň neurologického postižení v sedmi funkčních segmentech – zrakovém, kmenovém, pyramidovém, mozečkovém, senzitivním, sfinkterovém – a orientační hodnocení kognitivního postižení a únavy. Při těžším postižení je rozhodujícím faktorem škály mobilita a soběstačnost.
Aktuální léčebné přístupy
Hlavní současnou terapeutickou možností je ovlivnění zánětu imunoterapií, reziduální změny a neurodegeneratvní procesy jsou zatím farmakologicky minimálně ovlivnitelné. Efektivní léčba by měla být zahájena co nejdříve, tedy ve fázi, kdy probíhají ovlivnitelné zánětlivé změny s cílem zastavení nebo alespoň zmírnění nezvratných destruktivních změn v CNS.
V terapii atak roztroušené sklerózy se užívají v naprosté většině případů infuze methylprednisolonu (obvykle
3–6 gramů), při atakách refrakterních na kortikoidy plazmaferéza. V dlouhodobé léčbě užívaná imunoterapie je označována jako disease modifying drugs therapy (DMT).
Dlouhodobá imunoterapie RS – disease modifying therapy
V současné době lze v České republice schválené DMT dělit do více kategorií:
- monoklonální protilátky (natalizumab, okrelizumab, ofatumumab a alemtuzumab),
- perorální preparáty (fumaráty – dimethylfumarát; modulátory sfingosin-1-fosfátových [S1P] receptorů (fingolimod, siponimod), dále teriflunomid a kladribin,
- injekční (subkutánní a intramuskulární) terapie (rekombinantní lidský interferon β-1b, rekombinantní lidský interferon β-1a a glatiramer acetát).
Jednotlivé DMT se liší mechanizmem účinku, frekvencí a závažností eventuálních nežádoucích účinků, způsobem aplikace a dalšími proměnnými (tabulka 1).
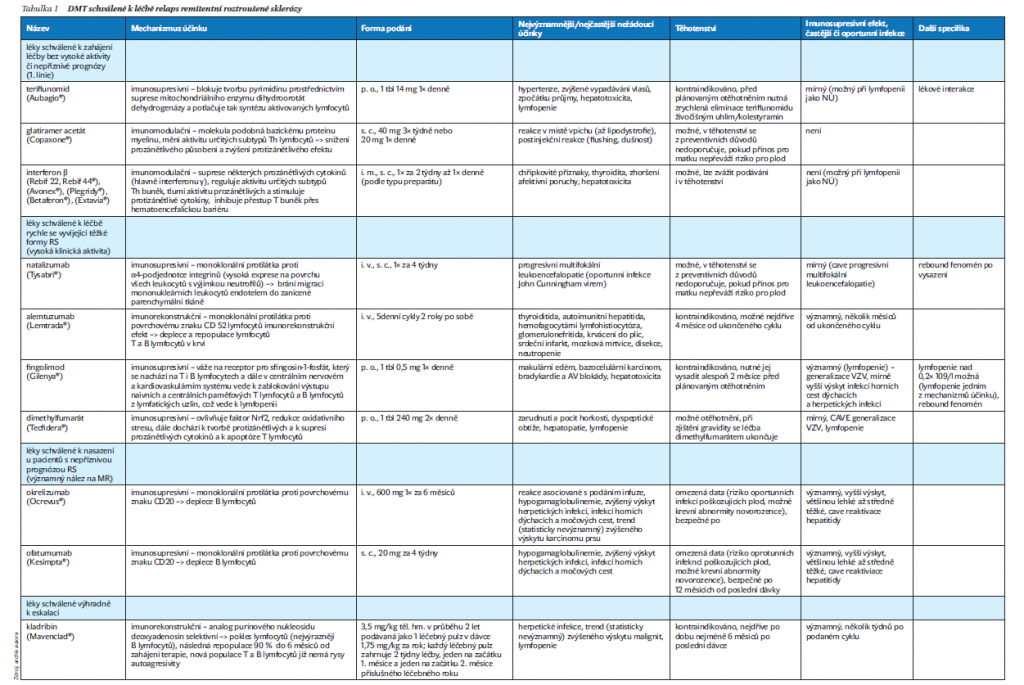
Dostupné práce srovnávající účinnost jednotlivých DMT jsou založeny na omezeném počtu randomizovaných kontrolovaných studií, nepřímých srovnáních mezi jednotlivými studiemi, observačních studiích a klinických zkušenostech. Účinnost také může být posuzována podle odlišných parametrů (snížení počtu atak, časové oddálení progrese, aktivita na MR, kognitivní deficit a další). Proto je přesné porovnání účinnosti DMT obtížné a v účinnosti se jistě liší jak interindividuálně, tak podle fáze a fenotypu RS, porovnání účinnosti tedy nemusí být přesné. Jako vysoce účinná terapie (high-efficacy therapy – HET) jsou označovány monoklonální protilátky (natalizumab, okrelizumab, ofatumumab a alemtuzumab) a podle některých autorů i kladribin.
Většina autorů se shoduje, že střední účinnost mají modulátory receptorů S1P a fumaráty. Nejnižší účinnostmají teriflunomid a nejstarší DMT – injekční interferony a glatiramer acetát. Je nutné si uvědomit, že byť se na novějších DMT objevují nežádoucí účinky v celkovém počtu méně často, mohou být významně závažnější. Většina z této léčby má podle mechanizmu účinku různý stupeň imunosupresivního účinku a setkáváme se mimo jiné s větším rizikem
i oportunních infekcí.
Léčba DMT je také poměrně finančně náročná (i u nejlevnějších DMT se roční náklady pohybují v řádu statisíců korun). Původně byl preferován koncept takzvané eskalační strategie léčby, kdy je účinnější terapie (nazývaná jako léky jedenapůlté nebo druhé linie) zahájena až po selhání (myšleno ataka vyžadující léčbu methylprednisolonem) léků takzvané prvé volby (interferony, glatiramer acetát, teriflunomid).
Nové práce ale potvrzují předpoklad, že právě časné nasazení vysoce účinné terapie, zejména u pacientů s vysokou aktivitou choroby v počátku (dvě a více atak v jednom roce, významný nebo zhoršující se nález na MR) nebo
s přítomností nepříznivých prognostických markerů (mimo jiné MR ložiska infratentoriálně či v míše) je pro další vývoj onemocnění zásadní a oddálení jejich nasazení může vést k promarnění terapeutického okna, kdy je RS nejlépe ovlivnitelná. Proto byl zaveden koncept indukční strategie léčby, kdy u těchto rizikových pacientů je při dostatečné farmakovigilanci zaváděna HET na počátku diagnózy. Tuto léčebnou strategii zohledňují indikační omezení vydávaná Státním ústavem pro kontrolu léčiv, která následně využívají plátci zdravotní péče k úhradě vlastní terapie.
Výběr DMT, zahájení léčby, sledování účinnosti a nežádoucích účinků
V klinické praxi se můžeme setkat jak se situací,že je u pacienta diagnóza nově stanovena (typicky po první atace), ale i s pacienty s již diagnostikovanou RS, kteří z jakýchkoliv důvodů dosud na léčbě DMT nejsou.
U pacientů s nově diagnostikovanou RS po první atace můžeme podle indikačních omezení úhrady nasadit léky první linie – interferony β, glatiramer acetát, teriflunomid. V případě přítomnosti nepříznivých prognostických markerů (MR ložiska infratentoriálně či v míše) je možné léčbu zahájit ofatumumabem či okrelizumabem. V případě rychle se vyvíjející těžké formy RS (dvě a více atak za rok s prokázanou aktivitou i na MR) je možné časné nasazení léků vyšší linie.
U pacientů s dříve diagnostikovanou RS, kteří dosud nebyli na léčbě DMT, je nutné prokázat ataku v posledních
1–2 letech (liší se podle jednotlivých DMT) – u neléčeného pacienta s diagnostikovanou RS, u kterého se v posledních letech ataky nevyskytují, a není tedy prokázána aktivita onemocnění, indikační omezení úhrady neumožňují nasazení DMT.
Pokud pacient neodpovídá na léčbu první linie (typicky ataka přeléčená methylprednisolonem, u některých DMT stačí i pouze aktivita na MR), povolují indikační omezení úhrady eskalaci léčby na léky druhé linie. V případě zahájení léčby okrelizumabem či ofatumumabem se změna jako eskalace neoznačuje, protože dochází ke změně na DMT podobné účinnosti.
Pochopitelně ne ve všech situacích je pro pacienta optimální možná léčba podle indikačních omezení a může pro něj být nejlepší možností DMT, u níž tato omezení nesplňuje. V těchto případech je možné léčbu zahájit pouze po předchozím schválení revizním lékařem pojišťovny.
Před zahájením léčby je tedy nutné minimalizovat rizika, jako přítomnost latentní infekce, možné zhoršení probíhající autoimunity, přítomnost maligního onemocnění. Nedávná pandemie také akcentovala omezení účinnosti vakcinace pacientů léčených HET a nutnost správného načasování očkování a léčby. Rizika léčby je nutné v jejím průběhu kontinuálně sledovat a vyhodnocovat.
Cíle léčby DMT definuje koncept NEDA (no evidence of disease activity). Různé verze tohoto konceptu uvádějí jako optimální cíl léčby nepřítomnost (1) průkazu klinické aktivity, tedy nepřítomnost atak, (2) progrese disability (více než 1 bod na škále EDSS za 3–6 měsíců), (3) aktivity na magnetické rezonanci (žádné přibývající T2 hyperintenzní léze),
(4) atrofie mozku na magnetické rezonanci, (5) markeru rozpadu CNS – neurofilament, (6) kognitivního deficitu.
Při plánování nasazení DMT je nutné si uvědomit, že se jedná o dlouhodobou léčbu s horizontem pokračování v řádu několika desítek let. Zejména u indukční strategie léčby není zatím jednoznačně určeno, jestli vůbec a eventuálně
v jakých případech zvažovat deeskalaci na DMT s nižším rizikem závažných nežádoucích účinků. Tato deeskalace jistě může být zvažována pouze při prokázaném zastavení aktivity onemocnění a dlouhodobé stabilizaci onemocnění. Stejně tak zatím není jednoznačně zodpovězena otázka úplného vysazení DMT. V současné době probíhají studie bezpečnosti vysazení DMT u dlouhodobě stabilizovaných pacientů od 50 let věku (ve vyšším věku je obecně nižší zánětlivá aktivita RS).
Další aspekty léčby RS
Kromě imunoterapie je velmi důležitá jak farmakologická, tak nefarmakologická symptomatická léčba. Velmi důležitá je suplementace vitamínu D, rehabilitace a u velké části pacientů i psychologická léčba.
Přímí příbuzní pacientů s RS mají riziko rozvoje onemocnění kolem 3 %, v běžné populaci je výskyt pod 1 %. Proto je u příbuzných pacientů s RS vhodné minimalizovat rizikové faktory rozvoje RS – suplementací vitamínu D, zanechat kouření, do budoucna je u dětí pacientů s RS diskutována i vakcinace proti EBV.
MUDr. Martin Elišák, Ph.D.
Neurologická klinika 2. LF UK a FN Motol, Praha
