Zhoubné nádory jsou jednou z nejčastějších příčin zdravotních problémů a úmrtí v naší populaci. Vlivem vysoké incidence a prevalence se týkají široké veřejnosti a s nemocnými postiženými nádory se setkávají zdravotníci všech odborností. Určitě je proto vhodné mít alespoň základní orientaci v oblasti onkologie. V případě karcinomu prostaty se jedná o nejčastější zhoubný nádor u mužů dospělého věku, s incidencí kolem 70–80 případů na 100 000 obyvatel ročně. K tomu, aby bylo možné tento nádor léčit, je třeba pochopit základní principy jeho biologického chování, znát jednotlivá stadia onemocnění, základní prognostické faktory a s tím související možnosti léčby.
Článek shrnuje potřebné informace ve velmi stručném formátu s důrazem na léčebné možnosti dostupné v současnosti.
Biologické chování karcinomu prostaty
Prostata je pohlavní žláza, která se nachází na spodině pánve. Obklopuje prostatickou část močové trubice a má velmi úzký vztah ke dnu močového měchýře. Její vývody ústí po celé délce prostatické uretry, kde se zároveň nachází společné vývody dalších pohlavních žláz (semenných váčků) a varlat (chámovody). Samotnou tkáň prostaty tvoří zejména žlázy a jejich vývody, které obklopuje tkáň hladké svaloviny a pojivová tkáň. Uvedené struktury jsou obaleny vazivovým pouzdrem oddělujícím tkáň prostaty od okolí. Většina zhoubných nádorů prostaty pochází ze žláz (98 %), tudíž se klasifikuje jako adenokarcinom.
Ostatní nádory tvoří jen velmi malou část, a proto následující text bude věnován pouze adenokarcinomu. Z praktického hlediska je velmi důležité, že karcinom vzniká ve většině případů multifokálně (na několika místech najednou, nebo postupně), roste nejenom v podobě nádorových ložisek, ale i v různě uspořádaných pruzích. Dalším velmi významným faktorem je skutečnost, že v počátečních fázích roste velmi pomalu, což se odráží v rozhodování o pátrání po karcinomu u nemocných bez příznaků onemocnění s krátkou očekávanou délkou života. Podrobnosti o časné diagnostice, screeningu a rozhodovacích algoritmech překračují zadání tohoto článku.
Diagnostické postupy
Diagnóza se stanovuje pomocí histologického vyšetření tkáně prostaty při zvýšené hladině prostatického specifického antigenu (PSA) v krvi, nejčastěji odebraného při biopsii jehlou (transrektálně nebo transperineálně), nebo se jedná o náhodný nález při operacích prostaty z jiného důvodu (transuretrální resekce/enukleace prostaty, transvezikální prostatektomie). Nádor ohraničený v prostatě se nazývá lokalizovaný.
Pokud má dostatečně agresivní potenciál, tak časem přeroste přes vazivové pouzdro prostaty, a to velmi často v místech, kde téměř chybí (hrdlo močového měchýře, apex prostaty) nebo je oslabené (místo průchodu ductus ejaculatorii nebo nervů či cév do prostaty). Může se tak šířit do semenných váčků, spodiny močového měchýře, konečníku nebo stěny pánve a označuje se jako lokálně pokročilý.
Další z možností šíření je mízními cestami do uzlin v oblasti pánve, kde ale neplatí lateralizace. To znamená, že při nádoru na jedné straně mohou být postiženy uzliny na straně kontralaterální. Regionální uzliny se nacházejí kolem vasa iliaca interna et externa a presakrálně, přičemž postižení uzlin nad úrovní vasa iliaca communis se již považuje za vzdálené metastázy. Hematogenně se nádor šíří zejména do kostí, kde v počátečních stadiích metastáz postihuje preferenčně kosti se zachovanou kostní dření (osový skelet, lebka, sternum a žebra). Viscerální metastázy se vyskytují v játrech, plicích nebo mozku, vzácně pak i v jiných lokalizacích.
Nádory v uzlinách mimo pánev, v kostech nebo jiných orgánech se označují jako generalizovaný karcinom. Kromě potvrzení přítomnosti nádorových buněk se histologicky stanovují i další charakteristiky nádoru, a to zejména biologická agresivita, jejímž korelátem je Gleasonovo skóre (GS). Jelikož je nádorová tkáň heterogenní, mohou se v různých částech nádoru vyskytovat části s různou agresivitou a při popisu je nutno zmínit tu nejčastěji se vyskytující a zároveň i tu nejagresivnější charakteristiku. Pokud se vyskytuje jen jeden druh, použije se skóre jako součet dvou stejných čísel (např. 3 + 3). Jinak se uvede jako součet nejčastějšího a méně častého nálezu (např. 4 + 3, 3 + 5). Podle prognostického významu rozdělila Mezinárodní společnost pro urologickou patologii (International Society of Urological Pathology – ISUP) nálezy do prognostických skupin podle stupňů (tabulka 1). Platí, že čím vyšší stupeň, tím agresivnější nádor.
Další diagnostické postupy v rámci stanovení rozsahu onemocnění jsou mimo rámec tohoto článku. Pro orientaci v dalším textu je však nutno stručně zmínit, že lokalizovaný karcinom se pomocí aktuální TNM klasifikace (8. vyd. z roku 2017, česká verze z r. 2018) označuje jako T1–2 N0 M0, lokálně pokročilý T3–4 N0 M0 nebo Tx N1 M0 a generalizovaný jako Tx Nx M1. Lokalizované a lokálně pokročilé karcinomy se podle Evropské urologické společnosti (European Association of Urology – EAU) dále rozdělují do skupin podle rizika progrese a recidivy (tabulka 2).

Jelikož jsou pohlavní orgány pod hormonálním vlivem, lze karcinom prostaty, ale i nezhoubné zvětšení léčit přípravky, které mění hladiny pohlavních hormonů v krvi nebo přímo ve zdravé či postižené tkáni prostaty. Podle citlivosti k hormonům se pak nádory dělí na hormonálně senzitivní nebo rezistentní a v závislosti na hladině androgenů v krvi na kastračně senzitivní nebo rezistentní. To platí i v případě, že se nádorové buňky dostanou mimo prostatu (při postižení uzlin nebo vzdálených metastázách). Podrobnosti ohledně účinku jednotlivých látek budou uvedeny dále.
Léčba lokalizovaného onemocnění
Všechna stadia karcinomu prostaty tvoří heterogenní podskupiny, které nelze vždy přesně definovat a odlišit na základě primární diagnostiky. Mnoho důležitých skutečností zjistíme až v průběhu onemocnění. Jak již bylo uvedeno, nádor roste z počátku velmi pomalu, a předchozí údaje platí zejména u nádoru ohraničeném na žlázu, tzn. v lokalizovaném stadiu. Bylo zjištěno, že i když nádor v prostatě vznikne a má veškeré histologické parametry zhoubného onemocnění, neroste dále (nebo jen velmi pomalu), nešíří se mimo žlázu a neohrožuje postiženého muže na zdraví ani na životě. Nejzávažnějším úkolem je tak odlišit nositele nálezu s pomalým a bezpečným průběhem od pacienta, který vyžaduje aktivní léčbu. I když máme k dispozici mnoho informací a rozhodování bývá velmi přesné, vždy se pracuje s určitou pravděpodobností dalšího vývoje. Vlivem zmíněných vlastností lze u mužů s histologicky prokázaným karcinomem prostaty a velmi malou pravděpodobností růstu a progrese stav jen sledovat, a neohrozit tak postiženého nežádoucími účinky případné léčby. Postup se nazývá aktivní sledování a zahrnuje pravidelné klinické vyšetření, sledování hladiny PSA v krvi a případné opakování zobrazovacích vyšetření (obvykle magnetické rezonance) a biopsie v určitých intervalech.
Kritéria pro zařazení pacientů do aktivního sledování, protokoly (obsah a intervaly) postupu a parametry pro změnu na aktivní léčbu se liší mezi pracovišti a zatím nebyl stanoven optimální postup. V České republice je nejvíce rozšířen protokol používaný ve studii PRIAS (Prostate Cancer Research International Active Surveillance), která byla vytvořena a je koordinována z Erasmus Medical Centre v Rotterdamu.
Aktivní léčba lokalizovaného onemocnění je indikována primárně u nemocných nevhodných k aktivnímu sledování, u mužů, kteří jej odmítají, nebo v případě, že se při aktivním sledování zjistí změna parametrů nádoru vyžadujících léčbu. Cílem aktivní léčby je vyléčení nádoru, provádí se tedy s kurativním záměrem. Je buď operační, nebo pomocíozařování.
Operační léčba zahrnuje odstranění prostaty, obvykle i se semennými váčky, a přerušení chámovodů s následným vytvořením spojení mezi hrdlem močového měchýře a pahýlem močové trubice nad úrovní pánevního dna (uretrovezikální anastomóza). Historicky se jednalo o velmi obtížný a rizikový výkon zatížený závažnými komplikacemi a nebylo vzácností i úmrtí pacienta při výkonu nebo po něm. Rozvoj znalostí o anatomických a funkčních souvislostech, vývoj technologií a zpřesnění předoperační diagnostiky vedly k velmi významnému snížení komplikací a rozšíření indikací operační léčby.
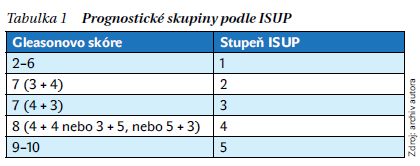
Od původního otevřeného přístupu se přešlo k minimálně invazivním (laparoskopii a roboticky asistovaným) výkonům. Původní dilema operační léčby s přísným výběrem pacientů a velkým rizikem komplikací vystřídal opačný problém, tzn. komu a jak indikovat operaci tak, aby přinesla očekávaný výsledek – odstranění orgánu postiženého nádorem bez rizika recidivy a závažných dlouhodobých následků. Díky potřebným zkušenostem a vybavení lze operaci provést i u nemocných, u nichž to dříve nebylo možné, jako například u velmi obézních, po předchozích operacích v podbřišku, stavu po transplantaci ledviny nebo jiných změnách v oblasti dolní poloviny břicha (obrázek 1).
Technické aspekty výkonu zahrnují operační přístup (trans/extraperitoneální), způsob ošetření dorzální žilní pleteně, zachování tkání obsahujících nervy a cévy důležité pro erekci a kontinenci, odstranění/ponechání semenných váčků, způsob vytvoření uretrovezikální anastomózy, zachování hrdla močového měchýře a pahýlu uretry a rekonstrukci septum rectovesicale. Tento výčet je důkazem toho, že výkon lze velmi přesně přizpůsobit onkologickým parametrům, morfologii pacienta a žlázy, a zajistit tak trvalé vyléčení s minimem následků.
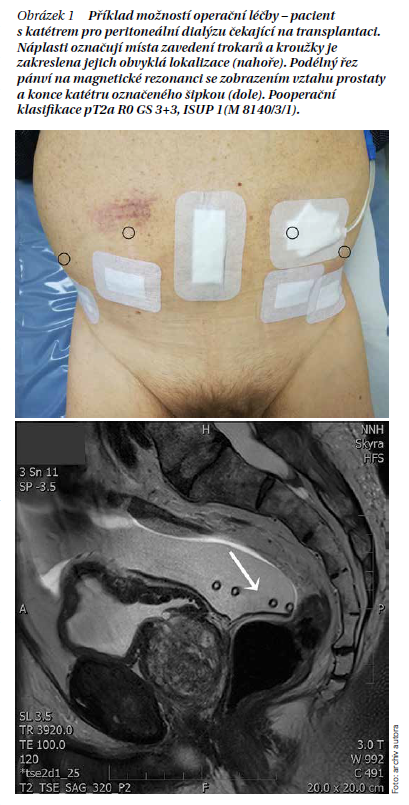
Léčba s použitím ozařování má několik modalit, mezi které patří fotonová radioterapie, protonová radioterapie, brachyradioterapie, stereotaktická radioterapie kybernetickým nožem a magnetickou rezonancí navigovaná radioterapie. Principem léčby radioterapií je aplikace dávky ionizujícího záření do stanoveného objemu tkáně. Aplikace dávek radioterapie se řídí podle nařízení ICRU 83 stanovením objemů dávek a technik jejich aplikace. Výše dávek radioterapie a indikace k radioterapii je stanovena radioterapeutickými standardy léčebné péče (MRS), kde jsou definované indikace a výše dávek. Popis jednotlivých způsobů léčby přesahuje rozsah článku, ale základním principem je aplikace záření do nádorové tkáně v takové dávce, která ji zničí a zároveň co nejvíce zachová strukturu a funkci postiženého orgánu a okolních struktur. Příklad plánování léčby zářením je na obrázku 2.
Podobně jako u operační léčby se díky vývoji znalostí o biologii nádoru, zpřesnění zobrazovacích metod a technologie záření rozšiřují možnosti kurativní léčby se současným významným snižováním dlouhodobých následků. Podobně jako u operační léčby existují faktory, jež rozhodují o provedení – způsob plánování a zaměření, zvyšování jednotlivých dávek (eskalace), snižování počtu sezení (hypofrakcionace), použití pomůcek pro zaměření (zrna) a prevenci nežádoucích účinků (spacery) a forma a délka podávání hormonální léčby. Opět je jasné, že současné možnosti přinášejí možnost individuálního přístupu ke každému nálezu a pacientovi.
Je důležité, že operační i radiační léčba jsou komplementární a oba způsoby mají stejný potenciál vyléčit nádor, avšak různými způsoby. Z podstaty obou metod vyplývá, že mohou mít z pohledu pacienta různé indikace, kontraindikace, způsoby hodnocení výsledků léčby a výskytu a závažnosti nežádoucích účinků, ale v obou případech je cílem trvalé vyléčení nálezu. Z praktického hlediska je nutno připomenout, že v případě nedostatečného vyléčení nádoru operací lze operovanou oblast ozářit, což však nejde opačně, protože je operace v ozářeném terénu zatížena velmi vysokým rizikem vzniku těžkých a doživotních následků.
Léčba lokálně pokročilého onemocnění
Stanovení rizikových skupin u lokalizovaného a definice lokálně pokročilého karcinomu pomáhají odlišit pacienty, u kterých by samotná lokální léčba v obvyklé podobě nemusela stačit k vyléčení nemocného. Samozřejmě i v těchto případech se léčba provádí s kurativním záměrem, ale očekává se, že jedním způsobem nelze nález vyřešit a je nutné použít kombinaci různých modalit.
Operační léčba je možná u nádorů ohraničených na prostatu (kategorie T1–2) se středním nebo vysokým rizikem progrese či recidivy nebo u lokálně pokročilého onemocnění (T3) s malým objemem a prorůstáním mimo prostatu v místě, kde po odstranění není riziko ponechání nádorové tkáně a poškození okolních struktur. Další podmínkou, podobně jako u lokalizovaného nádoru, je schopnost nemocného podstoupit výkon v celkové anestezii a klinicky nezjistitelné postižení místních uzlin nebo přítomnost vzdálených metastáz. V uvedených případech se kromě obvyklého rozsahu operace doplňuje i o operační odstranění regionálních uzlin (lymfadenektomii). Ta nemá podle současných poznatků kurativní záměr, ale je nejpřesnějším způsobem zjištění rozsahu onemocnění (stagingu). Na rozdíl od radioterapie není indikována žádná další celková léčba a další postup se stanovuje na základě histologických nálezů z odstraněné tkáně a dalšího sledování. Jak již bylo uvedeno, je potřeba pacienty v této situaci upozornit, že operační léčba nemusí stačit a je nutno dále pokračovat jinou modalitou, a to bezprostředně (adjuvantně) nebo v dalším průběhu (salvage) sledování po operaci.
Ozařování lokálně pokročilého karcinomu je možné i v případě většího objemu prorůstání mimo prostatu při klinicky negativním nálezu na uzlinách a po vyloučení vzdálených metastáz. Stejným způsobem jako u operace se ozařovaná oblast rozšiřuje i o oblast pánevních uzlin tak, aby byla ošetřena i případná klinicky nezjistitelná ložiska mimo prostatu. Na rozdíl od operační léčby je podle doporučení mezinárodních odborných společností radioterapie vždy doplněna o hormonální léčbu, jejíž forma a doba podávání se řídí rizikem recidivy a progrese. Z biologie základního onemocnění vyplývá, že léčba se má bez přerušení podávat minimálně 6–9 měsíců a maximálně 2–3 roky.
Léčba generalizovaného onemocnění
Vývoj v posledních letech se nezastavil jen u technologií lokální léčby, ale zahrnuje i systémovou léčbu určenou pro prevenci a léčbu nádoru, u nějž je nutno lokální léčbu doplnit o celkovou nebo není lokální léčba indikována kvůli celkovému rozsahu nemoci. Přes veškerý pokrok se však tato léčba nepodává s kurativním záměrem, ale proto, aby zmírnila příznaky, zabránila komplikacím a prodloužila dobu přežívání nemocných.
Základem léčby vzdálených metastáz je již mnoho desetiletí hormonální léčba. V dnešní podobě má dva způsoby – snížení hladiny mužských pohlavních hormonů v krvi (kastrace) nebo blokáda receptorů pro androgeny v nádorové tkáni. Obě možnosti vedou k omezení dostupnosti hormonů v nádoru, a tím ke zničení citlivých buněk nebo zastavení či zpomalení jejich růstu. Kastrace lze dosáhnout operačně (odstraněním tkáně varlat tvořící mužské pohlavní hormony) nebo chemicky. Operační kastrace je trvalá a nevratná, zatímco chemická může být trvalá nebo dočasná. V této indikaci se používají analoga hormonu uvolňujícího luteinizační hormon (LH-RH), která zpětnou vazbou utlumí stimulaci tvorby hormonů v hypofýze, nebo antagonisté LH-RH, jež zajišťují přímou blokádu tvorby hormonů. Kvůli tomu, že se jedná o bílkoviny s krátkým řetězcem, je nutné je podávat parenterálně v podkožních injekcích. Základní rozdíl mezi analogy a antagonisty spočívá v riziku vzniku přechodného zhoršení příznaků nádoru (bolesti, vyprazdňování moče, komprese míchy, hyperkoagulační stav) po podání analogů, což nenastává u antagonistů. Výhodou analog je na druhou stranu možnost použití depotních přípravků v intervalu 1–12 měsíců, což u antagonistů není možné, jelikož se musí podávat jednou za měsíc. Druhá možnost je blokáda receptorů pro androgeny. Zahrnuje preparáty, které se používají jen v rámci podpůrné či paliativní léčby (flutamid, bicalutamid), a novější přípravky (apalutamid, darolutamid, enzalutamid), jež působí komplexnějším způsobem a prokazatelně prodlužují přežívání a další parametry (čas do další progrese, zlepšení příznaků…). Souhrnně se novější přípravky nazývají antagonisté androgenního receptoru nebo přípravky zaměřené na androgenní receptor (androgen receptor targeting agents – ARTA). Lehce mimo uvedené mechanizmy účinku je látka abirateron acetát, jejímž mechanizmem účinku je blokáda tvorby pohlavních hormonů v kůře nadledvin a přímo v nádorové tkáni. Jelikož brání činnosti enzymů v nadledvinách, které souvisí i s mineralokortikoidy, musí pacienti v rámci prevence hypoladosteronizmu zároveň užívat prednison. Jako každá léčba, má i ta hormonální vedlejší účinky související s principem jejich působení v těle. Mezi nejzávažnější patří v dlouhodobém horizontu vznik nebo zhoršení metabolického syndromu, obezita, ztráta svalové síly a libida, osteoporóza a celkové zvýšení kardiovaskulárních rizik. Proto je u pacientů s hormonální léčbou potřeba sledovat nejenom aktivitu samotného nádoru, ale zároveň hodnotit a řešit případné následky celkové léčby.
Ze sledování pacientů s hormonální léčbou je známo, že po určité době dochází k progresi onemocnění i při kastračních hodnotách testosteronu v krvi, a nádor se tak stává kastračně rezistentní. Opět je z praktického hlediska nutno poznamenat, že tento stav může nastat i u pacientů bez generalizace, léčených hormonální léčbou. V mezinárodních doporučeních se zdůrazňuje trvalé ponechání hormonální léčby i v této situaci. Předpokládá se význam dlouhodobého až trvalého snížení hladiny androgenů. Systémová léčba u pacientů bez metastáz a s kastrační rezistencí zahrnuje v první řadě přípravky ARTA, v případě prokázaných metastáz se používá abirateron acetát, enzalutamid nebo chemoterapeutika ze skupiny taxanů (docetaxel). Výběr přípravku se řídí celkovým stavem pacienta, výsledky předchozí léčby a jejími potenciálními nežádoucími účinky. Díky velkým klinickým studiím je prokázáno, že existuje i možnost použití těchto přípravků po sobě či v kombinaci. V dalších stupních hraje roli i další taxan (kabazitaxel) a u pacientů s prokázanou mutací (homozygotní delece nebo závažné mutace genů pro reparaci DNA) se používají inhibitory enzymu poly (ADP-ribóza) polymerázy (PARP),z nichž jsou nejznámější olaparib a rukaparib.
Již v úvodu je uvedeno, že karcinom prostaty metastazuje přednostně do kostí. V minulosti proto byly hledány léky, které buď zabraňují dalšímu šíření nádoru do skeletu, nebo příznivě ovlivňují následky postižení kostí či nežádoucích účinků léčby. Tyto přípravky se souhrnně nazývají léčba zaměřená na kosti (bone targeted therapy). Patří mezi ně bifosfonáty, monoklonální protilátka proti RANKL (receptor activator of nuclear factor kappa-B ligand) s názvem denosumab a látka emitující α záření radium (Ra223).
Závěr
Komplexní charakter léčby karcinomu prostaty dává naději každému pacientovi, aby dostal péči odpovídající jeho stavu, a to v jakémkoliv stadiu onemocnění. Dosavadní vývoj v této oblasti, současný stav a nejbližší budoucnost zároveň přinášejí odborníkům účinné možnosti, jak nádor vyléčit nebo významně zasáhnout do jeho průběhu. Intenzivní výzkum a množství probíhajících klinických studií spolu s přibývajícími zkušenostmi umožňují významně zvýšit počty vyléčených mužů a zmírnit průběh nemoci u nevyléčitelných stavů. Možnosti jednotlivých modalit, jejich kombinace a návaznost se zdají téměř nekonečné, ale jen hluboké znalosti a vysoce odborný přístup mohou přinést ty správné výsledky.
prim. MUDr. Kamil Belej, Ph.D., FEBU, MBA
Urologické oddělení a Centrum robotické chirurgie
Ústřední vojenská nemocnice – Vojenská fakultní nemocnice, Praha
