Primární prevence je určena pro rizikové pacienty, kteří mozkovou příhodu dosud neprodělali, zatímco sekundární prevence je poskytována pacientům po prodělané ischemické cévní mozkové příhody (iCMP) nebo tranzitorní ischemické atace a zahajujeme ji co nejdříve, již v průběhu úvodní hospitalizace v iktovém centru. Řídíme se přitom podle aktuálních odborných doporučení. V následujícím textu uvádíme přehled léčebných postupů v sekundární prevenci iCMP doporučených na základě současných vědeckých poznatků. Je prokázáno, že včas zahájená a správně vedená sekundární prevence může snížit počet recidiv iCMP o třetinu až polovinu.
Ischemické cévní mozkové příhody (iCMP) patří mezi nejzávažnější onemocnění, vzhledem ke své vysoké incidenci (cca 2 tis./1 mil. obyvatel/rok) a častým následkům ve formě úmrtí nebo trvalé invalidity představují velmi významný medicínský i sociálně ekonomický problém. V případě překonání iCMP jsou pacienti navíc vystaveni vysokému riziku recidivy této nemoci – až 10 % ročně, z toho cca čtvrtina recidivuje již v prvním měsíci po příhodě. Proto je kromě neustálého zlepšování organizace akutní léčby iCMP velmi důležitá rovněž jejich soustavná prevence, která zahrnuje režimová a léčebná opatření, směřující k eliminaci ovlivnitelných rizikových faktorů.
Incidence iCMP
Ischemická CMP dominuje svou četností a závažnými následky mezi všemi neurologickými onemocněními. Drží si 2.–3. příčku mezi příčinami mortality v rozvinutých zemích a je nejčastější příčinou dlouhodobé invalidity. Incidence v České republice byla na začátku tisíciletí okolo 280 případů na 100 000 obyvatel za rok, v roce 2017 cca 211 případů a nadále pozvolna klesá. Podle údajů z cévních registrů mají pacienti po prodělané CMP nebo tranzitorní ischemické atace (TIA) až 8× vyšší riziko recidivy ve srovnání s běžnou populací.
Riziko recidivy iCMP
Výskyt recidiv se odhaduje na 5–10 % ročně, přičemž až ke čtvrtině recidiv dochází již v prvním měsíci po iniciální příhodě. Recidivující iCMP má přitom až dvojnásobnou mortalitu (41 %) než první příhoda. Zvláště vysoké riziko recidivy CMP hrozí pacientům s chronickou fibrilací síní a symptomatickou stenózou vnitřní karotidy ≥ 70 %. Kromě snahy o maximálně účinnou a dobře organizovanou akutní léčbu iCMP, jež je v současnosti v ČR prováděna ve vysoce specializovaných centrech, se musíme rovněž zaměřit na včasnou a správně vedenou sekundární prevenci iCMP, jež může snížit počet recidiv o 3–5 % ročně, tedy o třetinu až polovinu případů. Prevence iCMP zahrnuje soubor opatření s cílem korigovat ovlivnitelné rizikové faktory, jež vedou k rozvoji mozkové příhody.
Primární a sekundární prevence
Primární prevence je prováděna u pacientů, kteří dosud CMP neprodělali, s cílem zabránit jejímu vzniku. Sekundární prevence je určena pacientům, kteří již prodělali iCMP nebo TIA, s cílem zabránit recidivě. Správné vedení sekundární prevence iktu vychází ze současných odborných doporučení i platné legislativní úpravy pro péči o pacienty s akutní CMP v ČR.Odborná doporučení pro léčbu a prevenci iCMP zpracovává a aktualizuje Cerebrovaskulární sekce České neurologické společnosti ČLS JEP, vychází přitom především z aktualizovaných souborů doporučení European Stroke Organization (ESO) z let 2019–2022,doporučení Americké iktové asociace (AHA/ASA), australských Clinical Guidelines for Stroke Management (2017) a dalších odborných doporučení i nově publikovaných vědeckých poznatků.
Etiologické příčiny ischemické CMP, strategie sekundární prevence
Ischemická CMP je z hlediska příčin vzniku heterogenním onemocněním. Z etiologického hlediska dělíme iCMP nejčastěji podle obecně akceptovaných klasifikací TOAST (resp. SSS-TOAST) nebo ASCO.
Nejčastějšími příčinami iCMP jsou embolizace z kardiálního či jiného centrálního zdroje, následované onemocněním malých tepen (mikroangiopatie postihující perforující arterioly s následnými lakunárními infarkty) a aterosklerotickým postižením velkých krčních nebo intrakraniálních tepen (obrázek 1). Dále existuje řada vzácnějších příčin iCMP, do zvláštní skupiny se někdy řadí trombóza mozkových žil a splavů. U části příhod zůstává přes pečlivou diagnostiku příčina nejasná (kryptogenní iCMP, z nich cca 50 % tvoří tzv. ESUS – embolické iCMP nejasné etiologie).

K zásadám správné sekundární prevence přitom patří snaha o zjištění pravděpodobné etiologie iCMP u co nejvíce případů, a tedy o snížení podílu kryptogenních příhod. V průběhu iniciální hospitalizace pacienta s CMP nebo TIA proto provádíme co nejdříve všechna nezbytná vyšetření k upřesnění etiologie – kromě neodkladné výpočetní tomografie (CT) nebo magnetické rezonance (MR) mozku sem patří zejména zobrazení mozkových cév (CT angiografie, barevné duplexní ultrazvukové vyšetření extrakraniálních a intrakraniálních tepen, případně MR angiografie), monitorování EKG (následované obvykle dlouhodobějším telemetrickým sledováním v délce několika týdnů), kardiologické vyšetření a transtorakální nebo transezofageální echokardiografie (TTE, TEE), laboratorní screening včetně sledování glykemického profilu, glykovaného hemoglobinu a kompletního vyšetření lipidového spektra, koagulační vyšetření, u vybraných pacientů i vyšetření trombofilních stavů či markerů vaskulitid, systémových onemocnění a geneticky podmíněných syndromů. Výběr a rozsah pomocných vyšetření přizpůsobujeme pravděpodobným etiologickým činitelům iCMP u daného pacienta.
Podle výsledků těchto vyšetření pak optimalizujeme postup další sekundární prevence.
K léčebným metodám, užívaným v sekundární prevenci iCMP, patří režimová a dietní opatření, eliminace známých rizikových faktorů (medikamentózní, ve vybraných případech i intervenční) a také specifická antitrombotická léčba – antiagregační nebo antikoagulační, v závislosti na etiologii iCMP.
Režimová a dietní opatření
Režimová a dietní opatření v sekundární prevenci iCMP jsou v principu shodná s primární prevencí kardiovaskulárních onemocnění, ale měla by být uplatňována s větší důsledností.
Patří k nim doporučená středomořská dieta s vyšším podílem zeleniny a ryb, konzumací panenského olivového oleje nebo ořechů. Zvýšení podílu nenasycených mastných kyselin je přitom preferováno před prostým snižováním obsahu tuků v jídle. Pacienti po iCMP s hypertenzí by měli omezit svůj denní příjem sodíku nejméně o 1 g, což představuje snížení denního přídělu soli o 2,5 g. Jedincům s vyšší hodnotou body mass indexu (BMI) se doporučuje redukční dieta. Naopak běžně nedoporučujeme doplňky stravy charakteru vitaminů – antioxidantů ani hormonální substituční terapii u žen.
Všem pacientům po iCMP by měl být naléhavě vysvětlen zákaz kouření cigaret (je vhodné vyvarovat se i pasivního kouření), dále i zákaz nadměrné konzumace alkoholu (více než jedna jednotka denně u žen a dvě jednotky denně u mužů). K odvykání kouření lze využít dostupnou farmakologickou odvykací léčbu s náhradami nikotinu, bupropionem nebo vareniklinem.
V rámci režimových opatření doporučujeme i pravidelnou aerobní aktivitu (cvičení) – nejméně po dobu 10 minut 4× týdně s dosažením střední intenzity fyzické zátěže, nebo po dobu 20 minut 2× týdně s dosažením vyšší fyzické zátěže. U pacientů s celodenním sedavým režimem je doporučeno každou půlhodinu přerušit sezení postavením či pohybem v trvání 3 minut.
Konečně součástí režimových opatření v sekundární prevenci iCMP je i diagnostika a léčba poruch dýchání ve spánku (zejména obstrukční spánkové apnoe – OSA, po které bychom měli aktivně pátrat formou polysomnografie). V léčbě OSA je doporučeno využít dýchání s kontinuálním pozitivním tlakem v dýchacích cestách (continuous positive airway pressure – C-PAP).
Korekce ovlivnitelných rizikových faktorů iCMP
Kontrola krevního tlaku a léčba hypertenze
Podle metaanalýzy literárních dat z registrů i farmaceutických studií (např. PROGRESS) snižuje korekce krevního tlaku (TK) v sekundární prevenci výskyt recidivy všech kardiovaskulárních příhod cca o 10 % s každým poklesem systolického TK o 5 mm Hg.
U všech pacientů po CMP nebo TIA musí být v prvních 3–4 dnech pravidelně kontrolován TK. Krevní tlak se doporučuje snižovat po odeznění akutní fáze iktu (po stabilizaci neurologického nálezu) u všech pacientů, kteří mají TK ≥ 140/90 mm Hg. Doporučená cílová hodnota TK je 130/80 mm Hg nebo nižší. Správně vedená antihypertenzní léčba snižuje i riziko mozkového krvácení při dlouhodobé léčbě antiagregační nebo antikoagulační terapií. Diskutován je také možný přínos pro zpomalení progrese kognitivního deficitu u pacientů s onemocněním malých tepen. Určitá opatrnost při korekci TK je vhodná u pacientů s chronickou okluzí velkých magistrálních tepen, kde by mohla být hypotenze příčinou mozkového low-flow infarktu. Výběr antihypertenzní medikace má být individuální podle farmakologických vlastností léčiv a komorbidit pacienta. Mezi léky s evidencí o přínosu pro snížení recidivy iCMP patří inhibitory angiotensin konvertujícího enzymu (ACE), thiazidová diuretika a inhibitory angiotensinových receptorů (sartany).
Diabetes
Po prodělané iCMP nebo TIA má být pacientům vždy pravidelně kontrolována glykemie. V rámci vstupní hospitalizace je doporučeno i vyšetření denního glykemického profilu a glykovaného hemoglobinu (HbA1c). Je-li zjištěn diabetes, má být korigován individualizovanou farmakoterapií – cílem je u většiny pacientů dosáhnout HbA1c ≤ 7 % (s předpokládaným dopadem zejména na onemocnění malých tepen), dále pak u pacientů se srdečním selháním nebo ledvinným onemocněním by měla být podávána kombinace metforminu a SGLT2 inhibitorů (gliflozinů). Přidání agonistů GLP-1 receptoru (semaglutid, dulaglutid, liraglutid, exenatid, lixisenatid) k metforminu je dalším moderním postupem, který má prokazatelný vliv na snížení rizika vzniku iCMP (až o 17 %). Některá odborná doporučení je proto považují za indikovaná u všech diabetiků po prodělané iCMP, bez ohledu na hodnotu glykovaného hemoglobinu. U pacientů s diabetem, s inzulinovou rezistencí a bez srdečního selhání je doporučena léčba pioglitazonem.
Dyslipidemie
Na základě metaanalýzy klinických studií je zřejmé, že snížení LDL cholesterolu o 1 mmol/l snižuje významně riziko vzniku iCMP. Dále bylo prokázáno, že intenzivnější snížení LDL-C vede k výraznější redukci počtu iCMP, přičemž se nezvyšuje riziko krvácení ani progrese kognitivního deficitu. U všech pacientů, kteří prodělali nekardioembolický iktus, je doporučena následná léčba statinem, včetně těch, u nichž nebyla zjištěna významná dyslipoproteinemie. V souladu s doporučením AHA/ASA i ESO je indikováno podávání atorvastatinu v dávce 80 mg/den (nebo ekvivalentních dávek jiných statinů – simvastatinu, rosuvastatinu, lovastatinu a dalších). Cílem této léčby je snížit hladinu LDL cholesterolu pod 1,8 mmol/l. Významnou roli mohou mít i nelipidové účinky statinů – protizánětlivé, antitrombogenní a antioxydační. Podle doporučení Evropské kardiologické společnosti je u pacientů po iCMP doporučena ještě razantnější redukce LDL-C pod 1,4 mmol/l. U pacientů, kteří přes agresivní léčbu statinem mají nadále zvýšenou koncentraci LDL cholesterolu nebo po podání statinů mají klinické známky myopatie či jiné nežádoucí projevy, je doporučeno podávání ezetimibu (v kombinaci se statiny, zejména u diabetiků a vysoce rizikových pacientů) nebo inhibitorů proprotein konvertázy subtilisin-kexin typu 9 (PCSK9) (alirokumab, evolokumab) či inklisiranu.
Specifická léčba
Antiagregační terapie
Antiagregancia snižují riziko recidivující ischemické CMP nekardioembolické etiologie (až o 18 %), výskyt dalších vaskulárních příhod (hlavně infarktu myokardu, až o 21%) a celkovou mortalitu. Antiagregační terapie je proto doporučena všem pacientům po ischemické CMP nebo TIA, kteří nevyžadují antikoagulaci. Zahájení antiagregační léčby by mělo následovat ihned po vyloučení hemoragie pomocí CT vyšetření (nejpozději do 12–24 hodin od vzniku iCMP), u pacientů po intravenózní trombolýze se zahajuje až po uplynutí 24 hodin a kontrolním CT nebo MR vyšetření mozku, jež vyloučí hemoragickou transformaci.
V rámci antiagregační monoterapie lze podat buď samotný klopidogrel (75 mg/den, iniciálně může být podána nasycovací dávka 300 mg), nebo samotná ASA (50–325 mg/den, prakticky se využívá dávka 100–200 mg/den). V prvních 3 měsících po příhodě by se neměla ASA podávat ve formě enterosolventních tablet.
Alternativně by bylo možno použít ještě tikagrelor (2× 90 mg/den) nebo cilostazol, které ale nemají evidenci o lepším efektu než ASA nebo klopidogrel v prevenci CMP a nejsou u nás v této indikaci registrovány. Kombinace ASA a klopidogrelu v časném období (10–21 dnů) prokázala vyšší efektivitu u vysoce rizikových pacientů po TIA (ABCD2 skóre > 4) nebo po CMP s lehčím nálezem (skóre NIHSS < 4 body). Dlouhodobější podávání této kombinace se ale po ischemické CMP nedoporučuje, s výjimkou pacientů se specifickými indikacemi (nestabilní angina pectoris nebo non-Q infarkt myokardu, nedávný koronární stenting – až po dobu 9 měsíců, karotický stenting – po dobu 1–3 měsíců, dále po CMP či TIA v důsledku 70–99 % stenózy velké intrakraniální tepny po dobu do 90 dnů).
Další potenciálně prospěšnou krátkodobou kombinací antiagregačních léků po lehké ischemické CMP nebo vysoce rizikové TIA je ASA a tikagrelor, s dobou podávání do 30 dnů (tabulka 1).
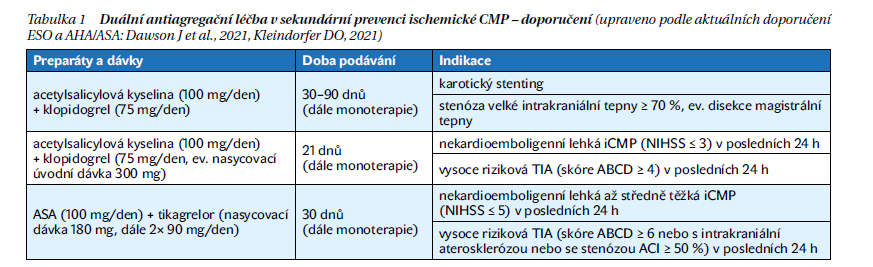
Zatím nezodpovězenou otázkou je, zda je přínosné u většího množství pacientů testovat laboratorně rezistenci vůči základním antiagregačním lékům, nebo nasazovat tuto léčbu „naslepo“, jak je tomu většinou nyní. U nemocných, kteří měli recidivu CMP již na antiagregační terapii, je vždy nezbytné nové posouzení patofyziologie a rizikových faktorů. Nenavyšujeme u nich dávkování stávajícího antiagregancia, ale pokud možno je vyměníme za látku s jiným mechanismem účinku. Posílení efektu antitrombotické léčby v sekundární prevenci iCMP by do budoucna mohli přinést antagonisté faktoru XIa ve formě add-on terapie, se kterými v současnosti probíhají klinické studie.
Antikoagulační terapie
Přibližně 25–30 % iCMP má kardioembolickou etiologii, další část se ještě může skrývat mezi kryptogenními embolickými příhodami (ESUS). Proto je kladen velký důraz na diagnostiku kardioembolických zdrojů u všech pacientů s iCMP nebo TIA, včetně transtorakální i transezofageální echokardiografie a dlouhodobého holterovského monitorování srdečního rytmu (MDT). Mezi nejčastější zdroje kardioembolizací patří fibrilace nebo flutter síní, dále přítomnost trombu v levé síni nebo komoře, chlopenní náhrady a vady, aterosklerotické pláty v ascendentní aortě a další vzácnější příčiny.
Roční riziko iCMP u pacientů s FS je 2–10 %, v závislosti na dalších rizikových faktorech. U pacientů s FS po prodělané ischemické CMP nebo TIA je v rámci sekundární prevence indikována trvalá perorální antikoagulační terapie (pokud nemá pacient k této léčbě jednoznačnou kontraindikaci). Podle doporučení ESO i ESC jsou preferována přímá antikoagulancia, nezávislá na působení vitaminu K (DOAK) – dabigatran, apixaban, rivaroxaban a edoxaban, která nevyžadují pravidelné laboratorní kontroly koagulace a jsou minimálně stejně účinná (spíše účinnější i bezpečnější) pro prevenci iCMP ve srovnání s warfarinem.
Výběr konkrétního DOAK provádíme podle předpokládané efektivity a bezpečnosti u daného pacienta s přihlédnutím k jeho komorbiditám. Opakované diskuze probíhají okolo optimální doby zahájení antikoagulační léčby po prodělané iCMP – aktuální doporučení ESO navrhuje zahájit antikoagulaci 3.–4. den po lehké CMP (průměr infarktu < 1,5 cm), 7. den po středně těžké a 14. den po těžké CMP. Při časném nasazení perorálních antikoagulancií podle tohoto schématu se nemusí předtím pacientům podávat nízkomolekulární hepariny. Opatrnosti je třeba pouze u pacientů se závažnými komorbiditami, zvyšujícími riziko krvácení, opakovanými pády a špatnou compliance. Na druhou stranu podle dat ze studií je největší prospěch z antikoagulace u pacientů nad 85 let věku.
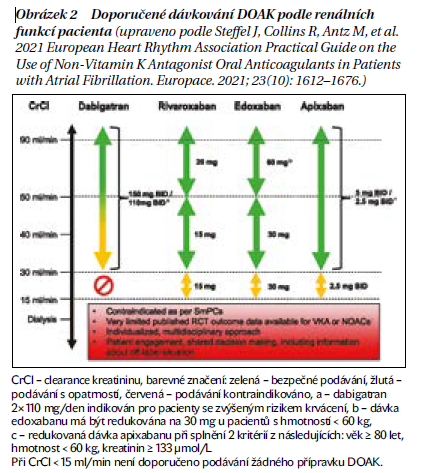
Velmi důležité pro prevenci recidivy iCMP je správné dávkování DOAK (obrázek 2). Nejméně 1× ročně by měly být monitorovány ledvinné funkce u všech antikoagulovaných pacientů.
Dalšími specifickými subkategoriemi iCMP, u kterých může být indikována antikoagulační léčba, jsou kardioemboligenní příhody bez spojitosti s fibrilací síní, avšak s vysokým rizikem recidivy (prokázaný trombus v levé komoře, stav po infarktu myokardu přední stěny se sníženou ejekční frakcí pod 50 %, kardiomyopatie s prokázaným trombem levé síně nebo komory, nebo s dysfunkcí levé komory) – u těchto nemocných je doporučena antikoagulace warfarinem s cílovým, INR 2,0–3,0, nejméně po dobu 3 měsíců. Dále mohou být k antikoagulační léčbě doporučeni pacienti s ateromy aorty, fuziformním aneuryzmatem bazilární tepny, konečně i s cervikální arteriální disekcí (zde je podle vědeckých dat rovnocennou alternativou podávání antiagregační léčby).
Dříve akceptované alternativní podávání antiagregace v sekundární prevenci CMP u pacientů s FS, s nízkým rizikem nebo s kontraindikací antikoagulace se již v současnosti nedoporučuje, protože v klinických studiích nevedlo ke snížení recidiv CMP, ale pouze ke zvýšenému počtu krvácivých komplikací. Opakovaně diskutovaným tématem je také znovunasazení antikoagulační léčby u pacientů s FS, kteří utrpěli intracerebrální krvácení. Současná doporučení nabádají k individuálnímu zvážení přínosů a rizik u každého takového pacienta. Pravděpodobně by antikoagulace již neměla být znovu nasazena u pacientů s atypickým (nikoli hypertenzním) intracerebrálním krvácením.
Intervence v sekundární prevenci iCMP
Karotické endarterektomie a angioplastiky
Karotická endarterektomie (CEA) nebo angioplastika (ev. se stentingem) (CAS) je podle platných doporučení v sekundární prevenci iCMP indikována u pacientů se stenózou a. carotis interna (ACI) 50–99 % (v měření podle NASCET), jež je považována za pravděpodobnou etiologickou příčinu prodělané příhody – ipsilaterální k proběhlé hemisferální symptomatologii, optimálně v prvních 2 týdnech po mozkové příhodě. S rostoucím odstupem výkonu od iniciální příhody se přínos pro pacienta významně snižuje, přibližně po 3 měsících je již riziko prakticky shodné s asymptomatickými pacienty.
Nejsilnější doporučení na základě vědecké evidence je pro intervenci u pacientů se 70–99% stenózou ACI s tím, že metodou volby je chirurgická endarterektomie (CEA). CAS může být zvažována jako alternativa u pacientů s horší chirurgickou dostupností stenózy nebo zvýšeným operačním rizikem a dále u pacientů mladších 70 let.
Slabší evidence ve prospěch CEA je u pacientů se středně těžkou stenózou ACI 50–69 %. Indikace může být provedena na základě vyšetření barevnou duplexní ultrasonografií (obrázek 3), CT nebo MR angiografií, optimální je kombinace dvou neinvazivních metod. Důraz je kladen na provádění těchto intervencí pouze v centrech s nezávisle monitorovanou frekvencí perioperačních komplikací (všechny CMP a úmrtí za hospitalizace) méně než 4 %. U pacientů se stenózou ACI < 50 % není žádná intervence indikována. Pacienti mají být vždy ponecháni na antiagregační terapii jak před, tak i po CEA – nejlépe tím lékem, který užívali dlouhodobě. Pacientům indikovaným k provedení CAS má být již před výkonem podána kombinace klopidogrelu a ASA a následně podávána ještě nejméně 1 měsíc po výkonu.
Další intervence s cílem eliminace embolického zdroje nebo zlepšení perfuze
Intervenci u pacientů se symptomatickou stenózou extrakraniálního úseku vertebrální tepny ≥ 50 % (angioplastiku, stenting, výjimečně operaci) je možné v současnosti zvažovat pouze v případech, kdy recidivují symptomy iCMP nebo TIA navzdory optimální medikamentózní léčbě. Při první prezentaci TIA nebo iCMP u pacientů se stenózou AV je preferována důsledná konzervativní léčba před intervencí.
Podobně je tomu také u stenózy velké intrakraniální tepny – i zde je na základě současných poznatků preferována medikamentosní léčba (její součástí by měla být duální antiagregace kyselinou acetylsalicylovou a klopidogrelem po dobu 3 měsíců). Pouze u intrakraniální stenózy ≥ 70 % při selhání optimální medikamentózní léčby může být zvážena angioplastika a/nebo stenting.
U pacientů s kryptogenní CMP a vysoce rizikovým otevřeným foramen ovale (středně velký až velký pravolevý zkrat, aneuryzma nebo hypomobilita septa) je vhodné zvážit jeho endovaskulární uzávěr – především u mladších pacientů (ve věku 18–60 let) s absencí jiné etiologie iCMP – pro přesnější stanovení rizika je možné využití skóre RoPE (Risk of Paradoxical Embolism Score). Diagnostickým standardem pro detekci pravolevého srdečního zkratu je kontrastní transezofageální echokardiografie, užitečné může být i kontrastní transkraniální dopplerovské vyšetření. Konečné rozhodnutí by mělo být na pacientovi, který musí být dobře informován i o rizicích tohoto výkonu, včetně možnosti následného vzniku fibrilace síní. Jinak je jako terapeutický standard zpravidla podávána antiagregační léčba.
Dalšími možnostmi intervencí v sekundární prevenci CMP, u nichž ale zatím neexistuje jednoznačná evidence o lepší účinnosti oproti konzervativní léčbě, jsou uzávěry ouška levé srdeční předsíně nebo selektivní indikace k extra- intrakraniálnímu bypassu u chronické karotické okluze, u pacientů s vyčerpanou funkční vazomotorickou rezervou v povodí uzavřené ACI.
Závěr
Rychle zahájená a správně vedená sekundární prevence iCMP může významně snížit riziko recidivy mozkové příhody u všech pacientů. Její efektivita se zvyšuje při úspěšné indentifikaci etiologických faktorů, které vedly ke vzniku iniciální iCMP nebo TIA. Při zahájení sekundární prevence, v její časné fázi a také u komplikovaných pacientů s kumulací rizik má klíčovou úlohu neurolog s erudicí v cerebrovaskulární péči – proto je cílem organizace této péče do budoucna zlepšit dostupnost cévních neurologických poraden, ať už ve vazbě na vysoce specializovaná cerebrovaskulární nebo iktová centra, nebo i samostatných v terénu. Dále je potřebná interdisciplinární spolupráce ambulantních specialistů (internista, kardiolog, diabetolog, lipidolog), u stabilizovaných pacientů může na tuto léčbu dále dohlížet jejich praktický lékař. V každém případě se však jedná o aktivní přístup s kontrolou dosažení cílových hodnot klíčových rizikových parametrů, jak je v tomto článku uvedeno, zhodnocení výsledků všech indikovaných vyšetření a eliminaci případných nežádoucích účinků léčby, nikoli ponechání nemocného jeho osudu „s těmi tabletkami, co si přinesl z nemocnice“, někdy i bez nich. To samozřejmě vyžaduje i co nejlepší zainteresování samotných pacientů na jejich spolupráci při dlouhodobé léčbě.
Literatura u autora.
MUDr. Ondřej Škoda, Ph.D., FESO
Neurologické oddělení, Nemocnice Jihlava, p. o.
Neurologická klinika 3. LF UK a FNKV, Praha
