Nimesulid je dnes v České republice jediným terapeuticky využívaným preferenčním inhibitorem cyklooxygenázy 2. V minulosti byla intenzivně diskutována otázka jeho bezpečnosti, zejména ve vztahu k jaternímu parenchymu a činnosti jater. Navzdory tomu zůstává poměr účinnosti a bezpečnosti pozitivní. Vysvětlením mohou být jeho specifika na úrovni vlastního mechanizmu účinku, která jsou pojednávána v textu.
Nimesulid (N-(4-nitro-2-fenoxyfenyl)-methansulfonamid) je nesteroidním antiflogistikem (NSA) řazeným mezi preferenčně selektivní inhibitory cyklooxygenázy COX-2 (poměr IC50 COX-2/COX-1 0,038); chemicky patří mezi sulfonanilidy. Objeven byl roce 1971 a poprvé byl v Evropě uveden do klinické praxe v Itálii roku 1985. Od té doby je využíván v mnoha zemích světa, jakkoliv jeho rozmach byl přibližně před deseti lety přibrzděn zprávami o možné hepatotoxicitě.
Dodnes stále zmiňovaná hypotéza „prospěšných“ prostaglandinů odvozených od COX-1 na straně jedné
a „nebezpečných“ prostaglandinech odvozených od COX-2 na straně druhé, jakkoliv je fascinující, musela být revidována. Dnes je totiž známo, že i COX-2 je konstitutivně exprimována v některých tkáních. Současně platí, že
i prostaglandiny odvozené od COX-1 se účastní zánětu.
Počáteční studie nimesulid popisují jako lehce kyselou molekulu (pKa = 6,4) charakterizovanou inhibicí syntézy prostaglandinů, protizánětlivým účinkem a dobrou gastrointestinální snášenlivostí. Za dobu od okamžiku svého objevu však byla popsána celá řada jiných, v podstatě neočekávaných farmakologických účinků, zahrnujících např. potlačení proliferace nádorově transformovaných buněk, neuroprotekci při mozkové ischemii, či dokonce antiglykační účinky naznačující jeho možný přínos ve vztahu k diabetes mellitus.
Nimesulid je dnes schválen k druholiniové léčbě akutní bolesti a primární dysmenorey. Protizánětlivý účinek nimesulidu vychází z inhibičního působení na řadu typů buněk zahrnující polymorfonukleáry či eozinofily, v důsledku čehož klesá jejich aktivace či tvorba cytokinů s poníženou chemotaxí; nimesulid inhibuje též aktivaci mastocytů doprovázenou nižší histaminoliberací. Popsán byl rovněž jeho účinek chondroprotektivní.
Tak trochu jiný antiflogistický účinek
Iniciálně byla v protizánětlivých účincích za stěžejní u nimesulidu považována role cyklického adenosinmonofosfátu (cAMP) v návaznosti na inhibici fosfodiesterázy IV (PDE IV). Nedlouho poté byla naznačena jeho role z pozice modulátoru adenosinových receptorů, neboť v in vitro studii s neutrofily byly jeho účinky blokovány teofylinem, který je, analogicky jako jiné methylxantiny, jejich dobře známým antagonistou. Tool a kol. v 90. letech prokázali, že nimesulid i salmeterol omezují tvorbu zánětlivých mediátorů aktivovanými eozinofily a že tento účinek je zprostředkován právě cAMP; na rozdíl od salmeterolu není u nimesulidu aktivace cAMP provázena aktivací beta-2 adrenoceptorů. Potlačená tvorba leukotrienů nimesulidem však byla výraznější než u salmeterolu. Záhy byla popsána dominantní inhibice tvorby leukotrienu B4 při hodnocení aktivity neutrofilů.
Z experimentálních prací zaměřených na popis mechanizmu nimesulidu je pak jistě důležité konstatování snížené infiltrace leukocyty a menšího otoku v karagenanem indukovaném zánětu (pozn.: důležitá role adenosinových receptorů – viz níže) u potkanů, které bylo dáno inhibicí COX-1 a COX-2, zatímco COX-2 selektivně působící molekuly byly bez účinku. Již autoři této práce zmiňují, že prostaglandiny vzniklé za katalýzy COX-1 participují v patofyziologii zánětu. Dále poněkud vizionářsky uvádějí, že inhibice aktivity cyklooxygenáz není postačující pro dosažení potlačení zánětu, jak je tomu u mnohých klasických NSA. V dalších experimentech nimesulid, nikoliv však ibuprofen, působil protektivně stran degradace chrupavky v osteoartrotickém modelu, avšak nezávisle na COX-2; spíše lze daný účinek vysvětlit inhibicí metaloproteináz.
Protizánětlivé účinky nimesulidu jsou tak vedle efektivní inhibice cyklooxygenáz dnes spojovány rovněž s modulací adenosinové signální cesty. Připomeňme, že adenosin je nukleosid za fyziologických podmínek přítomný v nanomolárních koncentracích intra- i extracelulárně; vzniká degradací adeninových nukleotidů. Prostřednictvím svých základních receptorů A1, A2A, A2B a A3 participuje v homeostatické regulaci řady orgánů a systémů (kardiovaskulární, renální, imunitní, gastrointestinální či nervový). Extracelulární adenosin se hromadí ve tkáních s probíhajícím zánětem či hypoxií, kdy adenosintrifosfát je uvolňován vně z poškozených buněk – působí zde jako signální molekula modulující zánětlivou reakci, respektive imunitní odpověď. Studie in vitro i in vivo tak kupř. prokázaly jeho protizánětlivý účinek daný aktivací receptorů A2A. Extracelulární množství adenosinu je přitom regulováno enzymy E-NTPDázou (CD39) a nukleotidázou (CD73). Jejich exprese vzrůstá při zánětu i hypoxii a má se za to, že slouží jako adaptivní mechanizmy zabraňující výraznějšímu tkáňovému poškození.
Poměrně záhy bylo zjištěno, že nimesulid potencuje antirevmatické účinky methotrexátu v myším modelu indukované artrózy za dosažení kontroly progrese s předpokládaným výrazným zapojením adenosinu. Ostatně protizánětlivé účinky nimesulidu byly pozorovány i u potkanů v karagenanem indukovaném otoku, jehož rozvoj je spjat nepřímo s aktivitou receptoru A2A, a že tyto účinky jsou současně dány stimulací CD73. V souladu s tím je i pozorování absence protizánětlivého působení nimesulidu v buňkách s potlačenou expresí mRNA pro CD73 (obrázek 1). Lze usuzovat, že stimulace adenosinu může být i v pozadí gastroprotektivního působení nimesulidu.
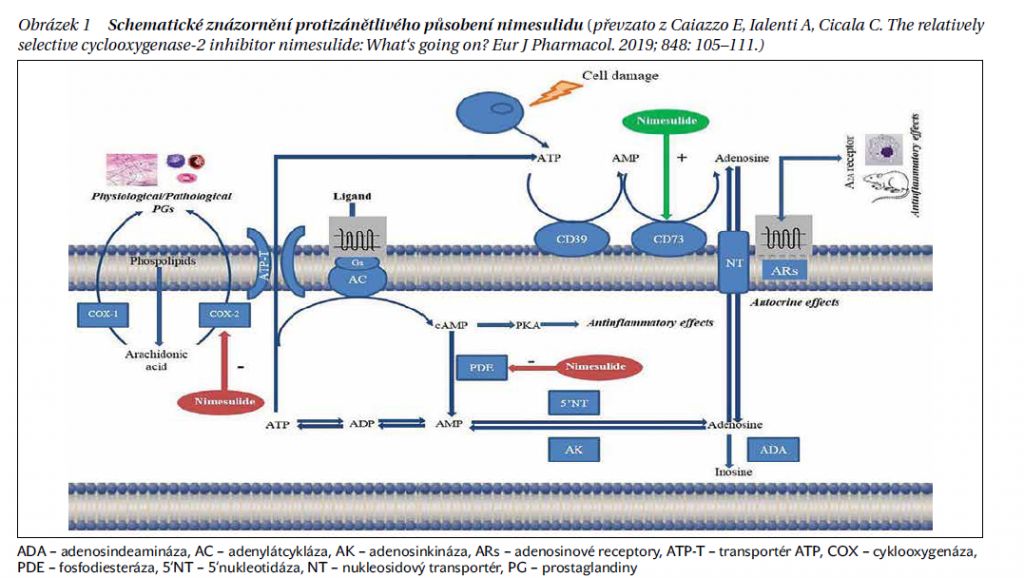
Z pohledu možných mechanizmů účinku nimesulidu ovšem stále nelze vyloučit inhibici agregace a migrace neutrofilů, výše zmíněné histaminoliberace, tvorby kyslíkových radikálů, aktivity syntázy oxidu dusnatého (NOS), tvorby destičky aktivujícího faktoru (PAF), syntézy metaloproteináz, uvolňování cytokinů (IL-6) či inhibici tvorby a uvolňování substance P.
Od teorie ke klinické praxi
Popsaný mechanizmus účinku nimeseulidu se promítá do jeho terapeutické účinnosti deklarované v řadě publikovaných klinických studií, které tak podporují jeho využití ve výše uvedených aktuálně schválených indikacích. Uveďme alespoň některé z nich.
Klinické studie s nimesulidem
Pohjolainen a kol. v prospektivní randomizované dvojitě zaslepené klinické studii čítající 104 nemocné akutní bolestí zad (LBP) porovnával účinnost nimesulidu 100 mg 2× denně oproti ibuprofenu 600 mg 3× denně po dobu 10 dní. Nimesulid zde byl stejně, nebo dokonce více účinný, zejména pak při hodnocení funkčnosti, a to za příznivějšího bezpečnostního profilu.
Již před více než dvěma dekádami byl ve dvojitě zaslepené randomizované klinické studii s aktivním komparátorem prokázán jeho přínos v léčbě akutní bolesti kloubů. Nemocným (n = 122) s akutní bolestí ramenního kloubu (akutní subdeltoidní burzitida či bicipitální tendinitida) byl podáván nimesulid v režimu 100 mg 2× denně nebo diklofenak 75 mg 2× denně po dobu dvou týdnů. Oba přístupy se ukázaly být terapeuticky ekvivalentní, tj. poskytovaly zlepšení v kompozitním sledovaném skóre sestávajícím z otoku, zarudnutí, citlivosti na tlak, bolesti v klidu či pohybu a rozsahu pohybu. Snášenlivost nimesulidu však byla oproti diklofenaku výrazně lepší, a to při hodnocení investigátory i samotnými pacienty.
Léčebné využití
Účinnost nimesulidu je nicméně prokazována rovněž u chronické bolesti kloubů, např. u nemocných trpících gonartrózou, což je ostatně dáno i jeho dobrou distribucí (i jeho hlavního metabolitu M1) do synoviální tekutiny, a to již po 30 minutách po perorálním podání dávky 100 mg s tím, že následující 14denní léčba 100 mg 2× denně koncentraci v synoviální tekutině nadále zvyšovala, zatímco v krevní plazmě nebyla zřejmá akumulace léčiva.
Účinnost nimesulidu byla testována i u pooperační bolesti. Šlo kupř. o bolest po artroplastice u 94 osob randomizovaných k léčbě nimesulidem 100 mg 2× denně, naproxenem 500 mg 2× denně nebo k užívání placeba po dobu nanejvýš 3 dnů. Nimesulid byl v léčbě bolesti významně účinnější než placebo i naproxen ve smyslu dosažené úlevy od bolesti po šesti hodinách, což umožnilo i nižší potřebu užití záchranné medikace – paracetamol 500 mg až 6× denně užilo 64,5 % osob v rameni placeba, 47,1 % pacientů léčených naproxenem a pouze 27,6 % pacientů léčených nimesulidem.
Stran dysmenorey uveďme pro ilustraci porovnávací, dvojitě zaslepenou studii, ve které byla účinnost nimesulidu porovnávána oproti diklofenaku v souboru 304 pacientek trpících primární dysmenoreou. Léčba byla indikována první 3 dny menstruačního cyklu. Za 2 hodiny byla úleva od bolesti v obou skupinách srovnatelná (82 vs. 79 %). U nimesulidu byl však zaznamenán rychlejší nástup, a to již během prvních 30 minut, během kterých popisovalo úlevu 35 % pacientek oproti 27 % u diklofenaku (p < 0,01). V obou ramenech studie došlo k podobné úpravě bolestí hlavy i zad. Důležité je nicméně i zjištění, že užití nimesulidu bylo spojeno s nižším výskytem nežádoucích účinků (7 vs. 16 pacientek; p < 0,05).
Bezpečnost
Vedle účinnosti je v kontextu léčebného využití nimesulidu dlouhodobě zmiňována jeho bezpečnost. Vzhledem k jeho preferenční inhibici cyklooxygenázy 2 je patrné nízké riziko nežádoucích účinků postihujících horní část gastrointestinálního traktu ve srovnání s velkou většinou nesteroidních antiflogistik. Relativní riziko těchto nežádoucích účinků bylo v retrospektivní studii čítající bezmála 589 tisíc nemocných vyčísleno hodnotou 1,53 vs. 1,00 při neužívání NSA.
Z pohledu možné hepatotoxicity pak nelze nezmínit závěry mezinárodní případové studie SALT probíhající v 52 centrech a zahrnující 9 479 nemocných. Studie prokázala celkově nízké riziko závažných jaterních reakcí spojených s užíváním NSA a stejně tak i nízký výskyt těžkého poškození jater daného nimesulidem, jenž v tomto směru nikterak nevybočoval.
Závěr
Nimesulid je dnes terapeuticky využíván v celé řadě lékařských specializací, a to v systémové i topické formě, v řadě evropských zemí, včetně České republiky. Nicméně nimesulid byl v několika zemích z trhu stažen (Španělsko, Irsko a Finsko) z důvodu obav ze zvýšeného rizika hepatotoxicity ve srovnání s jinými zástupci NSA. Nicméně již v roce 2012 úplné posouzení přínosů a rizik provedené Výborem pro humánní léčivé přípravky (CHMP) Evropské lékové agentury jasně potvrdilo, že přínosy nimesulidu převyšují možná rizika za předpokladu, že délka léčby je omezena na 15 dní a dodržení maximální denní dávky 200 mg (zpráva EMA/73856/2012).
Recentní výzkum ukázal, že molekulární mechanizmus nimesulidu na základě jeho protizánětlivého účinku a gastrointestinální bezpečnosti přesahuje inhibici COX-2 a šetřící účinek COX-1. Nashromážděné důkazy naznačují zapojení dalších mechanizmů účinku, které ho činí v zásadě unikátním. Vedle nejrůznějších postulovaných mechanizmů se jako nejvýznamnější aktuálně ukazuje modulace adenosinového systému. Tento nový poznatek by tak mohl vylepšit jeho terapeutické použití a současně i pomoci identifikovat nové cíle pro terapeutické ovlivnění zánětu.
Literatura1–27 u autora.
doc. MUDr. Jiří Slíva, Ph.D.
Ústav farmakologie, 3. LF UK, Praha
