Olaparib patří mezi PARP inhibitory. Poly-ADP-polymeráza (PARP) se účastní opravy jednořetězcové DNA. Inhibice komplexu PARP brání buňkám prostaty v opravě poškozené jednořetězcové DNA. Následkem toho buňky s trvalým poškozením jednořetězcové DNA mají problém s replikací, což posléze vede k poškození dvouřetězcové DNA. Oprava obou řetězců DNA vyžaduje aktivaci mechanizmů homologní rekombinační opravy a nehomologního spojování konců.
Proteiny BRCA1 a BRCA2 jsou důležité v procesu opravy poškozené DNA (obrázek 1). Když se v buňce objeví poškození DNA, proteiny BRCA1 a BRCA2 hrají klíčovou roli v aktivaci mechanizmu nazývaného homologní rekombinace (HRR). Tento proces začíná tím, že kinázy s názvy ATM (ataxia telangiectasia mutated) a ATR (ataxia telangiectasia and Rad3-related) rozpoznají poškození a předají signál dál pomocí fosforylovaných proteinů CHEK2 a BRCA1. BRCA1 má vedle své role v HRR i další úkoly v buňce, jako je regulace buněčného cyklu, kontrola transkripce genů účastnících se opravy DNA a programovaná buněčná smrt (apoptóza).
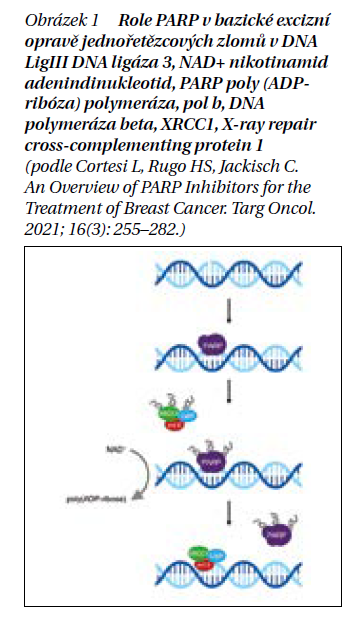
V rámci HRR funguje BRCA1 jako základ, který pomáhá organizovat proteiny zapojené do opravy DNA. BRCA2 pak usnadňuje tento proces tím, že pomáhá přitahovat rekombinátní protein RAD51 na místo poškození DNA. Kromě BRCA1 a BRCA2 se na ochraně buňky před dědičným karcinomem podílí další geny, jako jsou ATM, BARD1, BRIP1, CHEK2 (kódováním CHK2), MRE11A, PALB2, RAD50, RAD51C a RAD51D.
Germinální mutace v genech homologní rekombinace (HRR) DNA byly pozorovány u 10–15 % pacientů s metastatickým karcinomem prostaty, somatické mutace se vyskytují u 20–25 % těchto pacientů, nejčastěji v genech BRCA2 a ATM. Tyto genetické mutace jsou prediktivními faktory pro léčbu PARP inhibitory. Studie PROpel a PROfound hodnotily začlenění olaparibu do léčby karcinomu prostaty.
Studie PROfound
Otevřená randomizovaná klinická studie fáze 3 hodnotila účinnost olaparibu u pacientů s metastatickým kastračně rezistentním karcinomem prostaty (mCRPC), kteří zprogredovali na léčbě ARTA (enzalutamidem nebo abirateronem). Pacienti byli náhodně randomizováni v poměru 2 : 1, kdy v experimentálním rameni dostávali olaparib, v kontrolním rameni podle výběru lékaře byli léčeni enzalutamidem nebo abirateronem. Do studie byli zařazeni pacienti s alespoň jednou ze 14 genetických mutací.
Skupina A obsahovala pacienty s mutacemi v genech BRCA1, BRCA2 nebo ATM, zatímco skupina B zahrnovala pacienty s mutacemi v dalších 12 genech homologní rekombinace (BRIP1, BARD1, CDK12, CHEK1, CHEK2, FANCL, PALB2, PPP2R2A, RAD51B, RAD51C, RAD51D a RAD54L). Výsledky shrnuje obrázek 2. Statisticky významný přínos přežití bez progrese (rPFS) u olaparibu byl zaznamenán i v celkové studijní populaci (kohorty A + B, pacienti s ≥ 1 změnou z 15). Na základě dalších genomických studií u metastatického kastračně rezistentního karcinomu prostaty měla většina pacientů mutaci BRCA2 (90,6 %; 145/160 pacientů) spíše než mutaci v BRCA1 (9,4 %; 15/160 pacientů), které jsou u tohoto typu karcinomu vzácné. U pacientů s genovými změnami v BRCA bylo rPFS delší v experimentálním rameni s olaparibem než u kontrolní skupiny (medián 9,8 vs. 3,0 měsíce; HR 0,22 [95% CI 0,15–0,32]. U pacientů s mutacemi v genu BRCA2 (n = 128) byl medián rPFS pro olaparib 10,8 měsíce oproti 3,5 měsíce v kontrolní skupině. Mateova post hoc analýza podskupiny s BRCA mutací z loňského roku potvrdila benefit olaparibu.
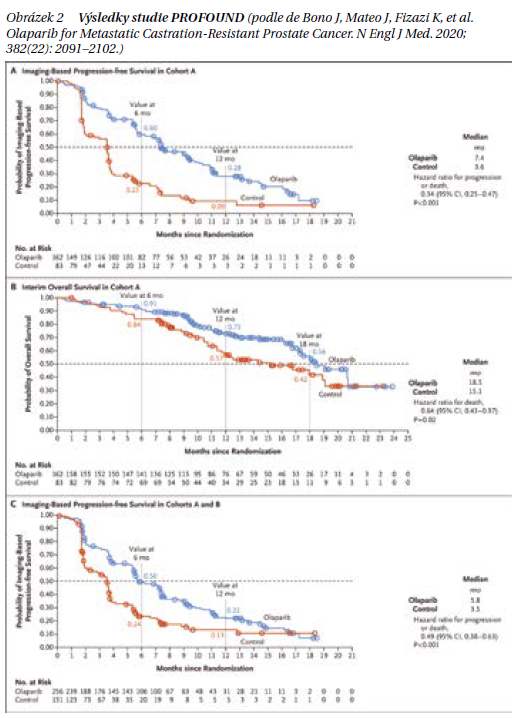
Studie PROfound poskytuje přesvědčivé důkazy o tom, že somatické nebo zárodečné mutace BRCA (ne non BRCA mutace) jsou prediktivním faktorem inhibice PARP, tj. léčby olaparibem.
První linie léčby mCRPC
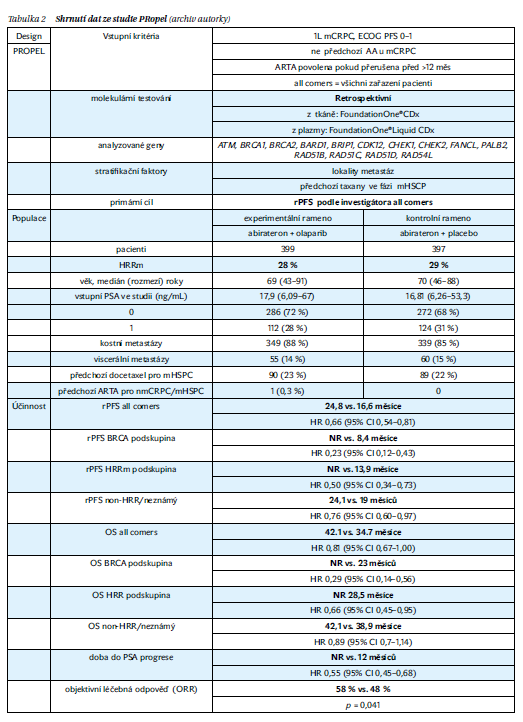
Účinnost kombinace olaparibu s abirateronem a prednisonem u mužů s mCRPC, u nichž není v 1. linii léčby indikována chemoterapie, hodnotila klinická studie PROpel; zařadila 796 pacientů s metastatickým kastračně rezistentním karcinomem prostaty. Pacienti byli náhodně rozděleni v poměru 1 : 1 v experimentálním rameni s kombinací olaparib + abirateron + prednison oproti kontrolnímu rameni placebo + abirateron + prednison. Pacienti před zařazením do studie byli buď po orchiektomii, nebo užívali analoga LHRH. Bylo povoleno pouze předléčení docetaxelem ve fázi metastatického hormonálně senzitivního onemocnění (mHSPC). Stratifikace pacientů ve studii byla provedena na základě lokalizace metastáz a na základě předléčenosti chemoterapií docetaxel. Ve studii PROpel byly hodnoceny mutace ve 14 genech HRR včetně BRCA1, BRCA2 a 12 dalších genů HRR (ATM, BARD1, BRIP1, CDK12, CHEK1, CHEK2, FANCL, PALB2, RAD51B, RAD51C, RAD51D, RAD54L).
Subanalýza podskupin u 85 pacientů s BRCA mutací prokázala, že mediánu přežití bez progrese nebylo dosaženo v rameni s olaparibem a abirateronem ve srovnání s 8 měsíci u těch, kteří dostávali placebo s abirateronem. Celkový poměr rizika přežití u těchto pacientů byl 0,30. U 711 pacientů bez mutace BRCA byl poměr rizika HR přežití bez radiologické progrese 0,77 a poměr HR rizika celkového přežití 0,92 (tabulka 1, obrázek 3).
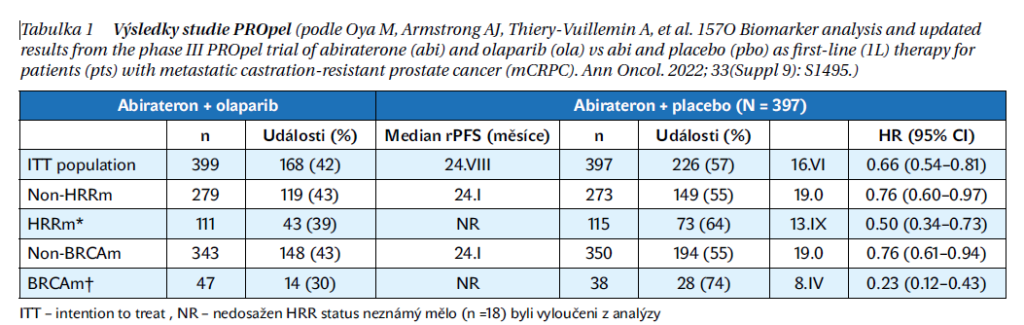
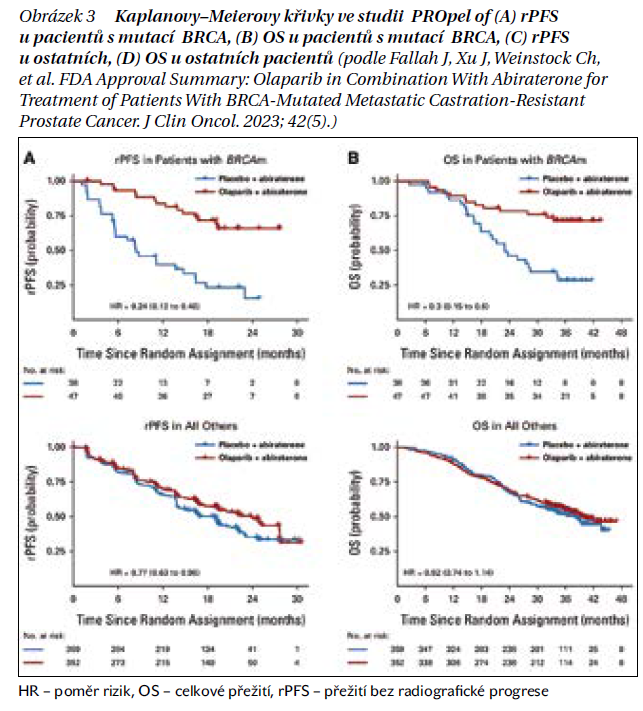
Olaparib v experimentálním rameni vykázal medián PFS 16,6 měsíce, zatímco u skupiny s placebem byl medián PFS 8,4 měsíce, došlo k prodloužení přežití bez progrese o 8,2 měsíce. Poměr PFS byl 0,66 (0,54–0,81). Data o celkovém přežití OS nejsou zralá. Podle NCCN guidelines je kombinace olaparib a abirateron doporučena pacientů s mCRPC s BRCA mutací (úroveň důkazů 1). Nejdůležitějsí údaje ze studie PROpel jsou shrnuty v tabulce 2.
Závěr
Na základě výsledku klinické studie PROFOUND je možné zvážit monoterapii olaparibem po selhání terapie ARTA (s nebo bez předchozí léčby taxany) u pacientů s mCRPC a změnami BRCA1/2. V ČR olaparib nemá v této indikaci dosud stanovenu úhradu, proto je potřeba žádat revizního lékaře o schválení úhrady na §16.
Podle NCCN guidelines je možné podat monoterapii olaparibem u pacientů s přítomností BRCA mutace (úroveň důkazů 1). Podle ESMO guidelines by měla být zvážena monoterapie olaparibem u pacientů progredujcích na předchozí léčbě ARTA u pacientů s mutacemi BRCA1, BRCA2 (zárodečná mutace nebo somatické mutace).
Na základě výsledků studie PROpel schválila FDA 31. května 2023 kombinaci olaparib a abirateron v 1. linii léčby metastatického kastračně rezistentního karcinomu prostaty. V ČR je nutné i v této indikaci žádat revizního lékaře o schválení léčby olaparibem na §16.
MUDr. Darja Šustrová
Onkologická klinika 2. LF UK a FN v Motole
