Stillova nemoc je poměrně heterogenní choroba, jejíž průběh může kolísat od mírných projevů až po závažné, život ohrožující stavy. Terapie onemocnění by měla být vždy vedena s ohledem na dominující klinické příznaky. Kromě glukokortikoidů a syntetických chorobu modifikujících léků nabývají na významu léky biologické, zejména , které mají dobrou účinnost zejména u systémových forem onemocnění. Jedním z nich je canakinumab, plně humánní protilátka proti IL-1β, který prokázal v klinických hodnoceních u dětí i dospělých se Stillovou chorobou dobrou účinnost s přijatelným bezpečnostním profilem.
Stillova nemoc je systémová, polygenně podmíněná autoinflamatorní choroba, mezi jejíž hlavní projevy patří zejména horečka, bolest v krku, makulopapulární kožní raš, muskuloskeletální příznaky (artralgie a artritidy), serozitida a hepatosplenomegalie. V laboratorním obraze dominuje zejména výrazná neutrofilní leukocytóza, dále se u akutního vzplanutí Stillovy choroby nacházejí prakticky vždy vysoké hladiny reaktantů akutní fáze (CRP, sedimentace erytrocytů, fibrinogen, imunoglobuliny). Časté jsou rovněž elevace hladin jaterních enzymů.
Diferenciálnědiagnostická rozvaha
Z diferenciálnědiagnostických důvodů horečky nejasné etiologie se provádí celá řada dalších vyšetření, jako je analýza přítomnosti autoprotilátek (revmatoidní faktor, antinukleární protilátky, ANCA) a celá paleta mikrobiologických a sérologických vyšetření, jejich výsledky však typicky bývají negativní.
Poměrně charakteristickým, byť opět nespecifickým nálezem bývá vysoká hladina sérového feritinu, která je indikátorem aktivace makrofágů a svědčí rovněž pro proinflamatorní funkci feritinu v rozvoji cytokinové bouře. Hladiny glykosylovaného feritinu bývají u nemocných se Stillovou nemocí nízké (< 20 %), tento test však není pro Stillovu nemoc specifický, navíc nebývá v laboratořích běžně dostupný. Poměrně časté jsou i zvýšené hladiny kalprotektinu či IL-6, ani tyto laboratorní nálezy však nejsou pro Stillovu nemoc specifické. U velmi aktivních forem nemoci mohou být zvýšeny i sérové hladiny prokalcitoninu, což může vést k diagnostickým rozpakům.
Existují dva navzájem se překrývající klinické fenotypy choroby: systémový typ, manifestující se zejména horečkou, vyrážkou a postižením vnitřních orgánů, a artikulární typ, podobný více revmatoidní artritidě. Může se jednat o onemocnění s mírným průběhem, ale rovněž tak i o závažné, život ohrožující stavy, a to zejména v případě hematologických (syndrom aktivovaných makrofágů, diseminovaná intravaskulární koagulace) či jiných závažných orgánových komplikací (ARDS či difuzní alveolární hemoragie, plicní arteriální hypertenze, kardiální postižení, jaterní selhání a další).
Dříve se rozlišovaly dvě formy onemocnění, a to systémová forma juvenilní idiopatické artritidy (sJIA) u pacientů se začátkem onemocnění před 16. rokem věku a Stillova nemoc dospělých (adult-onset Still’s disease – AOSD) manifestující se v pozdějším věku. Vzhledem ke stejné patogenezi, klinickým manifestacím a orgánovému postižení u sJIA a AOSD se však jedná o stejnou klinickou entitu, pro kterou je nyní užíván jednotný název Stillova nemoc.
Incidence a patogeneze
Incidence chorobyje v literatuře udávána v rozmezí 0,16–0,4/100 000 osob s prevalencí 1–34 postižených na milion osob s lehkou prevalencí žen.
Patogeneze choroby není zcela jednoznačně objasněná, mechanizmy jejího vzniku spočívají v poruše jak vrozené, tak i adaptivní imunitní odpovědi, přičemž možným spouštěčem autoinflamatorního onemocnění může být virová či bakteriální infekce nebo malignita.
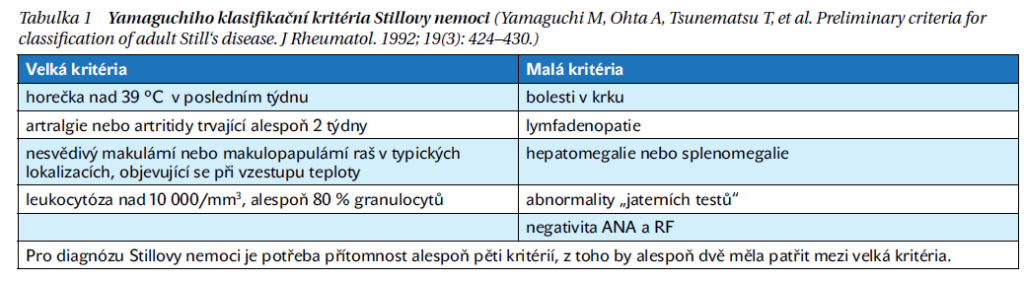
V diagnostice jsou využívána klasifikační kritéria, která jsou založena na kombinaci laboratorních a klinických nálezů po předchozím vyloučení infekčního, autoimunního či nádorového onemocnění. V současné době se doporučuje využívat klasifikační kritéria podle Yamaguchiho (tabulka 1). Hodnocení aktivity nemoci je vzhledem k jejím poměrně heterogenním projevům složité, neexistuje standardizovaný nástroj k posouzení remise, aktivity či relapsu onemocnění.
Průběh choroby může být monofázický s nástupem remise po několika týdnech či měsících nebo může onemocnění probíhat pod obrazem intermitentních vzplanutí choroby s remisemi mezi jednotlivými atakami, či jako chronická či perzistentně aktivní choroba s rizikem destrukce postižených kloubů.
Léčba
Cílem léčby Stillovy nemoci je ovlivnění klinických příznaků a snížení laboratorních známek zánětu s navozením remise, prevence ireverzibilního kloubního a orgánového postižení a minimalizace rizika vzniku komplikací, komorbidit či nežádoucích účinků léčiv. Samotná léčebná strategie by měla respektovat závažnost choroby (lehká, středně závažná, život ohrožující forma) a převládající klinickou symptomatologii (systémová vs. artikulární forma).
Nesteroidní antirevmatika nemají v dlouhodobé kontrole aktivity onemocnění u většiny nemocných efekt. Používají se zejména symptomaticky k potlačení horečky, bolesti a zánětu v kloubech nebo v počátku onemocnění či při jeho relapsu, kdy je potřeba širší diferenciálnědiagnostická rozvaha před zahájením terapie glukokortikoidy.
U převážné většiny pacientů je potřebné ke kontrole zánětu a zabránění destrukce kloubů zahájit terapii imunosupresivními léky. Základním lékem jsou glukokortikoidy, jejich dávka se odvíjí od závažnosti choroby, doporučuje se léčbu zahájit dávkou odpovídající ekvivalentu 0,5–1,0 mg prednisonu na kilogram hmotnosti a den. V případě závažných, život ohrožujících komplikací jsou podávány vysokodávkované intravenózní glukokortikoidy. K postupné redukci dávek se přistupuje po normalizaci parametrů zánětu. Vždy je nutno brát v potaz celou řadu potenciálních nežádoucích účinků léčby, stejně jako možný rozvoj kortikorezistence u části pacientů, čemuž lze částečně zabránit podáním glukokortikoidy šetřících léků. U pacientů s mono/oligoartikulárním postižením může být vhodnou alternativou léčby intraartikulární aplikace glukokortikoidů.
Ze syntetických chorobu modifikujících léků (disease modifying drugs – DMARDs) se v léčbě Stillovy nemoci využívá zejména methotrexát. Jeho dávkování je obdobné jako u pacientů s revmatoidní artritidou, nejčastěji se používá dávka 7,5–25 mg týdně v závislosti na aktivitě choroby a komorbiditách. Další možností, zejména při kontraindikacích či neúčinnosti methotrexátu, je podání cyklosporinu A, hydroxychlorochinu či intravenózních imunoglobulinů.
Biologickými léky, které mají registračními studiemi řádně doloženu účinnost a bezpečnost v léčbě Stillovy nemoci, jsou inhibitory IL-1 anakinra a canakinumab. Rovněž tak i další inhibitor IL-1 rilonacept má kaziuisticky zdokumentovanou účinnost u pacientů se Stillovou nemocí, k léčbě choroby však registrován není. Alternativou inhibitorů IL-1 mohou být u pacientů s kloubními a systémovými projevy choroby blokátory IL-6. Tocilizumab je registrován k podání u dětských pacientů, rovněž tak prokázal účinnost i u dospělých s refrakterními formami onemocnění. Sarilumab nemá registraci pro léčbu Stillovy choroby, jeho účinnost však byla kazuisticky zdokumentována. Lékem třetí volby mohou být TNFi (infliximab, adalimumab, etanercept, golimumab, certolizumab pegol), které mají efekt u pacientů s dominujícím kloubním postižením, systémové příznaky většinou nebývají těmito léky dostatečně kontrolovány. Ve vývoji jsou léky fungující na principu inhibice IL-18, rekombinantní protein vážící IL-18 tadekinig α prokázal v otevřené studii schopnost výrazně snížit sérové hladiny IL-18 a současně kontrolovat aktivitu choroby.
Optimální vedení léčby je v současnosti stále předmětem diskuze, ze které však vyplývá, že mnozí pacienti se závažnými formami choroby a rizikem orgánového poškození a rozvoje komplikací mohou významně profitovat z časně zahájené, a dokonce i glukokortikoidům předřazené biologické léčby.
Canakinumab v léčbě Stillovy nemoci
Canakinumab je plně humánní protilátka proti IL-1β,která je schválena pro použití v léčbě Stillovy nemoci, z dalších indikací lze jmenovat léčbu familiární středomořské horečky, refrakterní dny a dalších autoinflamatorních chorob.
Dlouhodobá účinnost a bezpečnost canakinumabu v dětské populaci se systémovou formou juvenilní idiopatické artritidy byla potvrzena v dlouhodobé extenzi dvou předchozích studií III. fáze. Z původních 177 dětských pacientů ve věku 2–19 let pokračovalo v dlouhodobém podávání canakinumabu 144 z nich (81 %). 75 pacientů (42 %) z celkového počtu dokončilo sledování ve studii a u 102 (58 %) bylo sledování předčasně ukončeno, nejčastěji pro neúčinnost (63/102; 62 %), přičemž se častěji jednalo o pacienty ze skupiny s pozdní odpovědí (n = 25/31; 81 %) než o pacienty s časnou odpovědí (n = 11/38; 29 %) na canakinumab. Po dvou letech sledování bylo dosaženo aJIA-ACR 50/70/90 (adapted JIA American College of Rheumatology) odpovědi u 62, 61 a 54 % pacientů. CRACR (ACR – clinical remission on medication criteria) bylo dosaženo u 20 % pacientů po 6 měsících léčby a u 32 % po dvou letech.
Nízké aktivity onemocnění hodnocené podle JADAS (Juvenile Arthritis Disease Activity Score) bylo po 2 letech sledování dosaženo celkem u 49 % pacientů, přičemž účinnost léku byla potvrzena i po 5 letech sledování. Celkem 72,3 % pacientů (128/177) bylo léčeno glukokortikoidy, přičemž při léčbě canakinumabem bylo možno u 15 % (20 pacientů) glukokortikoidy zcela vysadit a u 28 (22 %) byla dávka redukována na 0,15 mg/kg/den. Dlouhodobá léčba canakinumabem byla dobře tolerována, nejčastější nežádoucí příhodou byly infekce. V průběhu sledování manifestovalo 13 případů syndromu aktivovaných makrofágů (MAS), což naznačuje, že léčba canakinumabem zřejmě i přes dobrou léčebnou odpověď nesnižuje riziko rozvoje tohoto závažného syndromu. Lze tedy konstatovat, že dlouhodobé podávání canakinumabu vede k dosažení léčebné odpovědi a možnosti redukovat či vysadit léčbu glukokortikoidy u části pacientů se sJIA se systémovým postižením a artritidou. Pozitivním prediktivním faktorem dlouhodobé odpovědi na léčbu je pak zejména časné dosažení léčebné odpovědi, což může napomoct při rozhodování o dlouhodobé strategii léčby sJIA. V současné době jsou k dispozici i data z klinických registrů, která rovněž potvrzují účinnost canakinumabu u dětí a adolescentů v reálné klinické praxi.
Data ze studie CONSIDER u pacientů s AOSD s kloubním postižením
Účinnost a bezpečnost canakinumabu u pacientů s AOSD s kloubním postižením byla sledována ve studii CONSIDER. Jednalo se o multicentrickou, dvojitě zaslepenou, placebem kontrolovanou, randomizovanou studii II. fáze. Pacienti s aktivním kloubním postižením charakterizovaným jako ≥ 4 bolestivé a oteklé klouby byli léčeni canakinumabem v dávce 4 mg/kg (maximálně 300 mg) subkutánně každé 4 týdny nebo placebem.
Primárním cílem studie bylo dosažení klinicky relevantní redukce aktivity onemocnění v týdnu 12, hodnocené jako změna kompozitního skóre DAS28 > 1,2. Celkem bylo randomizováno 36 pacientů, z nichž 19 bylo léčeno canakinumabem a 17 placebem. Pacienti měli vysokou aktivitu onemocnění, průměrné DAS28 skóre bylo 5,4 ve skupině léčené canakinumabem a 5,3 ve skupině placebové. Primárního cíle studie bylo dosaženo u 12 pacientů (67 %) ve skupině léčené canakinumabem a u 7 (41 %) pacientů ve skupině placebové (p = 0,18). V další analýze bylo potvrzeno vyšší dosažení odpovědi ACR 30 (61 vs. 20 %, p = 0,033), ACR 50 (50 vs. 6,7 %, p = 0,009) a ACR 70 (28 vs. 0 %, p = 0,049) ve skupině pacientů léčených canakinumabem. U dvou pacientů léčených canakinumabem se vyskytly závažné nežádoucí příhody. Studie byla ukončena předčasně pro nedosažení cílových počtů pacientů a jejího primárního cíle nebylo dosaženo, přesto však lze konstatovat, že léčba canakinumabem vedla ke zlepšení projevů AOSD a výsledky studie podpořily jeho registraci k léčbě AOSD.
Data z literatury ukazují, že v letech 2012–2021 byla opakovaně publikována data o léčbě AOSD canakinumabem, kromě výše uvedené studie CONSIDER se jednalo o jednotlivé kazuistiky či kazuistické série a observační studie. Z celkového počtu 99 pacientů dosáhlo 68,7 % z nich kompletní remise systémových příznaků a artritid, 16,2 % pacientů vykazovalo parciální zlepšení symptomů a zbývajících 15,1 % nevykazovalo léčebnou odpověď nebo bylo z dalšího sledování vyloučeno. Nejčastější nežádoucí příhodou v průběhu léčby canakinumabem byly respirační infekce, artralgie, vzplanutí choroby, nauzea a bolesti břicha. Mezi závažné nežádoucí příhody patřil zejména syndrom aktivovaných makrofágů a závažné infekce.
Lze tedy konstatovat, že canakinumab má dobrou účinnost jak u dětí, tak i u dospělých se Stillovou nemocí s přijatelným bezpečnostním profilem, který je srovnatelný s jinými IL-1 inhibitory (anakinra).
Závěr
Stillova nemoc je velmi heterogenní choroba, která svým průběhem a rizikem rozvoje závažných komplikací může zásadním způsobem ovlivnit dlouhodobou prognózu nemocných. V její léčbě jsou úspěšně používány biologické léky ovlivňující signalizaci IL-1, jejichž podávání vede ke kontrole systémových a kloubních manifestací choroby a v případě závažných život ohrožujících stavů mohou být podány i jako lék první volby před nasazením glukokortikoidů.
Podpořeno MZ ČR RVO FNOL-0098892 a IGA_LF_2023_002.
MUDr. Martina Skácelová, Ph.D.
III. interní klinika – nefrologická, revmatologická a endokrinologická LF UP a FN Olomouc
