V posledním desetiletí došlo díky imunoterapii k výraznému pokroku v léčbě nemalobuněčného bronchogenního karcinomu. Inhibitory kontrolních bodů imunitní reakce se staly součástí standardního postupu v léčbě lokálně pokročilých a metastatických onemocnění. V budoucnu lze očekávat zařazení imunoterapie i do časných stadií buď v monoterapii, nebo v kombinaci s jinými léky.
V posledním desetiletí bylo dosaženo v diagnostice a léčbě nemalobněčného bronchogenního karcinomu (non-small-cell lung cancer – NSCLC) značného pokroku. Podle údajů Národního onkologického registru (NOR) z roku 2018 je rakovina plic pátým nejčastěji diagnostikovaným zhoubným nádorem v České republice. U mužů má incidence již více let klesající tendenci, zatímco u žen dochází stále ke vzestupu počtu onemocnění. V roce 2018 byla incidence rakoviny plic na 100 000 obyvatel 79,3 u mužů a 42,8 u žen.
Z morfologického hlediska zahrnuje NSCLC dvě skupiny onemocnění, a to skvamózní a neskvamózní karcinomy. Jedná se o heterogenní skupinu nádorů s různými molekulárněgenetickými charakteristikami, různými biologickými vlastnostmi a různou citlivostí k onkologické léčbě. V souvislosti s objevem genetických mutací v nádorových buňkách vznikla terčová léčba zaměřená na tyto cíle. V současnosti nabývá na významu genomické testování formou NGS (new generation sequencing), které může odhalit až u 30–40 % nemocných mutace, pro které bude možno najít odpovídající cílenou terapii. Další průlomovou léčebnou modalitou je imunoterapie, která významně zlepšuje výsledky léčby nemocných s rakovinou plic.
Historie imunoterapie
První zmínka o imunoterapii se v odborné literatuře objevila v 19. století, kdy německý lékař Busch infikoval pacienta se sarkomem měkké tkáně růží. Významný krok učinil v roce 1891 W. B. Coley, americký chirurg, který aplikoval nemocnému s inkurabilním lymfosarkomem do nádoru živou kulturu bakterií Streptococcus erysipelati a dosáhl vyléčení.
V roce 1957 vyslovil Sir MacFarlane Burnet hypotézu imunitního dohledu (immunosurveillance), podle které nové nádorové antigeny vyprovokují účinnou imunologickou reakci organizmu s regresí nádoru.
Později vzniká hypotéza imunoeditace, nazývaná hypotézou tří E (eliminace, equilibrium, escape). V první, eliminační fázi, jsou nádorové buňky ničeny NK, CD4+ a CD8+ buňkami. Druhá fáze je charakterizována rovnováhou mezi nádorovými a imunitními buňkami. Pokud není imunitní systém schopen nádorové buňky zničit, nastane třetí fáze se selekcí nádorových variant, kdy dojde ke ztrátě nádorových antigenů, ke zvýšené expresi proonkogenních vlivů
a k vytvoření imunosupresivního nádorového mikroprostředí. Tyto změny umožní únik nádorových buněk z dohledu imunitního systému a vznik klinicky zjistitelného nádoru.
Od 80. let minulého století se vývoj imunoterapie urychlil. Byla zveřejněna řada prací zabývajících se aplikací interleukinu 2 (IL-2) buď samostatně, nebo v kombinaci s jinými aktivovanými imunitními buňkami (lymphokine activated killer cells – LAK buňky, tumor infiltrating lymphocytes – TIL), cytokiny (interferon alfa – IFNα, tumour necrosis factor – TNF) nebo monoklonálními protilátkami.
V roce 1975 byla G. Köhlerem a C. Milsteinem popsána laboratorní produkce monoklonálních protilátek s použitím hybridomů vzniklých fúzí lymfocytů s buněčnými liniemi myelomu.
V současné době patří mezi nejslibnější protilátky inhibitory kontrolních bodů imunitní reakce (checkpoint inhibitory). První bod imunitní reakce, který byl objeven v roce 1987 Burnetem, byl nazván cytotoxický lymfocytární antigen číslo 4 (cytotoxic T-lymphocyte antigen number 4 – CTLA-4).
Prvním checkpoint inhibitorem schváleným FDA (Food and Drug Administration) ve Spojených státech v roce 2011 byl ipilimumab pro léčbu pokročilého melanomu. Jiný checkpoint inhibitor, nivolumab, první inhibitor PD-1 receptoru (programme cell death-1, receptor programované buněčné smrti) byl pro léčbu plicního karcinomu povolen v roce 2015. V následujících 3 letech byly schváleny další inhibitory PD-1 receptoru nebo jeho ligand PD-L1 a PD-L2, pembrolizumab, atezolizumab, durvalumab a avelumab.
Mechanizmus účinku blokády inhibičních molekul
Imunoterapie představuje léčebné postupy, které zásahem do imunitního systému jedince vedou ke zvýšenému rozpoznávání a ničení nádorových buněk. Bronchogenní karcinom se vzhledem k vysoké frekvenci mutací pokládá za vysoce imunogenní onemocnění. Molekuly kontrolních bodů imunitní reakce (CTLA-4 nebo PD-1 a jeho ligandy PD-L1 a PD-L2) jsou exprimovány na tumor infiltrujících lymfocytech (TIL) a na některých nádorových buňkách. Za normálních okolností hrají významnou roli v obraně před autoimunitním poškozením. Nádorové buňky využívají imunitní kontrolní body k potlačení normální funkce T lymfocytů v protinádorové imunitě a k následnému úniku z dohledu imunitního systému organizmu.
Protilátky proti receptoru PD-1 (nivolumab a pembrolizumab) a protilátky proti PD-L1 (atezolizumab a durvalumab) blokují interakci mezi PD-1 a ligandami PD-L1/PD-L2, které se nacházejí na T lymfocytech, B lymfocytech, antigen prezentujících buňkách (antigen- presenting cells – APC), stromálních buňkách a nádorových buňkách. Inhibice monoklonálními protilátkami blokuje inhibiční působení ligandů, zvyšuje a prodlužuje aktivaci T lymfocytů, znovu obnovuje imunitní reakci proti nádorovým buňkám.
Inhibitory kontrolního bodu imunitní reakce CTLA-4 (ipilimubab a tremelimumab) blokují inhibiční signály indukované signální drahou přes CTLA-4 a zvyšují počet reaktivních efektorových T buněk, které se mobilizují a útočí proti nádorovým buňkám.
Imunoterapie u lokálně pokročilého a metastatického NSCLC
V současné době jsou v České republice pro léčbu lokálně pokročilého a metastatického NSCLC k dispozici inhibitory PD-1 nivolumab a pembrolizumab a inhibitory PD-L1 atezolizumab a durvalumab.
Klinické studie prokazující vyšší účinnost imunoterapie v monoterapii vs. CHT
Studie CheckMate 017 a CheckMate 057
Nivolumab byl zaveden do 2. linie léčby NSCLC na základě studie CheckMate 017 (skvamózní) a studie CheckMate 057 (neskvamózní). V obou studiích bylo dosaženo prodloužení OS (overall survival). U skvamózního typu byl medián (m) OS u nivolumabu 9,2 měsíce oproti docetaxelu s 6,0 měsíce. Riziko úmrtí bylo u pacientů s nivolumabem sníženo o 41 %. U neskvamózního karcinomu byl mOS s nivolumabem 12,2 měsíce oproti 9,4 měsíce při léčbě docetaxelem. V této studii byla exprese PD L1 spojena s lepšími výsledky léčby nivolumabem a účinnost terapie byla prokázána napříč všemi hodnotami receptorů PD-L1. Pozdější analýzou bylo zjištěno pětileté přežití u 13,4 % pacientů s nivolumabem a 2,6 % pacientů s CHT.
Studie KEYNOTE-024
Na základě studie, která porovnává účinnost pembrolizumabus CHT (platinový dublet), se monoterapie pembrolizumabem stala standardní léčbou v 1. linii NSCLC s PD-L1 > 50 %. Tato studie prokázala prodloužení PFS (progression-free survival) a OS ve větvi s pembrolizumabem (PFS 10,3 měsíce u pembrolizumabu vs. 6,0 měsíce u CHT). Podle pozdější analýzy bylo pětileté přežití ve větvi s pembrolizumabem skoro dvojnásobné oproti větvi s CHT (31,9 vs. 16,3 %). Medián OS byl 26,3 měsíce vs. 13,4 měsíce.
Studie POPLAR a OAK
Dvě studie prokázaly benefit atezolizumabu v OS proti CHT u pacientů s již předléčeným pokročilým/metastatickým onemocněním.
Ve studii POPLAR bylo delší OS ve větvi s atezolizumabem (mOS 12,6 vs. 9,7 měsíce s docetaxelem). Čtyřleté přežití
v této studii bylo 14,8 %, resp. 8,1 %.
Ve studii OAK byl mOS významně prodloužen u atezolizumabu (13,3 vs. 9,8 měsíce). Čtyřleté přežití bylo 15,5 % pro atezolizumab a 8,7 % pro docetaxel. Atezolizumab prokázal prodloužené přežití napříč všemi skupinami PD-L1 exprese a histologickými typy.
Studie IMpower 110
Ve studi IMpower 110 byla srovnávána účinnost atezolizumabu oproti CHT s platinovým derivátem v 1. linii léčby skvamózního i neskvamózního NSCLC s PD-L1 expresí ≥ 1. Primárním cílem bylo hodnocení OS podle exprese PD-L1. V podskupině s nejvyšší expresí PD-L1 byl OS delší o 7,1 měsíce ve větvi s atezolizumabem než ve větvi s CHT (20,2 vs. 13,1 měsíce). Touto studií byla prokázána signifikantně delší doba OS při léčbě atezolizumabem vs. CHT s platinovým derivátem u pacientů s vysokou expresí PD-L1 nezávisle na histologickém typu nádoru.
Klinické studie s kombinovanou imunoterapií
Studie CheckMate 227
Studie CheckMate 227 prokázala prodloužení OS v 1. linii léčby NSCLC kombinací nivolumabuaipilimumabu ve srovnání s CHT u pacientů nezávisle na úrovni exprese PD-L1. Medián OS byl 17,1 měsíce ve větvi s nivolumabem/ipilimumabem a 13,9 měsíce s CHT. Čtyřleté přežití u pacientů s PD-L1 expresí ≥ 1 % bylo u 29 vs. 18 %. U nemocných s PD-L1 < 1 % bylo 4leté přežití ve 24 vs. 10 % pacientů léčených CHT.
Klinické studie prokazující vyšší účinnost chemoimunoterapie vs. CHT
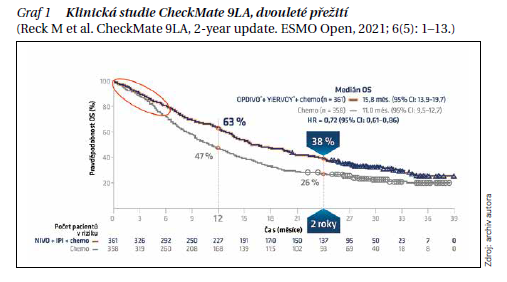
Studie CheckMate 9LA
Studie CheckMate 9LA řeší, zda přidání 2 cyklů chemoterapie ke kombinaci imunoterapie nivolumab/ipilimumab povede k rychlejšímu nástupu účinku léčby a následně k dlouhodobému trvání léčebné odpovědi za zachování přijatelné toxicity. V experimentální větvi byl mOS 15,6 vs. 10,9 měsíce v kontrolní skupině. Analýza po 2 letech potvrdila vyšší účinnost kombinované imunoterapie s chemoterapií. Dvouleté OS bylo 38 vs. 26 % (graf 1). Výhoda v přežití byla pozorována ve všech klíčových podskupinách, včetně exprese PD-L1 a histologie.
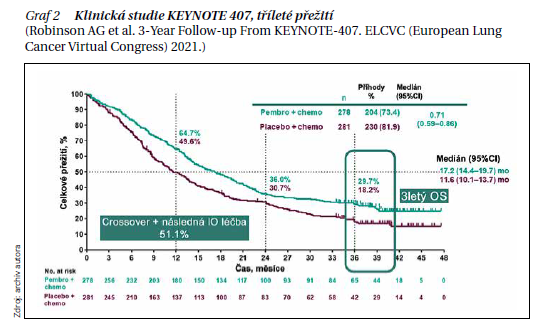
Studie KEYNOTE-189 a 407
V těchto dvou studiích bylo prokázáno prodloužené OS přidáním pembrolizumabu k platinové dvojkombinaci
v 1. linii léčby. Ve studii KEYNOTE-189 (neskvamózní NSCL) měl léčebný triplet (platinový derivát, pemetrexed
a pembrolizumab) delší PFS a OS ve srovnání s CHT (mPFS byl 8,8 vs. 4,9 měsíce, mOS 22 vs. 10,7 měsíce). Tento benefit byl nezávislý na stavu PD-L. Podle pozdější analýzy bylo tříleté přežití 31,3 vs. 17,4 %. Ve studii KEYNOTE-407 (skvamózní NSCLC) byla srovnávána léčba kombinací (pembrolizumab, platinový derivát, paklitaxel) s CHT (paklitaxel nebo nab-paklitaxel). Finální analýza potvrdila v rameni s pembrolizumabem prodloužení OS (17,1 vs. 11,6 měsíce)
a prodloužení PFS (8 vs. 5,1 měsíce), výsledek byl pozitivní nezávisle na PD-L1 expresi. Tříleté přežití bylo ve 29,7 % u pembrolizumabem vs.18,2 % ve větvi s CHT (graf 2).
Kombinace chemoimunoterapie s antiangiogenní léčbou
Studie IMpower 150
Ve studii IMpower 150 byli nemocní s dříve neléčeným neskvamózním NSCLC randomizováni do větví ACP (atezolizumab, karboplatina a paklitaxel), BCP (bevacizumab, karboplatina a paklitaxel) a ABCP (atezolizumab, bevacizumab, karboplatina a paklitaxel).
Primárním cílem studie byl PFS a OS. Medián PFS byl delší v rameni ABCP ve srovnání s BCP (8,3 vs. 6,8 měsíce). PFS byl delší ve větvi ABCP vs. BCP skupině v celé ITT (intention-to-treat) populaci (včetně pacientů s EGFR nebo ALK alteracemi) a také u pacientů s nízkou nebo negativní expresí PD-L1 a u pacientů s jaterními metastázami.
Konsolidační imunoterapie po konkomitatní chemoradioterapiii (CRT)
Studie PACIFIC
Studie PACIFICpotvrdila účinnost konsolidační léčby durvalumabem po standardní CRT u pacientů s lokálně pokročilým inoperabilním NSCLC prodloužením přežití a doby bez progrese (mPFS s durvalumabem byl 16,8 vs.
5,6 měsíce s placebem). Osmnáctiměsíční PFS bylo ve větvi s durvalumabem 44,2 vs. 27 %. Čtyř let se dožilo 49,6 % pacientů s léčbou durvalumabem a 36,3 % s placebem. Čas bez progrese (PFS) po 48 měsících byl pozorován
u 35,3 % pacientů s durvalumabem oproti 19,5 % s placebem.
Postavení imunoterapie v léčbě časného NSCLC
Imunoterapie v rámci neoadjuvantní léčby NSCLC
V léčbě časných stadií onemocnění (st. IB–IIIA) imunoterapie dosud není součástí standardních léčebných doporučení. Cílem předoperační systémové léčby u resekabilních NSCLC je redukce velikosti nádoru, zvýšení počtu R0 resekcí a ovlivnění časných mikrometastáz. Podle metaanalýzy 15 klinických studií u NSCLC došlo u pacientů s neoadjuvantní CHT k 10% redukci vzdálených metastáz za 5 let, k 13% snížení rizika úmrtí a 5% zlepšení v pětiletém přežití. V současné době probíhá více klinických studií hodnotících efekt imunoterapie samotné
a imunochemoterapie vs. CHT v neoadjuvantním podání.
Studie CheckMate 816 srovnává účinnost kombinace nivolumabu s CHT oproti samotné CHT v rámci neoadjuvantní léčby u resekabilního NSCLC. Primárním cílem bylo zhodnocení pCR (patologické kompletní remise) a EFS (event-free survival, přežití bez příhody), sekundárními cíli OS, čas do úmrtí nebo vzniku metastáz, hodnocení peri-
a postoperačních komplikací. U pacientů s nivolumabem došlo k pCR u 40 % pacientů v původním stadiu IB, u 23 % pacientů ve stadiu IIA, 24 % ve stadiu IIB a 23 % pacientů ve stadiu IIIB. Neoadjuvantní léčba kombinací nivolumab + CHT byla dobře snášena, přidání nivolumabu k CHT nezvýšilo pooperační komplikace.
Imunoterapie v rámci adjuvantní léčby NSCLC
Cílem adjuvantní systémové léčby je léčba mikrometastáz a zabránění vzniku lokální recidivy nádoru. Metaanalýza LACE (Lung Adjuvant Cisplatin Evaluation) prokázala 5,4% benefit adjuvantní CHT v pětiletém přežití u resekovaných pacientů. V současnosti probíhá více klinických stadií fáze II a III zabývajících se adjuvantní imunoterapií.
Ve studii IMpower010bylo prodlouženo DFS (disease-free survival, přežití bez onemocnění) u adjuvantní aplikace atezolizumabu u nemocných ve stadiu II–IIIA po 4 cyklech CHT (42,3 vs. 35,3 měsíce u kontrolní skupiny).
Závěr
Imunoterapie výrazně zlepšila výsledky léčby pacientů s NSCLC a stala se standardní léčbou metastastického
a lokoregionálně pokročilého inoperabilního onemocnění.
V České republice je v současné době hrazen zdravotními pojišťovnami v 1. linii pembrolizumab u pacientů s metastatickým NSCLC s expresí PD-L1 ≥ 50 % v monoterapii, u neskvamózního karcinomu lze podat kombinaci pembrolizumabu s CHT (pemetrexed + platina) u PD-L ≥ 1 %, u skvamózního typu s CHT (karboplatina + paklitaxel) s PD-L1 1–49 %, nivolumab v kombinaci s ipilimumabem a dvěma cykly CHT u pacientů se skvamózním a neskvamózním NSCLC s expresí PD-L1 0–49 %.
Ve 2. a vyšší linii onkologické léčby u pacientů ve stadiu IIIB nebo IV NSCLC lze předepsat nivolumab nebo atezolizumab v monoterapii. Durvalumab je hrazen v léčbě lokálně pokročilého, neresekabilního NSCLC s expresí PD-L1 ≥ 1 %, u kterého nedošlo k progresi onemocnění po CRT na bázi platiny.
Na základě výsledků klinických studií se lze domnívat, že imunoterapie samotná nebo v kombinaci s jinými léčivy nebo postupy (CHT, antiangiogenní léčba, cílená terčová léčba, radioterapie) bude dále zlepšovat léčebné výsledky onkologických onemocnění, včetně bronchogenního karcinomu. Se zvyšujícím se počtem léků v kombinacích se však může zvyšovat i horší tolerance nemocnými, proto je nutné co nejdříve identifikovat spolehlivé prediktivní biomarkery (míra exprese PD-L1, TMB, TIL nebo klonální profil T buněk), které pomohou vybrat pro každého pacienta nejúčinnější léčbu s přijatelnou toxicitou.
MUDr. Helena Čoupková
Klinika komplexní onkologické péče
Masarykův onkologický ústav, Brno
