Diabetická dyslipidemie představuje závažný rizikový faktor ischemické cévní mozkové příhody. Sdělení je věnováno vlivu jednotlivých hypolipidemik na výskyt CMP u diabetiků. Základem léčby diabetické dyslipidemie u nemocných po CMP je využití maximálně tolerované dávky statinu, eventuálně v kombinaci s ezetimibem, popřípadě s inhibitorem proprotein konvertázy subtilisin/kexin typu 9. Léčba však musí být komplexní a diabetici by měli mít adekvátní léčbu diabetu a hypertenze. Podle etiologie CMP je nutný i správný výběr antitrombotické léčby.
Diabetes mellitus (DM) představuje závažný rizikový faktor pro celou řadu kardiovaskulárních (KV) příhod včetně cévní mozkové příhody (CMP). Riziko ischemické (i-CMP) zvyšuje asi 2,3× a hemoragické CMP (h-CMP) asi 1,6×. Rozsáhlá metaanalýza, která zahrnula téměř 4 miliony pacientů s DM 2. typu, zjistila, že i-CMP prodělalo asi 7,6 % diabetiků. Naopak v souboru nemocných po CMP (n = 359 783) mělo diabetes28 % jedinců. Diabetes se podílí na patogenezi kardioembolizační i aterotrombotické i-CMP. V prvním případě hraje důležitou roli fibrilace síní. Přítomnost diabetu zvyšuje riziko fibrilace síní až o 35 %, přičemž rizikovější pro její vznik jsou zejména diabetičky, hůře kompenzovaní jedinci a pacienti s renálním postižením. Kromě strukturálních změn myokardu participuje na tromboembolických příhodách diabetiků i přítomná dysfunkce endotelu, koagulopatie a trombopatie. Tyto faktory mají vliv i na vývoj aterotrombotických CMP. Zde se navíc uplatňuje kumulace rizikových faktorů aterosklerózy, jako jsou dyslipidemie, hypertenze či viscerální obezita, které provázejí hlavně DM 2. typu. Tato situace vyžaduje komplexní intervenci všech rizikových faktorů, včetně adekvátní léčby diabetické dyslipidemie.
Diabetická dyslipidemie
Základním patogenetickým mechanizmem pro vznik této metabolické poruchy je inzulinová rezistence. Nedostatečné působení inzulinu v tukové tkáni vede k lipolýze a zvýšené nabídce volných mastných kyselin, které nejsou využity ve svalech, naopak se v nadbytku hromadí v játrech. Dalším zdrojem jsou volné mastné kyseliny produkované střevem a jejich zvýšená lokální produkce v samotných hepatocytech. V játrech pak vlivem hyperinzulinemie dochází ke zvýšené syntéze triglyceridů (TG) i cholesterolu a k nadměrné tvorbě lipoproteinů o velmi nízké hustotě (VLDL). To spolu s jejich pomalým odstraňováním z cirkulace vede ke zmnožení velkých VLDL v krvi a projeví se hypertriglyceridemií. Zvýšená produkce na TG bohatých VLDL částic a jejich snížená degradace mají za následek vznik malých denzních lipoproteinů o nízké hustotě (sdLDL), které se přímo podílí na iniciaci a progresi aterosklerotických změn. Negativní roli sehrává i cholesterol-ester transfer protein, který transportuje TG z VLDL do lipoproteinů o vysoké hustotě (HDL) i do LDL. Ty se tak stávají bohaté na TG a jsou vychytávány v játrech, kde se účinkem jaterní lipázy mění na menší, dysfunkční smHDL (HDL2 → HDL3) a na sdLDL. Dysfunkční smHDL podléhají rychlejšímu odstraňování z cirkulace, a vázne tak reverzní transport cholesterolu (obrázek 1).
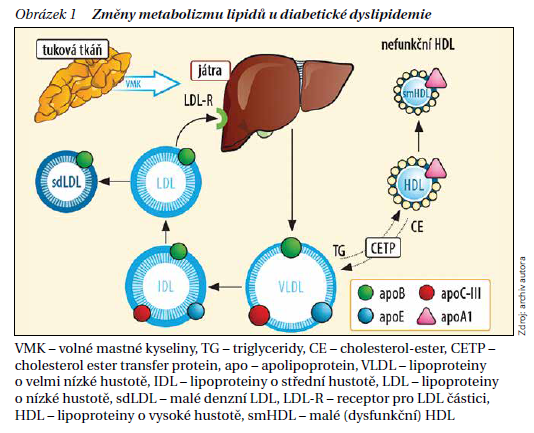
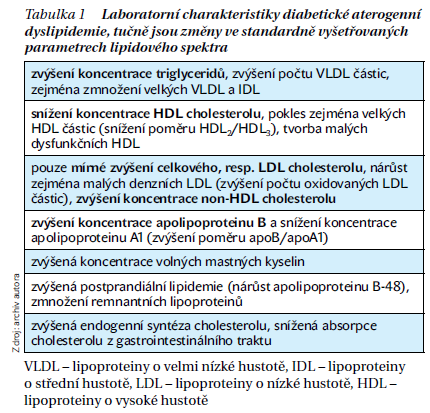
Popsané změny mají tedy za následek zvýšení hladin TG a snížení hladin HDL cholesterolu (HDL-C). Celkový, respektive LDL cholesterol (LDL-C) bývá často jen mírně zvýšený, nicméně jsou patrné kvalitativní změny lipidového spektra. Základní triádu této aterogenní dyslipidemie představuje elevace TG, snížení HDL-C a zvýšení počtu sdLDL částic. To můžeme detekovat nárůstem koncentrace apoB, který je hlavním apolipoproteinem těchto aterogenních částic. Podobnou informaci nám poskytne i non-HDL-cholesterol (non-HDL-C = celkový cholesterol – HDL-C) jako nástroj pro měření cholesterolu, který je obsažen v hlavních aterogenních lipoproteinech. Výpočet non-HDL-C a stanovení hladin apoB jsou jednoduché a běžně dostupné parametry, díky kterým můžeme zjistit aterogenní potenciál dyslipidemie, a to i v případě, že hladiny LDL-C nejsou významně zvýšené. Jedná se také o sekundární cíle hypolipidemické léčby. Základní kvantitativní i kvalitativní změny lipidového spektra charakteristické pro diabetickou aterogenní dyslipidemii udává tabulka 1.
Diabetická dyslipidemie a ischemická CMP
Vztah mezi hyperlipidemií a i-CMP není tak jednoznačný jako v případě ICHS. Např. studie ARIC, která sledovala 10 let více než 14 000 jedinců v primární prevenci, zaznamenala jen slabou a nekonzistentní asociaci mezi výskytem i-CMP a pěti hlavními lipidovými faktory (LDL-C, HDL-C, apoB, apoA1 a TG). Výsledky nedávných studií u jedinců s familiární hypercholesterolemií neprokázaly zvýšení rizika i-CMP nebo jiných cerebrovaskulárních onemocnění. Na druhou stranu v případě aterogenní dyslipidemie a metabolického syndromu je situace odlišná. Např. Northern Manhattan Study zjistila, že přítomnost metabolického syndromu zvyšuje riziko i-CMP asi 1,5×. Ve velké (n = 26 919) mezinárodní studii INTERSTROKE měli jedinci s nejvyšší hodnotou poměru apoB/apo asi 2,2× vyšší pravděpodobnost vzniku i-CMP. Asi nejvíce přesvědčivé z pohledu diabetické dyslipidemie jsou výsledky prospektivního sledování v programu Strong Heart Study. Do něj byli zařazeni jedinci v primární prevenci (n = 3 216), z nichž asi 40 % mělo diabetes. Signifikantně vyšší riziko i-CMP (HR = 2,13 [1,06–4,29]) bylo pozorováno pouze u jedinců s nízkým HDL-C a zvýšenou hladinou TG, kteří měli zároveň diabetes. Je evidentní, že díky inzulinové rezistenci diabetická dyslipidemie s sebou nese nejen proaterogenní, ale i protrombogenní a prozánětlivý potenciál, které se na komplexní patogenezi i-CMP mohou také uplatnit.
Principy léčby diabetické dyslipidemie
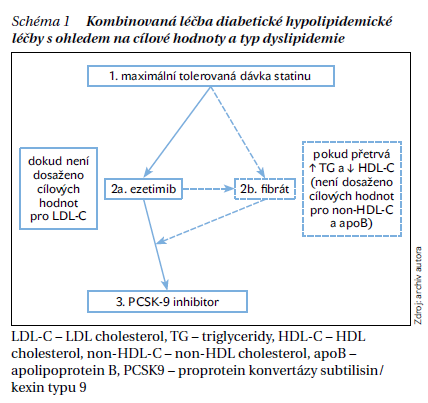
Léčba diabetické dyslipidemie by měla zahrnovat nefarmakologické prostředky, které vedou k úpravě životního stylu, redukci hmotnosti a zvýšené fyzické aktivitě nemocných, a taktéž adekvátní farmakoterapii diabetu. Vlastní léčba diabetu by kromě glykemické kompenzace měla respektovat i to, že nemocní po CMP představují jedince s velmi vysokým, v mnoha případech i s extrémním KV rizikem. Proto by měla být využita antidiabetika (analoga GLP-1 receptorů, glifloziny a pioglitazon), jež KV riziko prokazatelně snižují. V případě DM 2. typu však ani optimální glykemická kontrola nebývá provázena normalizací lipidového spektra, protože inzulinová rezistence, základní příčina dyslipidemie, nadále trvá. Proto je u naprosté většiny nemocných nutná hypolipidemická léčba. Primárním cílem je redukce LDL-C a lékem první volby jsou statiny. Důležité je využití potenciálu jejich vysokých dávek, neboť jen ty jsou schopny snížit LDL-C o více než 50 %. Hypolipidemickou terapii však nelze zredukovat jen na léčbu statiny, protože i přes podání jejich maximálních dávek nejsme vždy schopni dosáhnout cílových hodnot LDL-C, popřípadě dalších cílových parametrů, jako jsou non-HDL-C nebo apoB. Navíc velká část nemocných statiny, zejména jejich vyšší dávky, netoleruje. V těchto případech musíme využít i jiná hypolipidemika, zejména ta, o nichž v současné době máme důkazy, že prokazatelně redukují výskyt KV příhod (schéma 1).
Statiny
Statiny představují základní pilíř léčby diabetické dyslipidemie, protože máme nejvíc důkazů, že jednoznačně snižují KV riziko nemocných. Jejich dominujícím hypolipidemickým efektem je pokles apoB obsahujících lipoproteinů, což se projeví zejména snížením koncentrace LDL-C. Léčba statiny je provázena redukcí LDL-C o 25–60 %, TG o 5–20 % a variabilním vzestupem HDL-C o 5–10 %. Příznivou změnu lipidového profilu provází také pokles hladin non-HDL-C a apoB.
Jak ukázala metaanalýza 18 686 osob s diabetem léčených pomocí statinů, je každé snížení koncentrace LDL-C o 1 mmol/l provázeno poklesem koronárních příhod o 22 %, koronárních revaskularizací o 25 %, CMP o 21 %, kardiovaskulární mortality o 13 % a celkové mortality o 9 %. Studie SPARCL, která proběhla u jedinců po tranzitorní ischemické atace nebo CMP, sledovala efekt 80 mg atorvastatinu vůči placebu a zaznamenala za necelých 5 let redukci rekurence všech CMP o 16 % (i-CMP o 21 %). U jedinců, kteří do studie vstoupili po hemoragické CMP, byl při léčbě atorvastatinem sice registrován o něco větší počet recidiv h-CMP, nicméně jiné studie a metaanalýzy toto riziko nepotvrdily. Navíc u nemocných s diabetem nebyl vyšší počet h-CMP zjištěn ani ve studii SPARCL, přičemž z hlediska i-CMP profitovali z léčby statiny obdobně jako jedinci bez diabetu.
Statiny jsou tedy první volbou léčby diabetické dyslipidemie, která prokazatelně snižuje riziko i-CMP, a to jak v primární, tak v sekundární prevenci.
Ezetimib
Ezetimib je dalším lékem primárně snižujícím hladinu LDL-C. Monoterapie ezetimibem v dávce 10 mg vede k redukci LDL-C okolo 10–20 %. Jeho přidání ke statinu je pak účinnější než zdvojnásobení dávky statinu a je srovnatelné se zvýšením dávky statinu asi na trojnásobek. Podle některých dat se zdá, že kombinace statin + ezetimib je v redukci LDL-C úspěšnější právě u nemocných s diabetem. Možným vysvětlením by mohla být zvýšená exprese Niemann-Pick C1 like 1 proteinu na povrchu enterocytů v důsledku chronické hyperglykemie.
Nejvíc důkazů o prospěšnosti léčby ezetimibem na redukci KV rizika u diabetiků máme ze studie IMPROVE‑IT. Porovnávala efekt kombinace 40 mg simvastatinu a 10 mg ezetimibu vůči 40 mg simvastatinu podávaného samostatně u nemocných s akutním koronárním syndromem. Během sedmi let bylo ve skupině užívajících kombinační léčbu zaznamenáno o 170 KV příhod méně než ve skupině léčených pouze simvastatinem, což odpovídá poklesu KV rizika o 6,4 %. Významně většího ovlivnění výskytu KV příhod bylo dosaženo ve skupině diabetiků. Pokles rizika v diabetické populaci dosáhl 15 %, což bylo dáno především významnou redukcí nefatálních infarktů myokardu a i-CMP. Bližší analýza zjistila, že přidání ezetimibu bylo provázeno poklesem i-CMP o 21 %, přičemž nejvíce profitovali jedinci s již prodělanou CMP a nemocní s diabetem.
Ezetimib je tedy dalším lékem, který významně snižuje riziko i-CMP, a to především u diabetiků. V případě diabetické dyslipidemie se tak jedná o lék nejvhodnější do kombinace se statiny. Adherenci nemocných může zvýšit řada fixních kombinovaných preparátů, jež jsou v současné době k dispozici.
Inhibitory proprotein konvertázy subtilisin/kexin typu 9 (PCSK9)
PCSK9 inhibitory jsou reprezentanti inovativní hypolipidemické léčby, která může též najít uplatnění u nemocných s diabetickou dyslipidemií. V současné době máme k dispozici jednak monoklonální protilátky, které snižují cirkulující hladiny PCSK9, a další možností je inhibice syntézy PCSK9 prostřednictvím inklisiranu. Jedná se o malou interferující siRNA, která se pomocí tzv. RISC (RNA-induced silencing complex) podílí na vyhledání a degradaci specifické mRNA, jež má sloužit pro syntézu PCSK9, přímo v cytoplazmě hepatocytů. Inhibice produkce či zabránění působení PCSK9 je provázeno zvýšenou recyklací LDL receptorů na povrch buněčné membrány. Díky tomu se akceleruje clearance apoB obsahujících lipoproteinů (zejména LDL částic) a klesá jejich plazmatická koncentrace.
PCSK9 inhibitory v průměru snižují hladinu celkového cholesterolu o 25–40 %, LDL-C o 50–65 %, TG o 8–20 % a zvyšují koncentraci HDL-C o 5–9 %. Jako jedny z mála dostupných hypolipidemik vedou k významnému poklesu lipoproteinu(a), a to asi o 20–30 %. Z hlediska aterogenní dyslipidemie je důležitý jejich vliv i na hladiny non-HDL-C a apoB. U nemocných s diabetickou dyslipidemií vede podávání alirokumabu či evolokumabu k poklesu non-HDL-C o 40–55 % a apoB o 30–50 %. K dispozici máme i výsledky velkých studií, které hodnotily efekt dlouhodobé terapie monoklonálními protilátkami proti PCSK9 na výskyt hlavních KV příhod.
Ve studii FOURIER bylo podávání evolokumabu u celkem 27 564 vysoce rizikových nemocných s prokázaným stabilním KV onemocněním provázeno 15% redukcí primárního kompozitního cíle (KV úmrtí, nefatálního infarktu myokardu, CMP, nestabilní anginy pectoris a koronární revaskularizace) a 20% redukcí sekundárního cíle (KV úmrtí, nefatálního infarktu myokardu a CMP). V subanalýze, která zvlášť hodnotila diabetiky a nediabetiky, bylo dosaženo obdobných výsledků bez ohledu na přítomnost diabetu. U diabetiků došlo k 17% redukci primárního a k 13% redukci sekundárního cíle. Vzhledem tomu, že výskyt KV příhod byl u diabetiků vyšší než u ostatních jedinců, byl zaznamenán větší pokles jejich absolutního rizika (2,7 vs. 1,6 %), a to zejména díky větší redukci koronárních revaskularizací. Do studie ODYSSEY OUTCOMES bylo zařazeno 18 924 jedinců s anamnézou akutního koronárního syndromu. Léčba alirokumabem vedla k 15% redukci primárního endpointu (úmrtí pro ICHS, nefatálního IM, hospitalizací pro nestabilní anginu pectoris a ischemických CMP) a k 14% redukci dalšího tříbodového kompozitního cíle (úmrtí z jakékoli příčiny, nefatálního IM a CMP). U nemocných po akutním koronárním syndromu byla léčba alirokumabem provázena i poklesem celkové mortality. Účastníci byli hodnoceni také zvlášť podle přítomnosti diabetu, respektive prediabetu. U diabetiků i u jedinců s prediabetem či s normoglykemií bylo dosaženo prakticky stejného poklesu relativního rizika primárního endpointu (16 vs. 14 vs. 15 %). Nicméně ze stejného důvodu jako ve studii FOURIER byla taktéž největší redukce absolutního rizika KV příhod (2,3 vs. 1,2 vs. 1,2 %) registrována u diabetiků.
Výsledky dvou velkých metaanalýz ukázaly, že PCSK9 inhibitory významně snižují výskyt i-CMP a nemají vliv na počet h-CMP. Lze předpokládat, že jejich efekt bude obdobný bez ohledu na přítomnost diabetu, jak napovídá analýza zaměřená na výskyt všech hlavních KV příhod u diabetiků a ostatních jedinců. Hlavní limitací terapie pomocí PCSK9 inhibitorů je jejich vysoká cena a z toho vyplývající omezení pro úhradu z prostředků veřejného zdravotního pojištění.
Fibráty
Fibráty tvoří další skupinu léků, které můžeme využít v léčbě diabetické dyslipidemie. V průměru jsou schopny snížit hladinu celkového cholesterolu o 10–25 %, LDL-C o 5–15 %, TG o 20–50 % a zvýšit hladinu HDL-C o 5–20 %. Jejich efekt na redukci LDL-C je tedy malý, mohou však přispět k příznivým kvalitativním změnám lipidového spektra (vedou k poklesu smLDL). U nemocných s diabetem může být výhodné podávání fenofibrátu, neboť výsledky studie FIELD i ACCORD ukazují na jeho příznivé ovlivnění mikrovaskulárních komplikací, především diabetické retinopatie a nefropatie.
Ovlivnění makrovaskulárních komplikací a KV rizika pomocí fibrátů je ve srovnání se statiny méně významné. Ve studii FIELD fenofibrát sice signifikantně snížil výskyt KV příhod, a to díky redukci nefatálních infarktů myokardu a koronárních revaskularizací, nevedl však k poklesu CMP, KV ani celkové mortality. Ve studii ACCORD nebylo přidání fenofibrátu k simvastatinu provázeno poklesem počtu KV příhod, včetně CMP. Také následné metaanalýzy neprokázaly efekt fibrátů na redukci výskytu CMP v primární či sekundární prevenci, a to včetně nemocných s diabetem.
Závěr
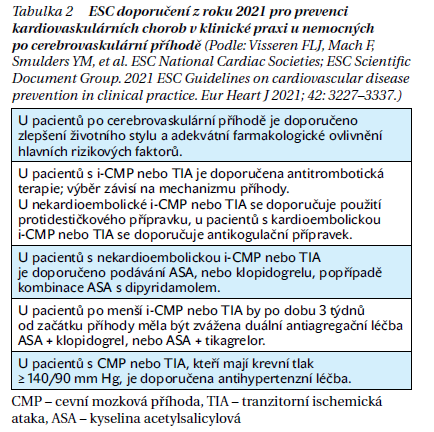
Dyslipidemie se významnou měrou podílí na KV riziku diabetiků, a to včetně rizika i-CMP. Toto riziko vyplývá nejen z vlastního aterogenního potenciálu diabetické dyslipidemie, ale též z kumulace dalších rizikových faktorů (hypertenze, hyperglykemie, viscerální obezity s chronickým zánětem a prokoagulačním stavem), které provázejí zejména diabetes 2. typu. Kromě terapie dyslipidemie zahrnující využití maximálně tolerované dávky statinu, eventuálně v kombinaci s ezetimibem, popřípadě PCSK9 inhibitorem, musí být diabetici po CMP také adekvátně léčeni z hlediska vlastního diabetu, hypertenze a podle etiologie i-CMP je nutný též správný výběr antitrombotické léčby (tabulka 2).
Podpořeno grantem MZ ČR – RVO (FNOL, 00098892).
prof. MUDr. David Karásek, Ph.D.
III. interní klinika – nefrologická, revmatologická a endokrinologická LF UP
a FN Olomouc
