Karcinom vaječníku se považuje za chemosenzitivní nádor. Dosud nepřekonaným standardem adjuvantní chemoterapie je kombinace platinového derivátu s taxanem. V posledních dekádách vstupuje do léčebného schématu cílená léčba PARP inhibitory, antiangiogenními preparáty ze skupiny monoklonálních protilátek a tzv. checkpoint inhibitory (s omezením na podávání v klinických studiích) patřícími mezi imunoterapeutika.
Termín karcinom vaječníku v současné době zahrnuje široké spektrum histopatologických entit, které mají původ v maligních kmenových buňkách pocházejících z mülleriánského traktu; patří sem i karcinomy z vejcovodu a karcinomy primárně diagnostikované na pobřišnici. Stále platí, že pro tyto nádory neexistuje populační screeningová metoda, a to ani pro rizikové skupiny pacientek. Nejčastějším histopatologickým typem onemocnění je high grade serózní ovariální karcinom.
Více než dvě třetiny případů onemocnění jsou diagnostikovány v lokálně pokročilém stadiu (diseminace po peritoneu a serózních površích pánevních a břišních orgánů). Jedná se o onemocnění s frekventní vazbou na germinální a/nebo somatické mutace. Pro pokročilá onemocnění jsou typické recidivy, jedním z prognostických faktorů je právě doba do první recidivy onemocnění. Nejvíce účinným modem onkologické léčby je operační výkon provedený radikálně do makroskopicky nulového rezidua.
Karcinom vaječníku je zastřešující termín pro skupinu onemocnění původem z epitelu vaječníků, vejcovodů nebo vznikajících primárně na peritoneu. Souhrnně se jedná o nádory se srovnatelným morfologickým vzhledem, biologickým chováním, léčebnou odpovědí a prognózou. I přes prokázaný původ ve vejcovodu nebo na peritoneu pánve hovoříme obecně o karcinomu vaječníku. Tyto karcinomy mají společnou TNM a FIGO klasifikaci a mají jednotné diagnostické a léčebné protokoly.
Incidence a mortalita
Karcinom vaječníku má nejvyšší mortalitu z gynekologických malignit v euroatlantické populaci. V České republice je ročně diagnostikováno přibližně 1 000 nových případů onemocnění, což odpovídá incidenci asi 16,42 nového případu na 100 000 žen za rok (údaj pro rok 2020); mortalita se pohybuje okolo 700 případů za rok (graf 1). I s vědomím, že nedokážeme predikovat trend do budoucna, můžeme z uvedeného grafu odhadovat jistý pokles incidence a mortality v posledních několika letech, jehož příčiny jsou spekulativní (vliv dlouhodobého užívání hormonální antikoncepce, zvýšený podíl genetického testování a profylaktické operace u nosiček specifických mutací, erudice gynekologů v ultrazvukové diagnostice adnexálních tumorů a cílené operace u suspektních útvarů?).
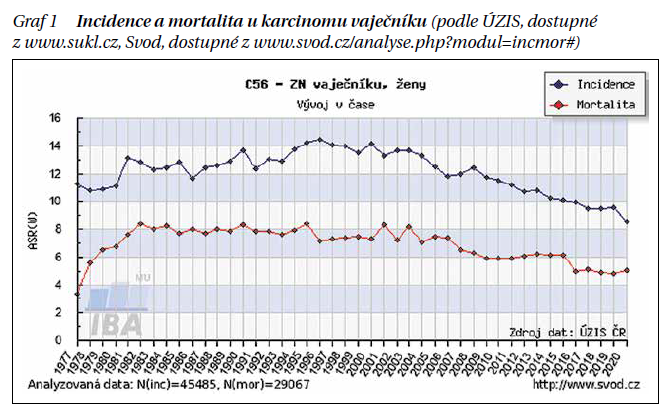
Ve Spojených státech amerických je za rok 2020 uvedeno 21 tisíc nových případů onemocnění a necelých 14 tisíc úmrtí na toto onemocnění za týž rok. Pro celou Evropu se za rok 2020 uvádí 29 tisíc úmrtí na vrub karcinomu vaječníku.
Genové mutace a systémová léčba
Díky poznání na úrovni genetiky nádorových onemocnění byly již na přelomu tisíciletí známy geny, jejichž mutace souvisí s vývojem karcinomů vaječníků a prsů, tzv. BRCA 1 a BRCA 2 geny. Tyto geny ve své nemutované podobě řídí opravy dvouvláknových zlomů DNA. Další skupinou jsou karcinomy, které souvisí s mutacemi ve skupině genů pro homologií řízenou opravu (tzv. homology directed repair – HDR, např. mutace RAD51, CHEK2, ATM, PALB2). Pacientky s mutacemi v HDR systému se označují jako pacientky HDR deficientní, oproti HDR proficientním, bez nalezených mutací v systému HDR. Celoživotní riziko vzniku karcinomu vaječníku v obecné populaci bez genetické zátěže se obvykle udává jako číslo nižší než 2 %. U nosiček mutace BRCA 1 se celoživotní riziko vzniku karcinomu vaječníku zvyšuje na 40–60 % a u nosiček BRCA 2 mutace je to odhadem 10–40 %. Riziko vzniku onemocnění strmě stoupá od 35., resp. 40. roku věku u BRCA 1 mutace, u BRCA 2 mutace je riziko vyšší od 50. roku věku. Podle doporučení odborných společností jsou všechny pacientky s karcinomem vaječníku indikovány ke genetickému testování, žádanku obvykle vystavuje lékař, který přebírá výsledek histopatologického vyšetření, tzn. gynekolog, onkogynekolog, klinický onkolog, a odesílá pacientku do akreditovaného zařízení, jež provádí genetické vyšetření pacientů s nádorovým onemocněním. Somatické mutace v nádorových buňkách jsou zahrnuty v souhrnné zprávě z patologického vyšetření nádoru, obvykle v kolonce prediktivní vyšetření (některé mutace lze stanovovat imunohistochemicky, jiné vyžadují analýzy nádorové DNA).
Informace a znalosti na úrovni mutací genů, které řídí opravy zlomů DNA, souvisejí úzce s pochopením mechanizmu účinků cílené léčby. Právě zásah do opravných systémů vede ke kumulaci mutací a tato kumulace je i pro nádorovou buňku letální. Jak mutace BRCA, tak mutace HDR invalidizují nádorovou buňku ve schopnosti opravovat svůj genetický materiál. Pokud navíc ještě cílenou léčbou zablokujeme náhradní opravné mechanizmy nebo způsobíme ještě více mutací (např. chemoterapií nebo zářením), dochází k účinnějšímu usmrcování maligních buněk a ke zlepšení terapeutických výsledků.
Obvykle se uvádí, že přibližně 70 % pacientek s pokročilým karcinomem vaječníku (klinické stadium III, tzn. diseminace v pánvi a na serózách břišních orgánů pro III. klinické stadium a vzdálené metastázy pro klinické stadium IV) je postiženo recidivou onemocnění, která nastává nejčastěji v prvních 3 letech od primární léčby. Čím dříve k recidivě dojde, tím méně je obvykle onemocnění citlivé na systémovou léčbu. S přibývajícími recidivami onemocnění se snižuje účinnost dostupných terapeutik. Recidivující pokročilý karcinom ovaria je v současné době nevyléčitelné onemocnění. Níže uvádíme přehled soudobých cílených preparátů, které vnášejí naději na prodloužení doby do progrese onemocnění a potenciálně i přispívají k prodloužení celkového přežívání pacientek s pokročilým karcinomem vaječníku.
Cílená terapie
Cílenou léčbou se myslí terapeutický zásah do konkrétního mechanizmu, který je pro další růst a úspěšné šíření maligního onemocnění v organizmu klíčový a jehož zablokováním dosahujeme léčebného úspěchu (tabulka 1). Úspěch je výsledně hodnocen jako parametr zlepšeného přežívání (overal survival – OS) nebo parametr prodloužení intervalu do recidivy/progrese onemocnění (obvykle disease free interval – DFI nebo progression free interval – PFI). Cílená léčba se vyděluje od konvenční chemoterapie právě svým vysoce specifickým účinkem. Cílená léčba má rovněž nežádoucí účinky, zpravidla se ale liší od chronicky v populaci známých nežádoucích účinků chemoterapie. Nejmarkantnější rozdíl je u protinádorové imunoterapie, kde nežádoucí účinky připomínají autoimunitní onemocnění. V terapeutickém portfoliu jednotlivých módů onkologické léčby (chirurgický výkon, chemoterapie, radioterapie, hormonální léčba, cílená léčba) jsou u karcinomu ovaria v současné době preparáty ze skupiny cílených léčiv i v režimech neoadjuvantních, tzn. na úplném začátku léčby.
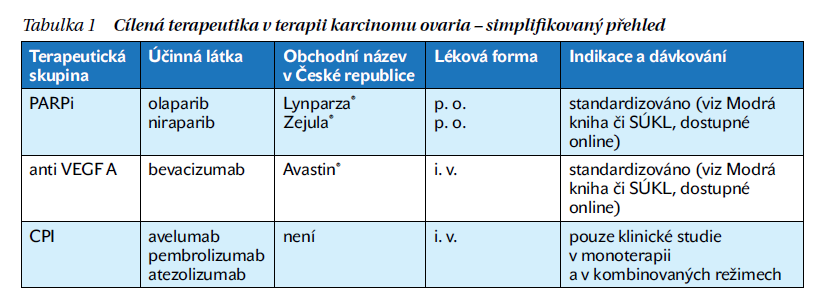
PARPi (inhibitory poly-adenosindifosfát-ribosa polymerázy)
Proteiny rodiny PARP hrají významnou roli v opravě jednovláknových zlomů DNA, a to mechanizmem nahrazování jednotlivých bází (base excision repair). Inhibice PARP vede k akumulaci jednovláknových zlomů DNA v jádře nádorové buňky, dochází ke kolapsu replikační vidlice a nahromadění dvouvláknových zlomů DNA. Dvouvláknové zlomy jsou opravovány jiným systémem, např. genovými produkty BRCA 1 a 2 genů. Tím se vysvětluje výborný efekt PARPi u pacientek s germinálními i somatickými mutacemi v genech BRCA. Dále z výše uvedeného vyplývá jasná indikace ke genetickému testování všech pacientek s nově zjištěným karcinomem ovaria a jsme o krok blíž ke konceptu individualizované protinádorové terapii, tzv. šité na míru, kdy správné pacientce podáváme správný lék ve správný čas. V současné době je v České republice ze skupiny PARPi schválen k podávání preparát olaparib (Lynparza) a niraparib (Zejula). Oba preparáty jsou v perorální podobě. V současné době je skupina PARPi velmi akcentovaná v souvislosti s prokázaným prodloužením intervalu do progrese. Důležitost udržovací léčby je především v první linii, ta je pro pacientku klíčová, jediná má kurativní záměr. Nejčastějším nežádoucím účinkem olaparibu je nauzea, anémie a hematologické nežádoucí účinky (anémie, leukopenie, trombocytopenie). U niraparibu převládá hematologická toxicita, zejména trombocytopenie.
Olaparib se v současné době podává v monoterapii:
- jako udržovací léčba dospělých pacientek s mutovaným BRCA1/2 genem (stadium III a IV podle FIGO) (zárodečná a/nebo somatická mutace), pokročilým high-grade epitelovým karcinomem vaječníku, vejcovodu nebo primárně peritoneálním karcinomem, které odpovídají (kompletní nebo částečná odpověď) na léčbu po ukončení první linie chemoterapie na bázi platiny;
- jako udržovací léčba dospělých pacientek s relabujícím high-grade epitelovým karcinomem vaječníku, vejcovodu nebo primárně peritoneálním karcinomem citlivým k platině, které odpovídají (úplná nebo částečná odpověď) na chemoterapii založenou na platině.
Olaparib v kombinaci s bevacizumabem se podává:
- jako udržovací léčba dospělých pacientek s pokročilým (stadium III a IV podle FIGO) high-grade epitelovým karcinomem vaječníků, vejcovodu nebo primárně peritoneálním karcinomem, které odpovídají (kompletní nebo částečná odpověď) na léčbu po ukončení první linie chemoterapie na bázi platiny v kombinaci s bevacizumabem a jejichž nádorové onemocnění je asociováno s pozitivním stavem poruchy homologní rekombinace (HDR) definovaným buďto mutací BRCA1/2, a/nebo genomovou nestabilitou.
Niraparib je používán v první i druhé linii a jeho podávání není podmíněno přítomností germinální nebo somatické mutace v genech BRCA 1 a 2 ani přítomností genomové nestability. V současné době se používá:
- jako monoterapie k udržovací léčbě dospělých pacientek s pokročilým high-grade epiteliálním karcinomem vaječníků (stadia FIGO III a IV), vejcovodů nebo primárním karcinomem peritonea, které odpovídají (úplná nebo částečná odpověď) po dokončení první linie chemoterapie založené na platině;
- jako monoterapie k udržovací léčbě dospělých pacientek s rekurentním a na léčbu platinou senzitivním high-grade serózním epiteliálním karcinomem vaječníků, vejcovodů nebo primárním karcinomem peritonea, které odpovídají (úplná nebo částečná odpověď) na chemoterapii založené na platině.
Bevacizumab (monoklonální protilátka proti vaskulárnímu endoteliálnímu růstovému faktoru A – anti VEGF A)
Bevacizumab (Avastin) má antiangiogenní účinek, redukuje nádorem indukovanou neovaskularizaci, působí tedy v nádorovém mikroprostředí. U karcinomu ovaria se bevacizumab používá v primární léčbě i v léčbě recidiv. Pokud ho přidáváme k chemoterapii 1. linie, obvykle po 6. sérii chemoterapie následuje monoterapie bevacizumabem, která může probíhat po dobu 1 roku ve frekvenci aplikace à 3 týdny. Preparát se podává intravenózně. Popsaný režim můžeme používat i v neoadjuvantním podávání s vmezeřenou intervalovou operací. V léčbě recidiv se bevacizumab indikuje v kombinaci s konvenční chemoterapií (viz níže). Mezi časté nežádoucí účinky patří výskyt hypertenze všech stupňů a zvýšená incidence tromboembolických příhod, logicky může být porušeno hojení operačních ran, lze očekávat zvýšené peroperační a pooperační krvácení. Byly popsány i případy vzniku spontánních perforací a píštělí v gastrointestinálním traktu.
Bevacizumab v kombinaci s karboplatinou a paklitaxelem je indikován:
- k úvodní léčbě dospělých pacientek s pokročilým (stadia III B, III C a IV podle klasifikace Mezinárodní federace gynekologie a porodnictví [International Federation of Gynecology and Obstetrics – FIGO]) epitelovým nádorem vaječníků, vejcovodů nebo primárním nádorem pobřišnice.
Bevacizumab v kombinaci s karboplatinou a gemcitabinem nebo v kombinaci s karboplatinou a paklitaxelem je indikován:
- k léčbě dospělých pacientek s první rekurencí epitelového nádoru vaječníků, vejcovodů nebo primárního nádoru pobřišnice citlivého na platinu, které nebyly dosud léčeny bevacizumabem nebo jiným inhibitorem růstového faktoru cévního endotelu (VEGF) nebo receptoru VEGF.
Bevacizumab v kombinaci s paklitaxelem, topotekanem nebo pegylovaným liposomálním doxorubicinem je indikován:
- k léčbě dospělých pacientek s rekurencí epitelového nádoru vaječníků, vejcovodů nebo primárního nádoru pobřišnice rezistentního k platině, které nebyly léčeny více než dvěma předchozími režimy chemoterapie a které nebyly dosud léčeny bevacizumabem nebo jiným inhibitorem růstového faktoru cévního endotelu (VEGF) nebo receptoru VEGF.
Checkpoint inhibitory (CPI, blokáda kontrolních bodů imunitní reakce)
Obecnou podstatu fungování CPI je možné vysvětlit na pochodech v imunitním systému člověka při obraně proti infekčnímu agens. CPI jsou regulátory zachování homeostázy v imunitním systému mezi obrannými a agresivními kaskádami na straně jedné a za zastavení antiinfekčních pochodů na straně druhé tak, aby agresivní produkty imunitních reakcí nedestruovaly vlastní tkáně a orgány. Tedy když je infekce zvládnuta, vznikají inhibiční signály, které postupně převládnou nad aktivačními signály a exekutor v antiinfekčním boji – cytotoxický T lymfocyt – je inaktivován. Nádorové mikroprostředí je charakteristické akcentací inhibičních signálů. CPI jsou preparáty, které umožňují aktivaci signálních kaskád k obnovení funkce cytotoxických T lymfocytů a zesílení imunitních reakcí proti nádorovým tkáním.
Patří sem například atezolizumab (IgG1 protilátka proti ligandu programované buněčné smrti PD-L1), nivolumab (vazbou na receptor PD1 znemožňuje inaktivaci cytotoxického T lymfocytu), stejný mechanizmus účinku má pembrolizumab. Ipilimumab inaktivuje inhibiční molekulu CTLA-4. Durvalumab blokuje ligand receptoru PD-L1. Nežádoucí účinky imunoterapie souvisí s porušením tolerance k vlastním nenádorovým tkáním. Tyto projevy připomínají autoimunitní onemocnění a označují se jako imunitně podmíněné vedlejší účinky (immune related adverse effects – irAE). Mohou být orgánově specifické a nespecifické, z hlediska časové osy mohou být časné a pozdní. irAE může postihnout jakýkoliv orgán. Empiricky bylo zjištěno, že rozvoj nežádoucího vedlejšího účinku imunoterapie je doprovázen lepší a déle trvající léčebnou odpovědí.
V současné době není žádný CPI schválen v České republice k léčbě karcinomu ovaria, nicméně probíhá celosvětově řada klinických studií, jejichž dosud publikované interim analýzy jsou spíše rozporuplné (na nepřesvědčivých výsledcích se podílí vysoká heterogenita nádorů, výrazně imunosupresivní nádorové mikroprostředí a nízká imunogenicita karcinomu ovaria, na druhé straně také design studií, kdy se jedná o vysoce předléčené pacientky s pokročilým onemocněním). Naopak výrazných úspěchů bylo dosaženo v léčbě karcinomu ledviny, maligního melanomu a nemalobuněčného karcinomu plic.
Závěr
Terapeutika ze skupiny cílených léčiv vstupují do léčebných protokolů karcinomu ovaria a svým farmakologickým profilem splňují představu individualizované – na míru šité – léčby, kdy správný lék je podaný správné pacientce ve správný čas. Právě vzhledem k individualizaci terapeutického protokolu nutně o postupech rozhoduje multioborový kvalifikovaný tým v komplexním onkologickém centru se zkušenostmi se všemi modalitami onkologické terapie.
Obecně platným faktem zůstává, že prognosticky nejvýznamnějšími počiny v léčbě pokročilého karcinomu ovaria jsou radikální operační výkon s cílem dosáhnout makroskopického nulového rezidua nádoru, zajištění genetického testování pacientky a molekulárního prediktivního vyšetření vlastního nádoru a zavedení maintenance terapie PARPi do první linie s cílem dosažení trvalé remise. S uvedenými fakty o novodobé léčbě chováme naději, že na základě dalších úspěchů ze skupiny cílených terapeutik dojde k transformaci inkurabilního onemocnění, jakým recidivující karcinom vaječníku bezesporu je, v onemocnění chronické, ale léčitelné.
MUDr. Monika Náležinská
Klinika operační onkologie, oddělení gynekologické onkologie MOU, Brno
