U pacientů s pokročilým nemalobuněčným karcinomem plic (NSCLC) došlo během posledního desetiletí k rozhodujícímu pokroku v léčbě. Přibývá možností léčby při prokázaných genetických aberacích, které nám predikují účinnost cílené léčby. Ta u řady pacientů často vede k výraznému prodloužení přežití, i když po určité době musíme počítat se vznikem rezistence.
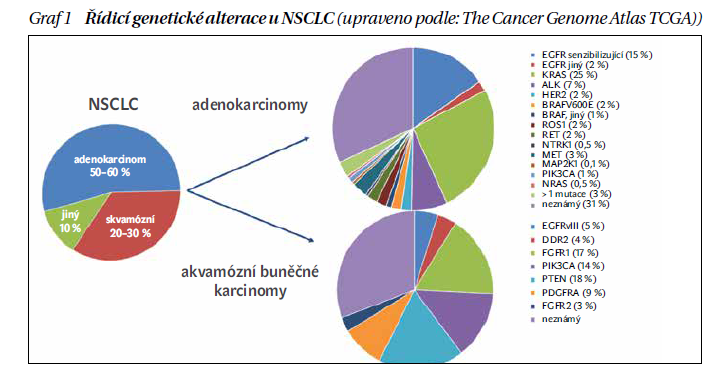
Pokročilý nemalobuněčný karcinom plic (NSCLC) je geneticky velmi nehomogenní skupinou nádorů (graf 1) a pacienti se stejným morfologickým typem nádoru mohou mít různé odpovědi na stejný protinádorový lék. S neustálým pokrokem v technologii biologické detekce se rozšiřují možnosti molekulární typizace lidského genomu, což umožňuje precizní a personalizovanou léčbu především neskvamózního NSCLC na základě zjištěných genetických změn. Tyto změny jsou prediktory účinnosti cílené léčby, kterápůsobí na nádorovou buňku na subcelulární úrovni s cílem ovlivnit signální dráhy u nádorů s těmito genetickými změnami. Ovlivněny jsou tak základní regulační funkce buněk, jako jsou proliferace, diferenciace, migrace, angiogeneze, apoptóza.
Zásadní je genetické testování nádorů
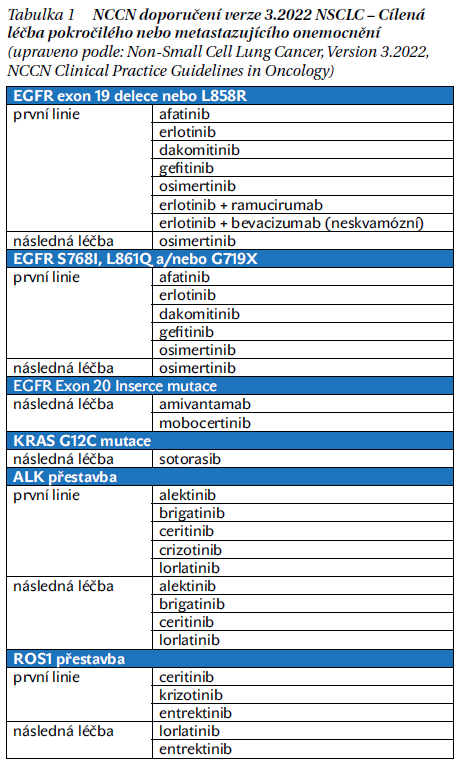
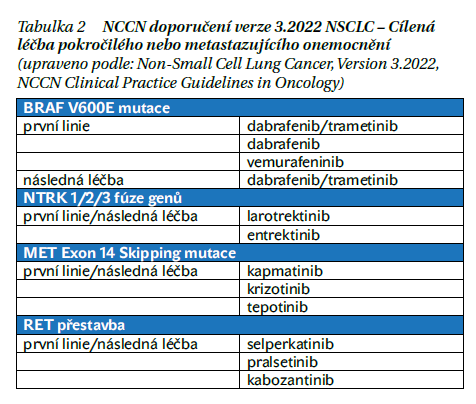
Rozšiřující se možnosti cílené léčby NSCLC dokládají například doporučení americké společnosti NCCN (National Comprehensive Cancer Network) (tabulka 1 a 2). Ne všechny tyto přípravky jsou ale v současné době schváleny Evropskou lékovou agenturou (European Medicines Agency – EMA). Je nezbytné klást důraz na genetické testování nádorů, kdy především sekvenování nové generace (next generation sequencing – NGS) nám umožňuje identifikovat celou řadu genetických změn. V případě, že nemáme k dispozici dostatek nádorové tkáně, můžeme využít i tzv. tekuté biopsie k vyšetření cirkulující nádorové DNA (ctDNA).
Při léčbě inhibitory tyrozinkináz (TKI), které se při této léčbě používají, vidíme obvykle rychlou a dlouhodobou léčebnou odpověď, musíme však počítat se vznikem rezistence a se selháním léčby. K jejímu objasnění je vhodná rebiopsie a molekulární reanalýza, která v určitých případech umožní nasazení další cílené léčby.
Osimertinib
Příkladem jednoho z léčebných přípravků cílené léčby je osimertinib (Tagrisso), selektivní ireverzibilní inhibitor tyrozinkinázy EGFR 3. generace, který prokázal účinnost u NSCLC s aktivačními mutacemi a mutací T790M rezistentní k TKI 1. a 2. generace. Nejprve byl schválen Food and Drug Administration (FDA) a EMA na základě výsledků studie fáze III AURA3, která srovnávala osimertinib s chemoterapií platinovým dubletem u pacientů s EGFR T790M pozitivním NSCLC. Medián doby bez progrese (PFS) byl signifikantně delší v rameni s osimertinibem (10,1 vs. 4,4 měsíce; HR 0,30; 95% CI 0,23–0,41; p < 0,001). Celková odpověď (ORR) byla rovněž signifikantně vyšší při léčbě osimertinibem (71 %; 95% CI 65–76) než při léčbě platinovým dubletem s pemetrexedem (31 %; 95% CI 24–40). Zlepšení PFS ve studii AURA3 bylo dosaženo také u pacientů s CNS metastázami při vstupu do studie.U 144 pacientů s mozkovými metastázami byl medián PFS delší při léčbě osimertinibem (8,5 vs. 4,2 měsíce; HR 0,32; 95% CI 0,21–0,49; p < 0,001).
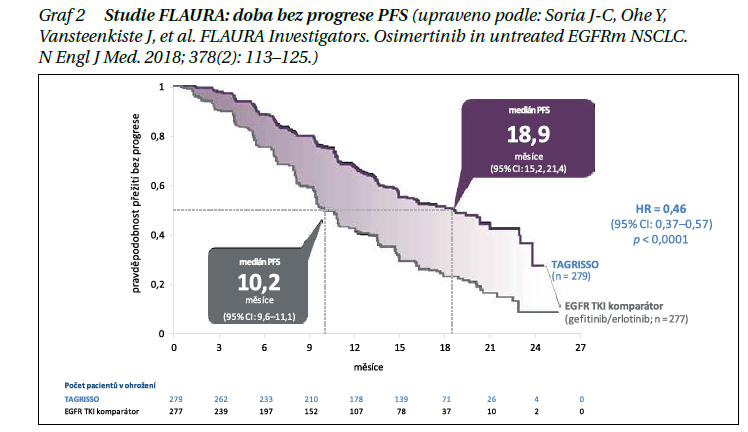
Do l. linie léčby byl osimertinib schválen EMA již v 6/2018 na základě studie fáze III FLAURA, ve které byl porovnáván s EGFR TKI 1. generace gefitinibem či erlotinibem v 1. linii léčby u pacientů s aktivační EGFR mutací v exonu 19 nebo 21.HodnotaPFS byla v rameni s osimertinibem 18,9 vs. 10,2 měsíce (HR 0,46; 95% CI 0,37–0,57; p < 0,001) (graf 2).
Do studie mohli být zařazeni i pacienti se stabilizovanými CNS metastázami. Také u této podskupiny pacientů vykázal osimertinib přínos z hlediska doby bez progrese, PFS 15,2 vs. 9,6 měsíce (HR 0,47; 95% CI 0,30–0,74; p < 0,001). Při léčbě osimertinibem bylo jak méně progresí v CNS, osimertinib v léčbě 1. linie snížil riziko progrese do CNS o 52 % (HR 0,48; 95% CI 0,26–0,86; p = 0,014), tak i méně nově se objevujících CNS lézí, odpovědi v CNS byly setrvalé ve srovnání s pacienty ze skupiny EGFR TKI komparátoru.
Při progresi onemocnění a prokázané mutaci T790M mohli pacienti ze skupiny EGFR TKI komparátoru přejít na léčbu osimertinibem. Medián celkového přežití (OS), publikovaný na konferenci ESMO 2019, byl 38,6 měsíce (95% CI 34,5–41,8) v rameni s osimertinibem a 31,8 měsíce (95% CI 26,6–36,0) ve srovnávacím rameni, HR 0,799 (95% CI 0,641–0,997; p = 0,0462) (graf 3).
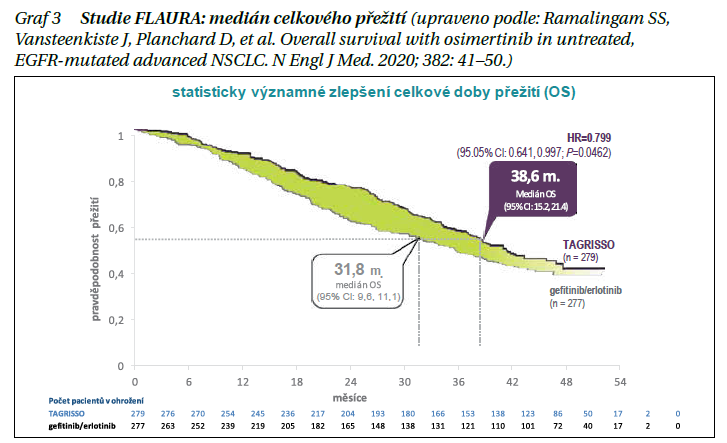
Jedná se tak o jedinou léčbu EGFR TKI v 1. linii léčby NSCLC, kdy medián celkového přežití přesahuje 3 roky terapie. Od 5/2021 je v této indikaci i v České republice schválena úhrada z veřejného zdravotního pojištění.
V aktualizovaných doporučených postupech ESMO z 9/2021 je také u kompletně resekovaného NSCLC st. IB–IIIA (AJCC verze 7) kromě adjuvantní chemoterapie při prokázané EGFR mutaci (delece exonu 19 a mutace exonu 21 L858R) doporučena adjuvantní cílená léčba osimertinibem na základě výsledků studie ADAURA.
Do této dvojitě zaslepené studie fáze III byli zařazeni pacienti s kompletně resekovaným NSCLC stadia IB–IIIA s prokázanou EGFR mutací, kteří dostávali buď osimertinib (80 mg 1× denně), nebo placebo po dobu 3 let (v poměru 1 : 1). Primárním cílovým parametrem bylo přežití bez onemocnění (DFS). Sekundární cílové parametry zahrnovaly DFS v celkové populaci pacientů s onemocněním stadia IB–IIIA, OS a bezpečnost. Randomizováno bylo 682 pacientů (339 ve skupině léčené osimertinibem a 343 ve skupině s placebem). Ve 24. měsíci 90 % pacientů s onemocněním stadia II–IIIA ve skupině s osimertinibem (95% CI 84–93) a 44 % pacientů ve skupině placeba (95% CI 37–51) žilo bez onemocnění (HR 0,17; 99,06% CI 0,11–0,26; p < 0,001). V celkové populaci 89 % pacientů ve skupině s osimertinibem (95% CI 85–92) a 52 % pacientů ve skupině placeba (95% CI 46–58) po 24 měsících žilo bez onemocnění (HR 0,20; 99,12% CI 0,14–0,30; p < 0,001) (graf 4).
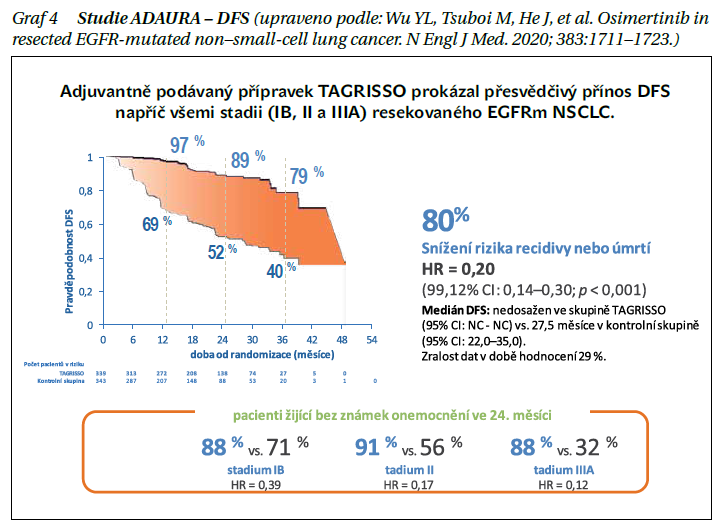
Adjuvantně podávaný osimertinib rovněž dosáhl 82% snížení rizika recidivy v CNS (HR 0,18, 95% CI 0,10–0,33). Údaje o celkovém přežití jsou nezralé. Zemřelo 29 pacientů (9 ve skupině osimertinibu a 20 ve skupině placeba). Nebyla zaznamenána žádná nová bezpečnostní rizika.
Lorlatinib
Dalším z těchto léčebných přípravků je lorlatinib (Lorviqua), vysoce účinný ALK (anaplastická lymfomová kináza) TKI 3. generace, který proniká do mozku, s celkovou a intrakraniální aktivitou u pokročilého ALK+ NSCLC. V preklinických studiích lorlatinib vykazoval značnou protinádorovou aktivitu u myší s nádorovými xenografty exprimujícími protein EML4 fúzovaný s ALK variantou 1, včetně ALK mutací L1196M, G1269A, G1202R a I1171T. Dvě z těchto ALK mutací, G1202R a I1171T, prokazatelně vedou k rezistenci nádoru na krizotinib, alektinib, brigatinib, ceritinib (ALK TKI 1. a 2. generace). Na základě výsledků registrační studie B7461001 fáze 1/2 byl lorlatinib nejdříve schválen k léčbě ALK+ NSCLC, u nichž došlo k progresi onemocnění po léčbě alektinibem nebo ceritinibem jako první léčbě ALK TKI, nebo léčbě krizotinibem a nejméně jedním dalším ALK TKI.
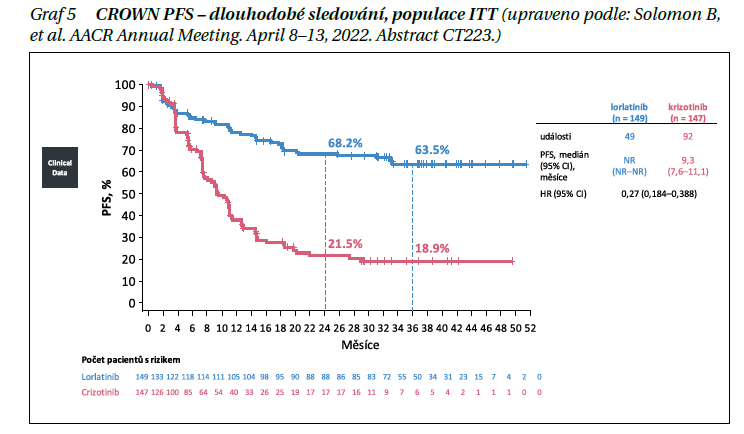
Od 1. 4. 2022 je v této indikaci schválena úhrada lorlatinibu z veřejného zdravotního pojištění i v České republice. Následně byl Úřadem pro kontrolu potravin a léčiv (FDA) a EMA schválen do 1. linie léčby ALK+ NSCLC na základěvýsledků studie fáze III CROWN. Na letošním AACR (American Association for Cancer Research) Annual Meeting v dubnu byla publikována aktualizovaná data této studie, která porovnávala lorlatinib vs. krizotinib v 1. linii léčby ALK+ NSCLC. Celkem 296 pacientů (104 studijních míst; 23 zemí) bylo randomizováno od května 2017 do února 2019. Primární cílový ukazatel PFS byl splněn v první interim analýze studie (medián sledování pro PFS byl 18,3 měsíce u pacientů užívajících lorlatinib a 14,8 měsíce u pacientů užívajících krizotinib); medián PFS nebyl dosažen pro rameno s lorlatinibem a byl 9,3 měsíce (95% CI 7,6–11,1 měsíce) pro rameno s krizotinibem (poměr rizika [HR], 0,28; 95% CI 0,19–0,41; p < 0,001).
Potvrzená objektivní odpověď byla vyšší u lorlatinibu (76 %) než u krizotinibu (58 %). U pacientů s měřitelnými výchozími mozkovými metastázami byla frekvence potvrzené intrakraniální odpovědi (IC) vyšší u lorlatinibu (82 %) než u krizotinibu (23 %).Neplánovaná analýza byla provedena při střední době sledování 36,7 měsíce u pacientů užívajících lorlatinib a 29,3 měsíce u pacientů užívajících krizotinib. Medián PFS hodnocený nezávislou komisí nebyl dosažen (95% CI NR-NR) pro rameno s lorlatrinibem a byl 9,3 měsíce (95% CI 7,6–11,1) pro rameno s krizotinibem (HR 0,27; 95% CI 0,184–0,388) (graf 5).
Entrektinib
U pacientů s prokázanou fúzí genu ROS1 je účinná léčba entrektinibem (Rozlytrek), selektivním inhibitoremNTRK/ROS1/ALK s prokazatelnou aktivitou v CNS, který byl cíleně vyvinut tak, aby překonával hematoencefalickou bariéru. Jeho účinnost byla hodnocena ve společné podskupině pacientů s ROS1 pozitivním metastazujícím NSCLC zařazených do jedné ze tří multicentrických, jednoramenných, otevřených klinických studií (ALKA, STARTRK-1 a STARTRK-2). Pacienti s ROS1 pozitivním NSCLC s hodnotitelnou účinností s ≥ 12měsíčním sledováním (n = 94) měli ORR 73,4 % (95% CI 63,3–82), medián doby trvání odpovědi (DOR) 16,5 měsíce (95% CI 14,6–28,6) a medián PFS 16,8 měsíce (95% CI (12–21,4).
Entrektinib vedl k výrazným a trvalým odpovědím u pacientů s výchozími metastázami do CNS i bez nich. Intrakraniální odpověď měla podskupina 46 pacientů s výchozími metastázami v CNS, a to včetně 24 pacientů s měřitelnými metastázami v CNS. U 19 z těchto 24 pacientů byla hodnota ORR 79,2 % (95% CI 57,8–92,9) (3× CR a 16× PR). Devět z těchto 24 pacientů absolvovalo intrakraniální radioterapii mozku během 2 měsíců před zahájením léčby entrektinibem.
Od 1. 9. 2021 je i v České republice léčba entrektinibem u pacientů s NSCLC s prokázanou přestavbou genu ROS1 hrazena z veřejného zdravotního pojištění.
Závěr
Léčba pokročilého NSCLC zaznamenala v posledních letech výrazný pokrok. Je důležité stále klást důraz na genetické testování nádorů, kdy především NGS nám umožňuje identifikovat řadu genetických změn a vybrat pro naše pacienty nejúčinnější léčbu. Nejdéle máme k dispozici léčebné přípravky při prokázané aktivační EGFR mutaci, přestavbě genu ALK a ROS1, postupně přibývají další. Ani touto léčbou však naše pacienty vzhledem k získané rezistenci na cílenou terapii vyléčit neumíme, často je ale dosahováno léčebných odpovědí, které mohou trvat řadu měsíců či let, a můžeme tak mluvit o chronickém průběhu onemocnění.
MUDr. Leona Koubková
Pneumologická klinika 2. LF UK a FN Motol, Praha
