Je nesporné, že se léčba astmatu v posledních letech dále zlepšila. Změnil se přístup k léčbě astmatu jako takového a současně máme řadu nových účinných biologických léčiv pro těžké astma, která přesně cílí na určený fenotyp. V článku se budeme zabývat přehledem současných biologických léčiv astmatu, včetně kazuistiky, která dokladuje, že lze v průběhu léčby těžkého astmatu biologická léčiva měnit podle klinické odpovědi.
Asthma bronchiale je heterogenní onemocnění obvykle charakterizované chronickým zánětem (nejčastěji eozinofilním) a remodelací dýchacích cest spolu s anamnézou respiračních příznaků, jakými jsou pískoty, dušnost, tíha na hrudi nebo kašel. Příznaky jsou v čase a intenzitě měnlivé, spolu s variabilní exspirační obstrukcí dýchacích cest, která se může po určitém čase stát trvalou. Astma je stále nemoc, kterou nelze vyléčit, ale je možné ji dostat pod kontrolu. Většina astmatiků je u nás léčena ambulantně, hlavně pneumology a alergology, pouze menší část lehkých forem je v péči praktických lékařů. Těžké astma by mělo být léčeno ve specializovaných centrech pro těžké astma.
Léčba astmatu komplexně
Hlavním cílem léčby je dosáhnout a udržet kontrolu nad astmatem. Kontrola astmatu je hodnocena ve dvou oblastech. První z nich je kontrola příznaků, druhou pak budoucí rizika nemoci (exacerbace, pokles plicních funkcí nebo rizika z nežádoucích účinků terapie). Špatná kontrola příznaků zvyšuje exacerbace, dokonce i pacienti s lehkým astmatem s minimem příznaků mohou mít těžké exacerbace nebo na astma umřít. Riziky pro exacerbace jsou vysoké dávky inhalačních β2-agonistů s krátkodobým působením (SABA), kdy se při jejich nadužívání (spotřeba více jak 1 balení po 200 dávkách/měsíc, např. 1 balení salbutamolu) zvyšuje mortalita na astma, terapie s vynecháním IKS (inhalační kortikosteroidy) nebo špatná inhalační technika, komorbidity, např. obezita, chronická rinosinusitida, refluxní nemoc jícnu, prokázaná potravinová alergie, expozice cigaretovému kouři, expozice alergenům a znečištěné ovzduší. Roli hrají i psychologické a socioekonomické faktory.
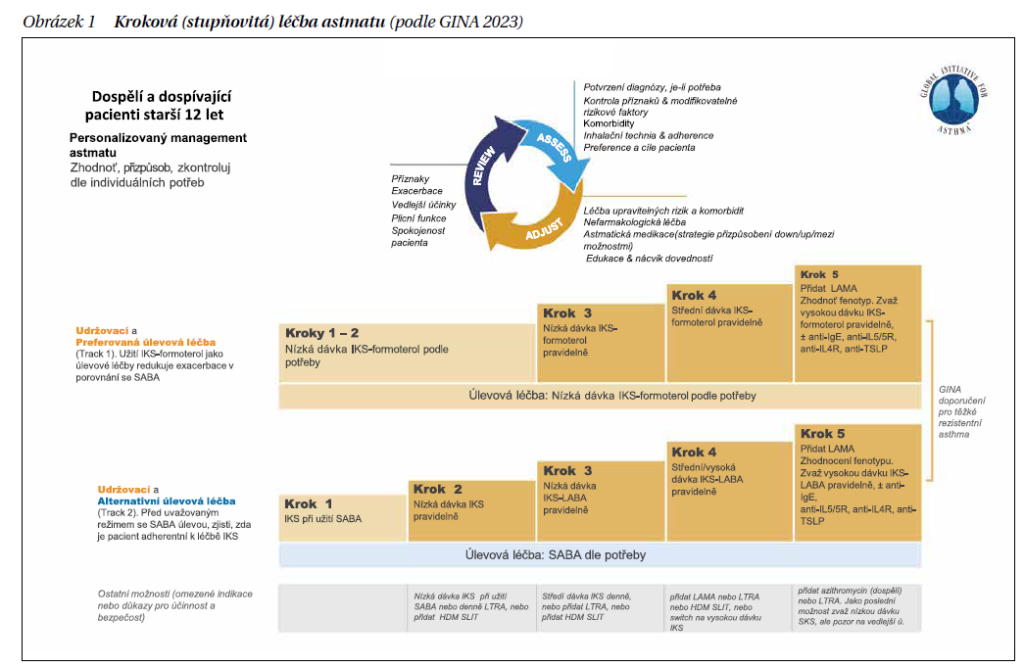
Předpokladem úspěchu léčby je nutné vytvořit partnerský vztah mezi pacientem a jeho ošetřujícím lékařem. Vlastní farmakoterapie je protizánětlivá a je určena ve stupních podle GINA (Globální inciativa pro astma) až po maximální standardní léčbu (obrázek 1). Maximální standardní léčba je definovaná podáváním středně vysokých (ev. až vysokých) dávek inhalačních kortikosteroidů a přídatné kortikoid šetřící léčby (LABA – inhalační β2-agonisté s dlouhodobým účinkem, LAMA – inhalační anticholinergika s dlouhodobým účinkem, antileukotrieny, teofyliny). Pokud i tak není astma pod kontrolu maximální standardní léčbou, je nutné pacienta odeslat k dalšímu vyšetření a léčbě do centra pro těžké astma, kde se po důkladné diagnostice zvažuje podání biologické léčby.
Biologická léčba těžkého astmatu
Biologická léčba je jednoznačně další převratnou léčbou u těžkého astmatu. Nyní máme k dispozici řadu léčiv, se kterými máme už konkrétní pozitivní zkušenosti. Léčiva fungují téměř vždy, pokud jsou správně indikována a zacílena.
Přínosy biologické léčby průduškového astmatu:
- zlepšení symptomů a kvality života;
- snížení exacerbací astmatu;
- prevence nasazení nebo redukce a případně vysazení dlouhodobé léčby celkovými kortikosteroidy;
- ovlivnění komorbidit astmatu (nosní polypy, hypereozinofilní syndromy, EGPA – eozinofilní granulomatóza s polyangiitidou).
Současné možnosti biologické léčby astmatu v praxi
Anti-IgE protilátka
Léčba monoklonální anti-IgE protilátkou omalizumab je indikována pro pacienty s těžkým alergickým astmatem. Určena je nejenom pro dospělé a mladistvé, ale i pro děti ve věku od 6 let. Je vhodné uvést, že k léčbě mohou být vhodní i astmatici, u kterých hladina celkového IgE není zvýšena – řada pacientů s těžkým alergickým astmatem, zvláště ti s užším spektrem alergenů, mívají hodnoty celkového IgE v normálním rozmezí. U dobře vybraných pacientů se dosahuje významné redukce exacerbací, často i snížení až vysazení systémové kortikoterapie, u některých těžkých astmatiků se zcela zásadně mění do té doby nepříznivý obraz nemoci. Lék je podáván 1–2× měsíčně v s. c. injekcích. Je k dispozici pod názvem Xolair.
Anti-IL-5
Dalším důležitým mediátorem eozinofilního astmatu je interleukin 5 (IL‑5). Anti-IL-5 monoklonální protilátky, které se na IL-5 vážou, znemožňují jeho vazbu na receptory. Tím neutralizují jeho účinky, a jsou proto označovány jako anti-IL-5 neutralizační protilátky. Pro léčbu eozinofilního zánětu u těžkého astmatu podáváme dva léky s anti-IL-5 působením. Jsou jimi mepolizumab (Nucala), humanizovaná monoklonální protilátka s vysokou afinitou vůči IL‑5, a druhý reslizumab (Cinqaero) s podobným mechanizmem účinku.
Oba léky jsou podávány v intervalu 1 měsíce, první z nich je podáván subkutánně, druhý v intravenózní infuzi. Léčba je určena pro pacienty s těžkým eozinofilním astmatem alergického i nealergického typu.
Další podobnou možností je blokáda receptoru IL-5. K dispozici máme benralizumab (Fasenra). Benralizumab vede k téměř úplné depleci eozinofilů v krvi během 24 hodin po první dávce. Při terapii dochází i k výraznému poklesu eozinofilů v dýchacích cestách.
Léky ovlivňující působení IL-4 a IL-13
Interleukiny 4 a 13 jsou strukturálně i funkčně podobné cytokiny, produkované podobně jako IL-5 především lymfocyty. Na rozdíl od IL-5 jsou však zapojené při vzniku eozinofilního zánětu především alergickými mechanizmy. Od roku 2019 je registrován v EU v indikaci těžké astma se zánětem typu 2 charakterizovaným zvýšeným počtem eozinofilů v krvi a/nebo zvýšením množství exhalovaného oxidu dusnatého (FENO). K dispozici je dupilumab (Dupixent), což je plně humánní monoklonální protilátka proti alfa podjednotce receptoru pro interleukin 4 (IL-4), která inhibuje signální dráhu IL-4/IL-13.
Anti-TSLP
Jde o nové biologikum tezepelumab, humanizovanou monoklonální protilátku, která se váže na TSLP (thymický stromální lymfopoetin) a blokuje interakci s receptorem pro TSLP.
Vzhledem ke komplexnímu působení tezepelumabu se zdá, že jeho indikace bude širší než jenom u T2 typu astmatického zánětu. Tezepelumab v klinických studií prokázal významnou účinnost ve smyslu snížení exacerbací nezávisle na počtu eozinofilů, zlepšení plicních funkcí, kvality života a má výbornou snášenlivost a bezpečnost. V červnu 2022 byl tezepelumab schválen FDA pro použití v USA napříč fenotypy astmatu. V ČR je k dispozici od roku března 2023 pod názvem Tezspire.
Závěr
Základem úspěšné terapie astmatu je především správná diagnóza na začátku a určení fenotypu. Astmatik má být adekvátně a srozumitelně poučen o své nemoci s důrazem, že jde o nemoc celoživotní. Následně je podávána protizánětlivá léčba, kde dominují IKS. Dávky IKS a indikace další přídatné léčby určují daný stupeň tíže astmatu (5 stupňů podle GINA). Dnes by neměl být astmatik léčen pouze úlevovou léčbou samotnými SABA. U astmatiků preferujeme vždy léčbu inhalační a jednoduchou a dbáme na správnost inhalační techniky (www.mujinhalator.cz). Inhalační techniku při návštěvách lékaře opakovaně kontrolujeme. Důsledně zjišťujeme všechny komorbidity a expozice a pokud možno je zaléčíme a odstraníme. V případě rezistentního těžkého astmatu na úrovni stupně 5 podle GINA, určujeme fenotyp a léčíme cíleně. Novou biologickou terapii dnes nasazujeme již před uvažovaným dlouhodobým podáváním celkových kortikosteroidů nebo v případech, kdy je chceme redukovat či postupně úplně vysadit. Pacienty s těžkým astmatem (GINA stupeň 4–5) je nutné odesílat včas na pracoviště sítě národních center pro těžké astma (NTCA, www.tezke-astma.cz). Současná léčba astmatu vyžaduje jednoznačně multidisciplinární přístup. V současnosti je možné biologickou léčbu v čase měnit podle klinického efektu (provádíme tzv. switch), což dokladuje i následná kazuistika.
Kazuistika
Pacientka je léčena pro asthma bronchiale již od dětství. Na kliniku se poprvé dostává až ve svých 30 letech. V červenci 2020 je praktickým lékařem odeslána k pneumologovi pro exacerbaci asthma bronchiale při virovém infektu. V chronické medikaci již má vysoké denní dávky inhalačních kortikosteroidů s dlouhodobě působícím β2-agonistou, antihistaminikum a úlevovou kombinaci bronchodilatancií s pravidelným užíváním. Navíc užívá perorální kortikosteroid 1× týdně.
Příznaky, anamnéza
Pacientka udává, že zhoršení dechu trvá ve skutečnosti asi 3 měsíce, kdy má trvale pocit, že je „na prahu záchvatu“, příznaky se zhoršují hlavně v noci. V objektivním vyšetření dominuje kromě poslechového nálezu obezita (váha 125 kg při výšce 161 cm).
Kromě astmatu má pacientka od dětství v anamnéze i atopický ekzém a polyvalentní alergii. Je alergická na vlašské ořechy, mezokain, lidokain, srst, některé plísně a pyly. Pracuje jako IT specialistka, nekouří.
Průběh vyšetření, nastavení medikace
Na skiagramu hrudníku je přiměřený nález, spirometrií zjišťujeme středně těžkou obstrukční ventilační poruchu. Bronchodilatační test je vstupně hraniční, s hodnotami post bronchodilatačního FEV1 +150 ml, +8,7 %, což signalizuje chronicitu astmatu. Hodnota oxidu dusnatého ve vydechovaném vzduchu (FeNO) je 24 ppb.
Doplňujeme základní odběry (krevní obraz s diferenciálem, biochemie) a další odběry (sérologie Aspergillus sp., imunologické a alergologické vyšetření) a též sputum na mikrobiologické vyšetření. Pacientce léčíme akutní exacerbaci a současně jí upravujeme chronickou medikaci. Do medikace přidáváme inhalační dlouhodobě působící anticholinergikum a antileukotrien.
Po týdnu přichází opět pro akutní exacerbaci a přibližně po měsíci poté na pravidelnou kontrolu, kde hodnotíme výsledky vyšetření z první návštěvy a efekt upravené terapie. Zjišťujeme vysokou periferní eozinofilii 1 000 buněk/μl, výrazně zvýšené celkové IgE 4 630, zvýšení specifických IgE proti pylům, plísním a také celoročním alergenům (srst kočky, psa). Autoprotilátky bez patologie, sputum s kultivačním nálezem normální flóry, sérologie byla negativní.
Subjektivně pacientka udává zhoršení dechu s nutností užívat systémový kortikosteroid v posledních 14 dnech. Změna medikace nijak zásadně nepomohla, zlepšení nepozoruje. V dotazníku test kontroly astmatu vychází (TKA) v součtu 9 bodů, svědčících pro velmi malou kontrolu nemoci. Objektivně je nemocná bez klinických známek akutní exacerbace. Navyšujeme denní dávku inhalačních kortikosteroidů a plánujeme kontrolu s odstupem.
V mezidobí pacientka opakovaně přichází pro akutní exacerbace, obtíže jsou spouštěny buď nachlazením, nebo alergií. Kontrolní bronchodilatační test je opět hraničně pozitivní s hodnotami +260 ml, +11,3 %, nicméně proti vstupnímu vyšetření absolutní hodnoty FEV1 vykazují výrazné zlepšení, nález tedy hodnotíme jako prokázanou variabilitu obstrukce.
Doplňují vyšetření
Doplňujeme ještě HRCT hrudníku, vyšetření plicní difuze a odběr krve k vyšetření hladiny alfa-1 antitrypsinu. Výsledky těchto vyšetření jsou v normě. Test kontroly astmatu je nadále s tristním výsledkem 6–8 bodů. Navíc zpočátku zjišťujeme, že pacientka přes edukaci nezřídka užívá perorální kortikosteroid bez toho, že by o akutním zhoršení informovala lékaře, čímž nedochází k zaznamenání těžké exacerbace do zdravotnické dokumentace a značně se komplikuje další postup.
Klinicky vylučujeme gastroezofageální reflux, doporučujeme redukci tělesné hmotnosti (obezita je známá komorbidita) a omezení expozice alergenům. Nadále zjišťujeme eozinofilii v periferní krvi v hodnotách 500 buněk/μl a opakovaně dochází k těžkým akutním exacerbacím astmatu s nutností podávat systémovou kortikoterapii 3 a více dnů, což už se nám daří zdokumentovat.
Nasazení biologické léčby
V květnu 2021 je případ pacientky probírán na indikačním setkání našeho týmu pro těžké astma. Pacientka splňuje indikační kritéria k nasazení antieozinofilní biologické léčby podle doporučení GINA a splňuje i kritéria pro úhradu zdravotní pojišťovnou v České republice. Tato kritéria jsou: dodržování zákazu kouření, eozinofilie minimálně 300 buněk v mikrolitru periferní krve, čtyři dokumentované těžké exacerbace s nutností systémové kortikoterapie během posledních 12 měsíců navzdory léčbě vysokými dávkami inhalačních kortikosteroidů a přídatné léčby nebo dlouhodobé užívání perorální kortikoterapie (alespoň 6 měsíců v dávce ekvivalentní nejméně 5 mg prednisonu denně).
Indikujeme podávání benralizumabu. Podává se subkutánní injekcí nejprve každé čtyři týdny, po třech dávkách se přechází na velmi komfortní interval 8 týdnů.
Po první aplikaci dochází u naší pacientky k polékové reakci, která se projevuje zimnicí, třesavkou, zvýšenou teplotou, bolestmi kloubů a pocitem tlaku na plicích. Pacientka nám však tuto událost zmiňuje až po 4 týdnech od aplikace, při plánované kontrole před druhou aplikací, s odůvodněním, že potíže ustaly po několika hodinách samovolně a ona by raději snášela nežádoucí účinky nové léčby než další zhoršování astmatu. V této době je již u nemocné patrný cushingoidní habitus, pomalu přibírá na váze a v medikaci se objevuje antidepresivum.
Léčbu benralizumabem vzhledem k nežádoucí reakci po první dávce ukončujeme, událost hlásíme Státnímu ústavu pro kontrolu léčiv jako nežádoucí účinek léčby.
Při dalším indikačním setkání týmu se rozhodujeme pro jiný přípravek s antieozinofilním účinkem a pacientce nasazujeme mepolizumab. Podává se opět subkutánně, jednou za 4 týdny. Tento přípravek již pacientka snáší bez problémů. Co se týče účinnosti, po prvních 2 aplikacích subjektivně k výraznému zlepšení nedochází, lze připustit snížení frekvence příležitostného jednorázového užití celkových kortikoidů, objektivně nedochází k těžkým akutním exacerbacím. Trvá ale potřeba užívání úlevové medikace přibližně každé 4 hodiny, noční příznaky se objevují asi 3× týdně a součet v dotazníku Test kontroly astmatu je nyní kolem 12 bodů, tedy stále v pásmu nedostatečné kontroly.
Začínáme uvažovat o mezioborové spolupráci s dermatology, jelikož se po citelném omezení systémového kortikoidu horší projevy alergie a atopického ekzému, který v tomto období již u pacientky trvale pokrývá obličej, krk a většinu trupu. V návrhu je nová indikace astmatu a atopické dermatitidy pro biologickou léčbu humánní monoklonální protilátkou inhibující signální dráhu IL-4 a IL-13 – dupilumabem. Po roce léčby mepolizumabem konstatujeme v září 2022 dysefekt této léčby a rozhodujeme se pro switch na dupilumab, v této době již hrazený i pro naše pneumologické pacienty.
Léčbu dupilumabem zahajujeme v říjnu 2022 v dávce 300 mg v subkutánní injekci každé 2 týdny. Po prvních aplikacích, které pacientka toleruje velmi dobře, přecházíme na pohodlnou domácí aplikaci. Po 2 měsících léčby je u pacientky patrné významné zlepšení atopické dermatitidy, ale také ústup dechových obtíží a mnohem nižší potřeba úlevové medikace, dokonce již převažují dny, kdy úlevovou medikaci nemusí použít vůbec. Vymizely noční příznaky a za posledních 6 měsíců nedošlo u nemocné ani k jedné akutní exacerbaci. Pacientka je dosud na této léčbě kompenzovaná a plně spokojená.
Literatura u autora.
Tato práce byla podpořena výzkumným programem Univerzity Karlovy, Cooperatio 34.
doc. MUDr. Norbert Pauk, Ph.D.
Klinika pneumologie 3. LF UK a FN Bulovka, Praha
