Atopická dermatitida je multifaktoriální onemocnění postihující typicky děti, dospívající, ale i dospělé pacienty. V klinickém obraze dominují erytematózní pruritické papuly, vezikuly, mokvající či suché a zhrubělé projevy splývající do ložisek až ploch. Typické postižení je v obličeji a flexorových partiích končetin. Vedle režimových opatření se v léčbě nejvíce uplatňují kortikoidní externa a fototerapie. U závažných forem je k dispozici celková léčba cyklosporinem, případně po jejím selhání i terapie biologická pomocí dupilumabu či JAK inhibitorů baricitinibem či abrocitinibem. Léčba tohoto onemocnění je komplexní, vyžadující úzkou spolupráci pacienta, rodiny a lékaře.
Atopická dermatitida (AD), synonymum eczema atopicum, je chronické, recidivující, zánětlivé onemocnění s komplexní multifaktoriální etiopatogenezí. Na vzniku onemocnění se podílí složitá interakce genetické predispozice (souhra působení řady různých genů, geneticky komplexní choroba), vlivů vnějšího prostředí, neuroimunologická nerovnováha a porušená epidermální bariéra včetně abnormalit kožního mikrobiomu. AD se stala celosvětovým zdravotním problémem, protože je spojena se značnou morbiditou a zhoršenou kvalitou života (QoL). AD se často rozvíjí v dětském věku a má široké spektrum příznaků, které přispívají k hlubokým funkčním poruchám, omezujícím schopnost vykonávat každodenní činnosti a způsobujím psychosociální stres a stigma.
Epidemiologie
Podle údajů WHO (Global Burden of Diseases) se odhaduje, že AD postihuje nejméně 230 milionů lidí na celém světě. AD je jednou z celosvětově nejčastějších chronických onemocnění a nejběžnějším zánětlivým kožním onemocněním ve vyspělém světě, postihujícím muže a ženy všech ras, děti i dospělé, často se vyskytujícím v rodinách s jinými atopickými onemocněními (bronchiální astma a/nebo alergická rýma). Původně byla AD považována za onemocnění raného dětství s odhadovanou prevalencí 15–25 % u dětí, nověji však víme, že AD je také velmi rozšířená u dospělých, s mírou prevalence od 1 do 10 %. V posledních letech dochází ve vyspělých zemích Evropy, USA, v Japonsku k výraznému nárůstu prevalence AD až na 30 %. Studie, které hodnotí tento nárůst, poukazují na četné genetické, sociální a/nebo environmentální faktory. Tyto studie ale dokládají hlavní nárůst prevalence AD v dětském věku. Přibližně 45 % všech případů AD začíná během prvních šesti měsíců života, celkově do 60 % během prvního roku a před pátým rokem života zastoupení roste až na 80–90 %. AD je často prvním krokem v rozvoji i dalších atopických onemocnění, jako jsou alergická rýma, astma a potravinové alergie, tzv. atopický pochod/atopic march, charakterizovaný typickým sledem atopických onemocnění předcházejících rozvoji dalších alergických onemocnění v pozdějším věku. Z těchto epidemiologických studií dále vyplývá, že až u 50 % pacientů, u kterých se vyvine AD před dosažením 2. roku života, se během následujících let vyvine bronchiální astma. Navíc u dětí s AD, u kterých se rozvine astma a alergická rinitida, je pravděpodobnější, že budou mít závažnější průběh onemocnění. Průběh AD může být kontinuální po mnoho let, ale může také vykazovat recidivující-remitující vzorec. Dřívější studie naznačovaly, že onemocnění vymizí u > 50 % postižených dětí v průběhu dospívání, přičemž jen závažnější případy přetrvávají do dospělosti. Soudobé studie dokládají, že podíl pacientů s perzistentním onemocněním nebo onemocněním začínajícím v dospělosti nebo s relapsy po dlouhých remitujících intervalech je mnohem vyšší, než se dříve předpokládalo. Podle těchto studí je prevalence v dospělé populaci ve vyspělých státech severní Ameriky a Evropy okolo 3,5–4,4 %.
Etiologie a patofyziologie
Celosvětově rostoucí prevalenci AD nelze připsat samostatně jen genetické predispozici. Etiologie je multifaktoriální, vedle genetické predispozice se jedná o vlivy zevního prostředí s patologickou imunologickou odpovědí a porušenou kožní bariérou. Nejsilnějším známým rizikovým faktorem AD je rodinná anamnéza atopických onemocnění, zejména AD. Přítomnost atopického onemocnění u jednoho z rodičů přispívá ke zvýšení rizika AD u dítěte až na 1,5násobek. Přítomnost přímo AD u jednoho nebo u obou rodičů zvyšuje riziko u dítěte dokonce až na 3–5násobek. Další rizikové faktory spojené se zvýšenou prevalencí AD zahrnuje život v městském prostředí a v oblastech s nízkou expozicí ultrafialovému záření nebo suchým klimatem, diety bohaté na cukry a nenasycené mastné kyseliny (typické pro západní země) nebo např. opakovaná expozice na antibiotika do pěti let věku. Účinky vystavení mateřskému a/nebo postnatálnímu stresu, konzumace tabáku, antibiotik nebo alkoholu, dlouhodobé výhradně jen kojení, rutinní dětské očkování, virové nebo bakteriální infekce, látky znečišťující ovzduší, prostředí s domácími zvířaty s chlupy patří mezi nekonzistentní rizikové faktory pro rozvoj AD.
Patogeneze AD je komplexní a vedle zmíněných vlivů kombinuje i kožní bariérovou dysfunkci, kožní a systémovou imunitní dysregulaci, dysbiózu kožního bakteriálního mikrobiomu a jak již bylo zmíněno genetické faktory. U pacientů s AD jsou prokázány abnormality kožní bariéry spojené s mutacemi nebo zhoršenou expresí filagrinového genu, který kóduje strukturální protein nezbytný pro tvorbu kožní bariéry. Navíc dysregulace metabolizmu lipidů se sníženou produkcí ceramidů jsou důležité faktory, které vedou k transepidermální ztrátě vody a zvýšenému pronikání dráždivých látek, alergenů a mikrobů do kůže. Narušení bariéry vede ke chronickému zánětu s epidermální hyperplazií a zánětlivým infiltrátem, včetně účasti dendritických buněk, eozinofilů a T lymfocytů.
AD je v současnosti považována za dvoufázové či kombinované onemocnění zprostředkované T lymfocyty. Signál pomocných T lymfocytů (Th2) bohatý na IL-4, IL-5, IL-13, IL-25 a IL-31 převládá v akutní fázi, zatímco v chronické fázi onemocnění převládá signalizace Th1. Vrozený imunitní systém poskytuje první linii obrany proti mikrobiálním patogenům. Poruchy vrozené imunitní reakce se snížením antimikrobiálních peptidů přispívají ke zvýšení počtu bakteriálních a virových infekcí. Tato souhra faktorů vede ke kožní imunitní reakci s následným uvolňováním chemokinů a prozánětlivých cytokinů (jmenovitě TSLP a IL-4), které podporují tvorbu imunoglobulinu E (IgE). Kožní a systémová zánětlivá reakce s vyšší hladinou IL-31 vedou následně k silnému až urputnému svědění. I když byla elevace IgE považována za charakteristický znak atopika, u AD se podílí na patogenitě onemocnění jen asi u 70–80 % pacientů. U ostatních pacientů je hladina IgE v normě, ale muže být přítomna eozinofilie. Zásadní je i snížená diverzita kožního mikrobiomu ve prospěch především Staphylococcus aureus, který je přítomný až u 90 % pacientů s AD. Tato kolonizace přispívá k dalším kožním infekcím a patogenitě AD působením na keratinocyty, které chemotakticky indukují zánětlivou reakci. Podstatnou roli mají i další organizmy, včetně kvasinek, například Malassezia spp., které mohou přímo stimulovat kožní zánětlivou reakci.
Klinický obraz
AD se vyskytuje ve třech rozdílných formách, které se liší lokalizací, obdobím vzniku, ale i samotnými kožními projevy. Jednotlivé formy mohou být samostatné v určitém věkovém období, nebo během stárnutí postiženého jedince na sebe plynule navazují. U každého postiženého jedince je však průběh onemocnění značně individuální a některé vývojové formy onemocnění mohou i chybět. AD se může objevit až v dospělosti, či dokonce ve starším věku.
Kojenecká forma. Nejčastější je kojenecká forma AD, začíná mezi 2. a 6. měsícem po narození, zpravidla na tvářích, čele a postupně může generalizovat na celou hlavu, tělo i končetiny. Kůže nejdříve zčervená, na povrchu se vysévají drobné papulky a vezikuly, dochází k mokvání a následné tvorbě krust a deskvamaci. Tento úvodní projev u kojenců se označuje jako crusta lactea (ouročky). V tomto období jsou nejčastější zhoršující a provokující faktory potravinové alergeny (kravské mléko, vejce, aromatické citrusové plody a následně i inhalační alergeny, jako je pyl, prach apod.). Tento typ AD se může během druhého roku života zhojit nebo přechází plynule v dětskou formu.
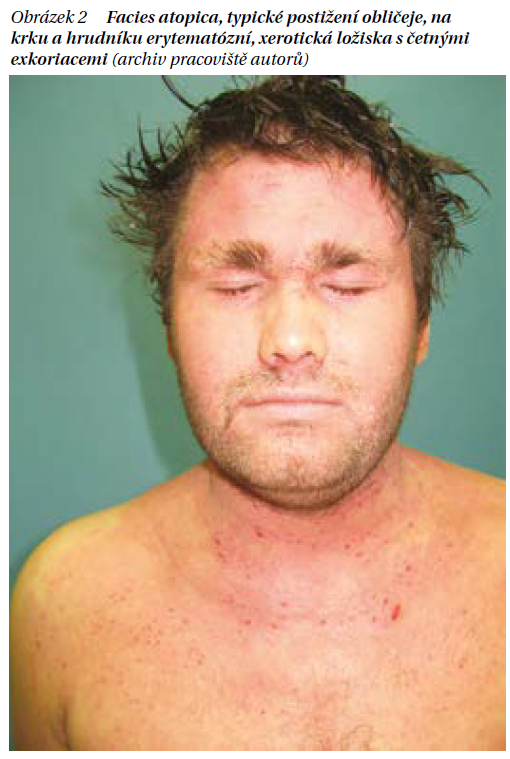
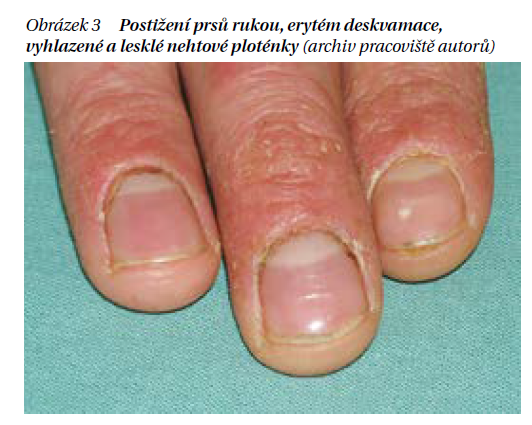
Dětská forma. Dětská forma AD má postižení v typických (pro ekzém) flexorových lokalizacích. Postihuje loketní a podkolení jamky, krk, zápěstí a hřbety rukou. Kůže již tolik nemokvá, naopak je suchá, drsná a hrubá – lichenifikovaná (obrázek 1). Při silném svědění jsou projevy často výrazně exkoriované, případně i sekundárně infikované s tvorbou žlutavých krust. Kůže obličeje bývá bledá, což spolu s tmavší a zhrubělou kůží očních víček a zdvojením záhybu pod očima (tzv. infraorbitální řasa) dává obličeji charakteristický vzhled tzv. facies atopica (obrázek 2). Nehty rukou jsou následkem škrábání vyhlazené a lesklé (obrázek 3).
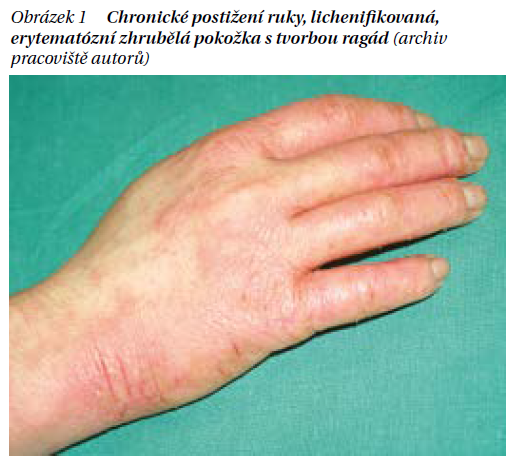
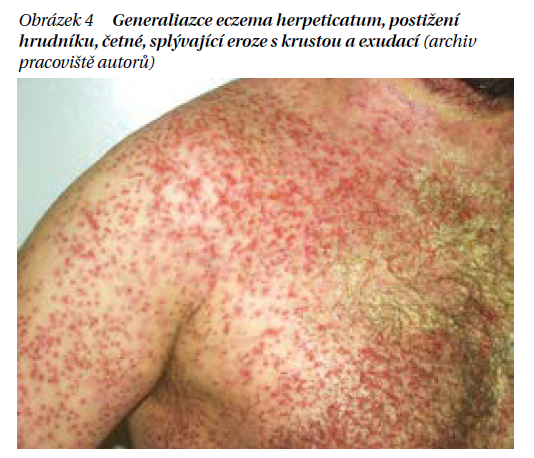
Dospělá forma. Dospělá formaAD se může vyskytnout jako první projev onemocnění i u pacientů, kteří dříve ekzém nikdy neměli. Zpravidla však předchází kojenecká či dětská forma AD nebo astma. V klinickém obraze dominuje postižení stejných lokalit jako ve formě dětské, může být ale i výraznější svědění a xeróza. Jako frustní formu AD označujeme postižení, které je lokalizované jen na některé okrsky těla s atypickým klinickým obrazem. Depigmentovaná, lichenifikovaná a deskvamující makulózní ložiska se označují jako pityriasis alba a postihují malé děti předškolního věku v obličeji, na trupu a končetinách. Deskvamující, erytematoskvamózní projevy bříšek prstů se označují jako pulpitis sicca, obdobné projevy postihující u dětí bříška prstů, a navíc i dlaně a plosky označujeme jako juvenilní plantární dermatózu. Výrazný pruritus a následné četné exkoriace projevů výrazně přispívají k poruše epidermální bariéry a vedou, zejména při akutní exacerbaci AD, k sekundární bakteriální infekci (Staphylococcus aureus, Streptococcus pyogenes), která se projevuje tvorbou četných žlutavých až medových krust s macerací. Závažná je i diseminace virové infekce, především jako primoinfekce (která se může i opakovat při recidivě labiálního oparu) herpes simplex v podobě eczema hepreticatum (obrázek 4). U těchto pacientů nejčastěji v obličeji dochází k rychlé diseminaci drobných vezikul, které během hodin praskají a jsou doprovázeny masivní exsudací. Při generalizaci této sekundární infekce se jedná o potencionálně život ohrožující stav.
Hodnocení postižení, stratifikace terapeutických modalit
Klinická měření jsou základem pro definování závažnosti AD a k posouzení výsledků terapie.
Nejčastěji používané skórovací systémy pro hodnocení závažnosti AD zahrnuje definice postižené oblasti a index závažnosti (EASI), skórovací systém atopické dermatitidy (SCORAD), atopický index závažnosti (ADSI) nebo dermatologický index kvality života (DLQI). SCORAD připisuje přibližně 60 % z celkového skóre intenzitě lézí a míře postižení, 20 % šíření projevů a 20 % pro subjektivní hodnocení obtíží pacientem. Výsledné hodnocení
SCORAD > 50 je považováno za závažné projevy AD, zatímco SCORAD skóre < 25 se považuje za postižení mírné. Dalším z rutinně používaných systémů u AD je DLQI a index kvality života kojenců (IDQOL), který umožňuje hodnotit subjektivní vjemy pacienta v návaznosti na kvalitě života, spánku a socioemocionální pohody. Tyto skórovací systémy pomáhají stratifikovat pacienty podle míry postižení, a navíc i podle subjektivních obtíží. Hodnocení je navíc zásadní pro jednotlivé terapeutické modality a hodnocení jejich efektu. Pro tyto účely se nejvíce využívá skórovací systém EASI, který určuje procentuální míru zhojení pacienta při terapii danou modalitou.
Léčebné přístupy
Terapie AD můžeme rozdělit na edukaci pacienta včetně režimových opatření, léčbu lokální a léčbu systémovou. Cílem léčby je snaha navodit stabilitu onemocnění a snížit možné riziko exacerbace.
Edukace pacienta. Edukace pacienta je důležitá k rozpoznání zásadních zhoršujících faktorů zevního prostředí a navození dostatečné spolupráce pacienta či rodiče k eliminaci zhoršujících faktorů a dodržování režimových opatření. Mezi základní režimová opatření patří zejména dodržování dietních opatření, dostatečné promazávání pokožky indiferentními mastmi, používání např. olejových základů do koupelí apod.
Lokální léčba. Zásadní je léčba lokální, vedle dostatečně hydratujících indiferentních extern lze využívat i lokální přípravky s obsahem urey, nízké (keratoplastické) koncentrace kyseliny salicylové či vitaminové masti. Cílem této formy léčby je obnova kožní bariéry a podpora přirozeného kožního mikrobiomu. U pacientů, kde je nedostačující tato léčba, jsou indikována kortikoidní externa. Při této zevní léčbě začínáme aplikovat kortikoidní externa nejprve II. třídy, při závažnějším postižení i III. třídy, tedy již silná kortikoidní externa. Léčba by měla být intermitentní, tj. vedoucí ke zlepšení, a poté postupně vysazována a nahrazena indiferentní udržovací lokální terapií. Alternativou k lokálním kortikoidům je terapie takrolimem a pimekrolimem, které patří do skupiny imunomodulačních léků. Tyto preparáty mají sice obdobný efekt jako lokální kortikoidy, ale nejsou zatíženy nežádoucími účinky typickými pro lokální kortikosteroidy (atrofie, tvorba strií, v obličeji periorální dermatitida). Jejich aplikace je výhodná pro udržení stability onemocnění a při postižení obličeje. U středně těžké AD je možné kombinovat lokální terapii s fototerapií. Dříve hojně používaná fototerapie pomocí spektra UVA je v současnosti podle doporučení nahrazena selektivním UVB zářením pouze o vlnové délce 311 nm. Jedná se o léčbu podpůrnou s prokázaným imunomodulačním, antipruriginózním a protizánětlivým efektem. Významná je i role psychosomatická.
Systémová léčba. U pacientů s těžkou formou AD je indikována celková léčba. V první řadě je možné využít celkové kortikoidy, ale pouze jako úlevovou terapii zastavující akutní exacerbaci onemocnění. Pro dlouhodobou terapii jsou nevhodné pro četné a závažné nežádoucí účinky, které z této dlouhodobé léčby plynou, navíc při jejich vysazení lez očekávat i tzv. rebound fenomén.
Z jiných imunosupresiv se nejvíce používá cyklosporin A. Léčba musí být přísně individuální, odpovídající variabilitě onemocnění. Doporučované denní dávky se pohybují v rozmezí 2,5–5,0 mg/kg/den a podávají se rozdělené do dvou dílčích dávek. Po dosažení odpovídajícího terapeutického účinku by měla být dávka postupně snižována, a pokud to stav onemocnění dovoluje, úplně vysazena. Léčba je obvykle po dobu 6–12 měsíců podle případného efektu.
Pokud není léčba dostatečně efektní nebo není tolerována, je v současné době indikována biologická léčba dupilumabem. Dupilumab byl prvním biologickým lékem schváleným pro léčbu atopické dermatitidy dospělých a dětí. Jeho cílené působení potlačuje zásadní Th2 signalizaci vazbou na IL-4Rα, která inhibuje produkci IL-4 a IL-13. V klinických studiích SOLO-1 a SOLO-2, srovnávajících efekt dupilumabu s placebem, dosáhlo zlepšení (EASI-75) 51 % a 44 % pacientů (dokonce 64 % při používání i lokálních kortikoidů) oproti 15 % a 12 % při užívání placeba (23 % při používání lokálních kortikoidů), navíc již po 16 týdnech terapie. Dupilumab se podává subkutánně u dospělých pacientů v úvodní dávce 400 mg v následovaný v dlouhodobé léčbě dávkou 200 mg. Provedené klinické studie a četná data z národních registrů dokládají bezpečnost této terapie a její efekt v dlouhodobém sledování. Nejčastější nežádoucí účinky jsou běžné infekce horních cest dýchacích a herpetické infekce a konjunktivitidy.
Dalšími léky jsou léčiva ze skupiny tzv. malých molekul JAK inhibitory. Prvním tímto lékem byl baricitinib, který v klinických studiích BRAZE-AD1, AD2 a AD7 v dávkování 2 a 4 mg oproti placebu prokázal významnou účinnost. Současně s možnou lokální léčbou kortikoidními externy bylo dosaženo EASI-75 u 48 % pacientů s dávkou 4 mg a 43 % s dávkou 2 mg oproti 23 % pacientů léčených placebem. Baricitinib má navíc jako i ostatní JAK inhibitory vynikající efekt na pruritus, který ustupuje, nebo dochází ke zlepšení již v prvních dnech terapie. Vedle běžných infekcí, obdobných jako u terapie dupilumabem, jsou vhodné pravidelné kontroly lipidů a kreatinkinázy, léčba je podle výsledků dostupných studií také bezpečná.
Další alternativou je abrocitinib, který je selektivním inhibitorem JAK1. Ve studii JADE MONO-1 a MONO-2 bylo dosaženo EASI-75 u 63 % pacientů na dávce 200 mg a u 44 % pacientů na dávce 100 mg. Ve srovnávací studii JADE COMPARE byl porovnán efekt abrocitinibu s dupilumabem a terapií placebem. Nejlepších výsledků bylo dosaženo při dávce 200 mg abrocitinibu, kdy po 12 týdnech terapie došlo ke zlepšení EASI-75 u 70,3 % pacientů ve srovnání s 58,1 % pacientů léčených dupilumabem a 27,1% pacientů na placebu. Výsledky jednotlivých studií dokládají bezpečností profil těchto léků a nesporný efekt při terapii AD.
Závěr
AD je nejčastějším zánětlivým neinfekčním onemocněním, se kterým se setkáváme v dermatologické praxi. Péče o tyto pacienty je dlouhodobá a komplexní. Díky novým léčebným modalitám se u pacientů daří zvládat často obtížně řešitelné postižení, a zmírnit tak i jejich omezující schopnost vykonávat každodenní činnosti a psychosociální stres a stigma.
doc. MUDr. Ondřej Kodet, Ph.D.1,2
MUDr. Andrea Kodetová1
1 Dermatovenerologická klinika 1. LF UK a VFN
2 Anatomický ústav 1. LF UK
