V souvislosti s pokrokem v poznání imunologických mechanizmů, které vedou ke vzniku psoriatické artritidy, se v posledních letech výrazně rozšířilo terapeutické armamentárium, které máme k dispozici, stejně jako se upřesnila strategie léčby. To vše umožňuje cílit léčbu podle jednotlivých klinických komponent, jež se podílejí na výsledném klinickém obrazu konkrétního pacienta (personalizovaná medicína).
Každý nově zaváděný lék prochází náročným systémem klinických hodnocení, ve kterých je sledován efekt léčby i její bezpečnost. V následujícím textu shrneme metody hodnocení aktivity onemocnění a odpovědi na léčbu, přehled farmak, která máme v současné době k dispozici, a nakonec strategii léčby.
Psoriatická artritida (PsA) je zánětlivé kloubní onemocnění, které se řadí do skupiny tzv. spondyloartritid (SpA), charakterizované širokým spektrem klinických manifestací, které zahrnují periferní artritidy, zánětlivé postižení axiálního skeletu, entezitidy, daktylitidy a extraartikulární manifestace kožní (např. psoriáza), oční (např. uveitidy), střevní (jako Crohnova choroba, ulcerózní kolitida). Konečně představuje PsA rizikový faktor pro tzv. komorbidity, mezi nimi zejména kardiovaskulární onemocnění, poruchy nálad (vč. suicidálních tendencí), malignity, významná je i fibromyalgie (až v 17 % případů). Proto je psoriatická artritida v současné době označována spíše jako „psoriatická nemoc“ (PN).
Hodnocení aktivity onemocnění a odpovědi na léčbu
V poslední době se jako léčebný cíl prosazuje dosažení tzv. minimální aktivity onemocnění (minimal disease activity – MDA). Tento cíl zahrnuje více klinických manifestací psoriatické artritidy, lépe řečeno „psoriatické nemoci“, a hodnotí onemocnění komplexně (tabulka 1). Zahrnuje kromě kloubních parametrů (počet oteklých kloubů z 66 a počet bolestivých kloubů z 68) i hodnocení onemocnění pacientem (kloubní bolest na vizuální analogové škále 100 mm a globální hodnocení onemocnění pacientem) a dále počet míst s entezitidou, povrch kůže postižený lupénkou (BSA) a funkční postižení podle HAQ (Health Assessment Questionnaire).

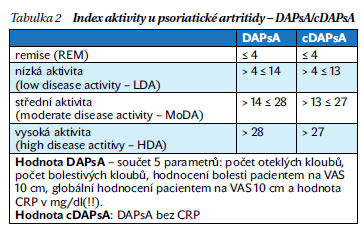
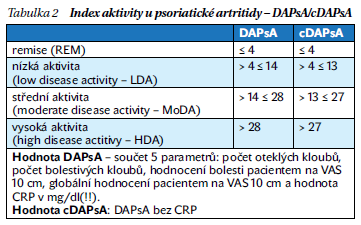
Problémem hodnocení aktivity psoriatické artritidy bylo dosud chybění numerického ukazatele aktivity (obdobně jako DAS28 u revmatoidní artritidy). V poslední době bylo navrženo několik takových systémů hodnocení, mezi nimi DAPsA (Disease Activity Index for Psoriatic Arthritis). Systém hodnocení aktivity podle DAPsA vyniká svou jednoduchostí a byl v roce 2015 pro PsA validizován. Je konstruován jako prostý součet 5 parametrů: počet oteklých kloubů, počet bolestivých kloubů, hodnocení bolesti pacientem na 10centimetrové vizuální analogové škále (VAS 10 cm), globální hodnocení pacientem na VAS 10 cm a hodnota CRP (v mg/dl!!). Současně byly definovány kritické hodnoty, podle kterých lze definovat remisi (REM), nízkou aktivitu (low disease activity – LDA), střední aktivitu (moderate disease activity – MoDA) a vysokou aktivitu (high disease activity – HDA). V tomto případě je cílem léčby takto definovaná remise, nebo alespoň nízká aktivita (LDA). Při nedostupnosti laboratorního vyšetření (CRP) lze použít „klinické varianty“ DAPsA – cDAPsA, která vynechává hodnotu CRP. V tom případě se kritické hodnoty pro střední a vysokou aktivitu snižují o 1 jednotku (tabulka 2).
Přehled preparátů
Přehled preparátů
Nově byla upravena terminologie jednotlivých druhů farmak používaných v léčbě PsA:
- konvenční syntetické chorobu modifikující léky (csDMARDs),
- biologické chorobu modifikující léky (bDMARDs),
- cílené (targeted) syntetické chorobu modifikující léky (tsDMARDs).
Léky s analgetickým a protizánětlivým účinkem:
Konvenční syntetická chorobu modifikující farmaka (csDMARDs):
- methotrexát,
- leflunomid,
- sulfasalazin.
Biologická chorobu modifikující farmaka (bDMARDs):
- inhibitory TNFα (TNFi): etanercept, infliximab, adalimumab, golimumab, certolizumab,
- inhibitory osy IL-12/23, IL-17:
- inhibitory IL12/23: ustekinumab,
- inhibitory IL17: sekukinumab, ixekizumab, bimekizumab, brodalumab,
- inhibitory IL-23p19: guselkumab, risankizumab,
- cílené chorobu modifikující léky (tsDMARDs):
- apremilast,
- inhibitory Janusovy kinázy (JAKi): tofacitinib, upadacitinib, filgotinib.
Nesteroidní antirevmatika (NSA)
Léky první volby u aktivní PsA, nemají žádný chorobu modifikující efekt a jejich použití v monoterapii je možné pouze u lehkých, nedestruktivních forem onemocnění bez výraznějšího kožního postižení.
Glukokortikoidy (GK)
Jejich systémové podání je indikováno u akutních vzplanutí jinak dobře kontrolovaných polyartikulárních forem po nezbytně nutnou (co nejkratší) dobu. Intraartikulární aplikace GK je užitečná u lokalizovaných forem (oligo/monoartritida, entezitida, daktylitida).
Konvenční syntetické chorobu modifikující léky (csDMARDs)
Patří mezi ně sulfasalazin, methotrexát (MTX) a leflunomid. Pro žádné z uvedených farmak ale nebyla prokázána schopnost zpomalit, nebo dokonce zastavit rentgenovou progresi. Podobně nebyla prokázána schopnost těchto farmak ovlivnit daktylitidy, entezitidy či axiální syndrom. U všech je třeba zohlednit jejich toxicitu.
Biologické chorobu modifikující léky (bDMARDs)
- Inhibitory TNFα (TNFi)
V současné době jsou pro léčbu PsA schváleny a pojišťovnami kategorizovány všechny inhibitory TNFa, tj. infliximab, etanercept, adalimumab, golimumab a certolizumab.
Obecně je biologická léčba anti-TNFa indikována v případě selhání léčby nižších úrovní, tedy zpravidla konvenčními syntetickými DMARDs v průběhu 3–6 měsíců (podle farmakokinetického profilu léku). Selháním léčby se rozumí nedosažení léčebného cíle, tj. remise, stavu „minimální aktivity“ (MDA) (tabulka 1) nebo nízké aktivity (LDA) (tabulka 2).
Nebyly prokázány rozdíly v účinnosti mezi jednotlivými inhibitory TNFa (TNFi), i když studie přímo srovnávající jednotlivé preparáty chybí. Nejsou žádné doklady o vyšší účinnosti TNF inhibitorů (TNFi) v kombinaci s csDMARDs ve srovnání s TNFi v monoterapii. Přesto může být výhodné přidat methotrexát k biologickému léku v případě nedostatečné odpovědi kožního syndromu. Důvodem může být i snížení imunogenicity biologického léku. To se týká zejména infliximabu.
TNFi jsou účinné i u entezitid a daktylitid. U pacientů s predominantním aktivním postižením axiálního skeletu je indikována biologická léčba bez předchozího pokusu s csDMARDs.
Hlavními nežádoucími účinky pro celou skupinu TNFi jsou infekce, zejména oportunní, mezi nimi hlavně tuberkulóza (TB). Před zahájením této léčby musí být pacient v tomto směru vyšetřen tak, aby byla vyloučena aktivní, ale i latentní TB infekce (rtg s+p a quantiferonový test, eventuálně pneumologické konzilium). Rovněž je třeba vyloučit aktivní virovou hepatitidu, zejména typu B (sérologické testy).
Pokud jde o těhotenství, doporučuje se ukončit léčbu TNFi do začátku třetího trimestru, i když nejsou jednoznačná data o jejich embryotoxicitě. Výjimkou je certolizumab (viz dále).
Infliximab – chimérická monoklonální protilátka proti tumory nekrotizujícímu faktoru (tumour necrosis factor alfa – TNFa). Molekula infliximabu je tvořena ze 75 % humánní a z 25 % myší komponentou (variabilní část imunoglobulinové molekuly – Fab). Eliminační poločas infliximabu je kolem 10 dní. Podává se v nitrožilních infuzích v dávce 3–5 mg/kg hmotnosti v 6–8týdenních intervalech. Na úvod léčby se podávají tyto infuze v týdnech 0, 2 a 6. Kombinace s methotrexátem je zde vhodná vzhledem k omezení tvorby antichimérických protilátek (HACA).
Etanercept – solubilní, dimerický fúzovaný protein, sestávající ze dvou extracelulárních částí humánního receptoru pro TNFα p75 a konstantní části humánního imunoglobulinu IgG1. Eliminační poločas etanerceptu je kolem 4 dní. Klinická hodnocení prokazují jeho účinnost u všech klinických manifestací, vč. periferních kloubů, entezitid a daktylitid, zpomaluje i rentgenovou progresi. U PsA se podává v subkutánních injekcích 50 mg 1× týdně.
Adalimumab – rekombinantní humánní monoklonální protilátka IgG1 specifická proti TNFα. Eliminační poločas adalimumabu je kolem 14 dní. Účinnost zůstává zachována i po přechodu z jiného TNFi, i když účinnost je numericky poněkud nižší. Podává se v subkutánních injekcích v dávce 40 mg 1× za 2 týdny. Podobně jako u etanerceptu jej lze podávat samostatně, bez MTX, ale kombinované podávání může v některých případech potencovat jeho účinnost.
Golimumab – plně humánní monoklonální protilátka proti TNFα. Eliminační poločas je 14 dní. Podává se subkutánně 1× měsíčně v dávce 50 mg.
Certolizumab – PEGylovaný Fab´ fragment monoklonální protilátky proti TNFα. Váže se na TNFα, a zabraňuje tak jeho vazbě na membránový receptor. Jeho účinnost zůstává zachována rovněž u pacientů dříve léčených jinými inhibitory TNFa. Vzhledem k těhotenství má certolizumab výhodu v tom, že je pouze minimálně transportován placentou (pokud vůbec), proto může být podáván i v průběhu těhotenství. Podává se subkutánně v iniciální dávce 400 mg v týdnech 0, 2 a 4 a dále v dávce 200 mg za 2 týdny.
- Modulace osy IL-12/23/IL17
Interleukiny 12 a 23 (IL-12/23) mají společnou podjednotku označovanou jako p40, druhou podjednotkou IL-12 je p35 a v případě IL-23 je to p19. IL-23 vede k proliferaci Th17 lymfocytů a expresi IL-17, který hraje významnou roli ve vývoji jak psoriázy, tak psoriatické artritidy. Cytokiny osy IL-12/23/IL-17 se tedy staly předmětem zájmu při vývoji nových farmak v léčbě psoriázy i psoriatické artritidy. V klinických studiích se tato farmaka skutečně ukázala být účinná v léčbě obou těchto onemocnění. Některá z nich jsou již používána, některá jsou v současné době předmětem klinických studií. Některá z nich cílí na inhibici společné podjednotky p40 interleukinu 12/23 (IL-12/23p40) (ustekinumab, briakinumab), jiná přímo na IL-17A (sekukinumab, ixekizumab), nebo na obě varianty – IL-17A a IL-17F (duální inhibitor bimekizumab), nebo na receptor pro IL-17 (brodalumab). Poslední ve vývoji biologik zaměřených na inhibici osy IL-12/23/IL-17 jsou biologika, která cílí na podjednotku p19 interleukinu 23 (IL-23p19) (guselkumab, risankizumab, tildrakizumab, mirikizumab).
Inhibitory IL12/23
Ustekinumab – plně humánní monoklonální protilátka IgG1κ se specifickou afinitou k podjednotce p40 cytokinů IL-12 a IL-23, kterým tak brání navázat se na receptory exprimované na povrchu imunitních buněk. Eliminační poločas je 15–45 dnů. Podává se v subkutánních injekcích v iniciální dávce 45 mg v týdnu 0 a 4 a následně 45 mg po 12 týdnech. U pacientů se středně těžkou a těžkou psoriázou se podává v dávce 90 mg ve stejném schématu. Ustekinumab (STELARA) je v ČR registrovaný pro použití u psoriázy také u PsA, kategorizován je zatím pouze pro použití u psoriázy.
Inhibitory IL-17
IL-17 je prozánětlivý cytokin, který hraje rovněž významnou roli v patogenezi psoriázy a psoriatické artritidy, podobně jako v jiných imunitně zprostředkovaných chronických zánětlivých onemocněních. Zvýšená exprese IL-17 byla nalezena jak v synovialis kloubů u pacientů s PsA, tak v psoriatických lézích. Inhibice tohoto cytokinu tak představuje relevantní cíl léčby PsA. Pokud jde o bezpečnost, vyskytuje se u celé této skupiny častěji kandidóza, která dobře reaguje na léčbu antimykotiky a ve studiích ale nevedla k přerušení studie. Mohou vést k exacerbaci preexistujících idiopatických střevních zánětů (IBD) – Crohnova choroba, ulcerózní kolitida. Proto by neměly být podávány u pacientů s osobní anamnézou IBD ani u pacientů s IBD u prvostupňového příbuzenstva.
Sekukinumab – plně humánní monoklonální protilátka proti IL-17A. Jeho účinnost byla prokázána v řadě studií (FUTURE-1 a FUTURE-2). Sekukinumab byl účinný bez ohledu na současnou léčbu methotrexátem či předchozí léčbu inhibitory TNFα. Podává se subkutánně v dávce 150 mg s iniciálním podáním v týdnech 0, 1, 2 a 3, následuje měsíční udržovací dávka od týdne 4. U pacientů se současně přítomnou středně těžkou až těžkou ložiskovou psoriázou nebo u pacientů nedostatečně odpovídajících na anti-TNFα je doporučená dávka 300 mg se stejným dávkovacím schématem. Každá dávka 300 mg je podána ve dvou dílčích subkutánních injekcích po 150 mg.
Ixekizumab (IXE)– humanizovaná monoklonální protilátka proti IL-17A. Jeho účinnost byla prokázána v řadě klinických studií (SPIRIT-P1, SPIRIT, SPIRIT H2H). Je vysoce účinný u psoriázy, kde 30–50 % pacientů dosáhne úplného vymizení psoriázy (PASI100). Jeho účinnost zůstává zachována také u pacientů s nedostatečnou nebo chybějící odpovědí na léčbu inhibitory TNFα. Podává se v úvodní dávce 160 mg s. c. (2 injekce) a dále 80 mg (1 injekce) každé 4 týdny.
Bimekizumab – IgG1κ humanizovaná monoklonální protilátka, která se selektivně váže jak na IL-17A, tak na IL-17F. Tím blokuje expresi prozánětlivých cytokinů a chemotaxi neutrofilů účinněji než blokáda pouze IL-17A či IL-17F. Biologický poločas je 20 dní. Pokud jde o výskyt idiopatického střevního zánětu (IBD) (problém všech inhibitorů IL-17), nebyl pozorován zvýšený výskyt ve srovnání s inhibitory IL-17A. Poněkud vyšší byl ale výskyt mukokutánní kandidózy (rovněž specifický problém inhibitorů IL-17), což naznačuje protektivní efekt IL-17F proti kandidové infekci. Nicméně všechny případy byly mírné a odezněly při topické, resp. perorální antifungální léčbě. V současné době probíhá klinická studie fáze III.
Brodalumab – blokátor receptoru pro IL-17. Studie s brodalumabem byla pozastavena pro zvýšený výskyt depresí.
Inhibice IL-23p19
Guselkumab – humánní IgG1λ monoklonální protilátka, která se váže na podjednotku IL-23p19, a tak inhibuje jeho efekt. Eliminační poločas je přibližně 17 dnů. Jeho účinnost u PsA byla prokázána ve studiích DISCOVER, jež hodnotily podávání guselkumabu pacientům s aktivní PsA, a to včetně nemocných, kteří byli již v minulosti léčeni inhibitorem TNFα. Guselkumab má velmi dobrý bezpečnostní profil. Významná je neutropenie, která se vyskytla u 5 % pacientů, podobně jako jiných farmak této skupiny (sekukinumab, ixekizumab a brodalumab). Guselkumab je v ČR registrován pro psoriázu i psoriatickou artritidu, pro kterou ale nemá dosud stanovenou úhradu. V indikaci PsA se podává v s. c. injekcích v dávce 100 mg v týdnu 0 a 4, dále po 8 týdnech. Může se podávat v monoterapii i v kombinaci s MTX.
Risankizumab – humanizovaná monoklonální IgG1 protilátka, která cílí na IL-23p19 podjednotku a selektivně inhibuje IL-23. Klinicky byl testován u psoriázy s výborným efektem, studie u PsA probíhá. Má indikaci pro psoriázu i PsA, v ČR ale zatím nemá registraci (ani úhradu). Podává se s. c. v dávce 150 mg v týdnu 0 a 4, dále po 12 týdnech.
Cílené chorobu modifikující léky
- Apremilast
Apremilast je specifický inhibitor fosfodiesterázy 4; jedná se o novou, malou molekulu pro perorální použití. Apremilast moduluje expresi prozánětlivých cytokinů prostřednictvím zvýšené hladiny intracelulárního cAMP s následným snížením hladin TNFa, IL-12 a IL-23.
Z výsledků dosavadních studií vyplývá, že účinnost apremilastu u psoriázy a psoriatické artritidy je relativně menší. Zdá se tedy, že bude vhodný u pacientů s dominantním kloubním postižením, s mírnou až střední formou a mírnou psoriázou, po selhání bDMARD 1 linie (TNFi). Významný je i jeho příznivý bezpečnostní profil.
- Inhibitory Janusovy kinázy (JAKi)
Janusovy kinázy (JAK) jsou intracelulární tyrozinové kinázy sloužící jako intracelulární signální molekuly pro různé prozánětlivé molekuly (včetně IL-23), které jsou nezbytné pro aktivaci a plnou funkci T lymfocytů.
Tofacitinib – neselektivní inhibitor JAK1 a JAK3, do menší míry i JAK2. Jde o malou molekulu určenou pro perorální podání. Tofacitinib mj. suprimuje expresi receptoru pro IL-23, a tím ovlivňuje diferenciaci Th 17 buněk. Současně interferuje se signalizací IL-6 a IFNg.
Byl schválen pro léčbu aktivní PsA v dávce 5 mg BID v kombinaci s MTX tam, kde nebylo dosaženo léčebného cíle konvenčními syntetickými DMARDs (csDMARDs), nebo nebyly tolerovány. V ČR nemá dosud v této indikaci úhradu.
Upadacitinib – selektivní inhibitor JAK1. Byl schválen FDA pro léčbu RA a je testován rovněž u jiných autoimunitních onemocnění, včetně ankylozující spondylitidy, systémového lupus erythematodes, idiopatického střevního zánětu a atopické dermatitidy.
U PsA byla jeho účinnost prokázána ve studiích SELECT PsA-1 a 2, a to i u pacientů, kteří neodpověděli na předchozí biologickou léčbu nebo ji netolerovali. Nevyskytly se žádné nové, neočekávané nežádoucí účinky ve srovnání s předchozími studiemi u revmatoidní artritidy. Výsledky těchto studií vedly ke schválení upadacitinibu pro léčbu PsA. V ČR zatím nemá úhradu.
Filgotinib – jiný selektivní inhibitor JAK1. Jeho účinnost u PsA hodnocená pomocí ACR50, LDA (DAPSA ≤ 14) byla prokázána ve dvojitě zaslepené studii fáze II EQUATOR s kontrolní fází. Další klinické studie probíhají.
Léčebná strategie
V popředí zájmu revmatologů v současné době je kromě hodnocení aktivity onemocnění a odpovědi na léčbu i nová strategie léčby. Ta se zaměřuje jednak na stanovení léčebného cíle (a jeho důsledné sledování), jednak na včasné zahájení léčby. Za včasné zahájení léčby se v současné době považuje zavedení léčby alespoň do 2 roku od první manifestace onemocnění, optimálně do 6 měsíců, což je ale prakticky obtížně realizovatelné.
Strategie léčby PsA vychází z doporučení EULAR z r. 2019
Cílem léčby je dosažení remise, resp. stavu „nízké aktivity onemocnění“.
V 1. úrovni léčby jsou indikována NSA, respektive lokální (intraartikulární) glukokortikoidy.
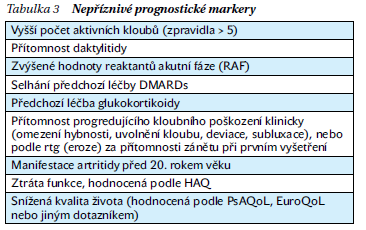
Tato léčba je indikována u lehkých, mono/oligoartikulárních forem, bez přítomnosti negativních prognostických markerů (tabulka 3). Léčebného cíle by mělo být dosaženo do 3–6 měsíců. V případě přítomnosti negativních prognostických markerů je indikována léčba na úrovni 2.
Ve 2. úrovni léčby jsou indikována csDMARDs.
- V případě monoartritidy či oligoartritidy s přítomností rizikových faktorů závažného průběhu, zejména strukturálním postižením (eroze na rtg, elevací RAF-FW, CRP, s daktylitidou) je indikováno neodkladné zahájení léčby csDMARDs s preferencí methotrexátu, zejména při současném závažném kožním postižení.
- V případě polyartritidy neodkladné zahájení léčby csDMARDs s preferencí methotrexátu, zejména při současném závažném kožním postižením.
Ve 3. úrovni léčby jsou indikována biologická farmaka (bDMARDs), resp. cílené chorobu modifikující léky (tsDMARDs).
Léčba bDMARDs je indikována:
- V případě periferní artritidy s nedostatečnou odpovědí na 1 nebo více csDMARDs.
- V případě dominujícího kožního postižení jsou v této situaci preferovány inhibitory IL-17 (sekukinumab, ixekizumab).
- V případě preexistujícího idiopatického střevního zánětu jsou preferovány inhibitory IL-17.
- V případě dominující jednoznačné entezitidy (verifikované USG nebo MRI vyšetřením), při nedostatečné odpovědi na NSA či lokální glukokortikoidy.
- V případě axiálního postižení se známkami aktivity, při neadekvátní odpovědi na NSA, zejména TNFi, v případě výrazného kožního postižení IL-17i.
Léčba tsDMARDs je indikována:
- v případě periferní artritidy s nedostatečnou odpovědí na 1 nebo více csDMARDs a alespoň 1 bDMARD,
- v případě periferní artritidy s nedostatečnou odpovědí na 1 nebo více csDMARDs v případě, že léčba bDMARDs není vhodná (JAKi),
- v případě mírné artritidy s nedostatečnou odpovědí na 1 nebo více csDMARDs v případě, že léčba bDMARDs ani JAKi není vhodná (inhibitor fosfodiesterázy 4 – apremilast).
Ve 4. úrovni léčby se řeší otázka dalšího postupu při selhání nebo intoleranci bDMARDs.
- změna za jiný bDMARD v rámci stejné třídy,
- po selhání dvou, respektive dalších bDMARDs stejné třídy změna za bDMARD s jiným mechanizmem účinku,
- změna na inhibitor Janusovy kinázy (JAKi),
- v případě setrvávající remise při léčbě bDMARDs je možné opatrné snižování dávky nebo prodloužení intervalu. Úplně vysazení biologické léčby vede zpravidla k relapsu onemocnění.
Závěr
Pro pacienty s PsA máme v současné době poměrně širokou paletu účinných léků, které jsou schopny dlouhodobě příznivě ovlivnit většinu komponent klinického obrazu psoriatické nemoci (kožní projevy, kloubní i extraartikulární). Současná léčba nabízí i různé aplikační formy – subkutánní injekce, intravenózní infuze, v poslední době i účinné „malé molekuly“ pro perorální použití (tsDMARDs), řada dalších je ve vývoji. To umožňuje do značné míry léčbu cílit na konkrétního pacienta. Součástí každé léčby ale musí vždy být řádné poučení pacienta o podstatě onemocnění, mechanizmu účinku léků i o potenciálních nežádoucích účincích. To pak umožňuje sdílet s pacientem rozhodování o způsobu léčby (shared decision). Ani při tak rozsáhlém a účinném léčebném armamentáriu nesmíme zapomínat na úpravu životního stylu s cílem udržovat normální tělesnou hmotnost, pravidelné cvičení a vyloučení kouření.
Literatura u autora.
MUDr. Jiří Štolfa
Revmatologický ústav Praha
