Předmětem přehledového článku je prezentace psoriatické artritidy jako heterogenního systémového onemocnění, které spolu se skeletem a kůží postihuje i oči a střevní sliznici. Kromě toho jsou velmi časté komorbidity, z nichž nejvýznamnější je zvýšené kardiovaskulární riziko. Jsou uvedeny jednotlivé klinické obrazy a klasifikační schéma pro psoriatickou artritidu a algoritmy současné léčby, které vycházejí z Doporučení České revmatologické společnosti publikované v loňském roce.
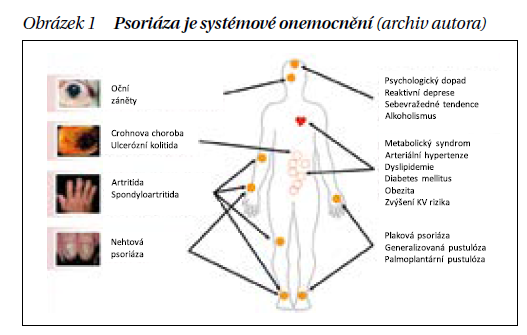
Psoriatická artritida (PsA) je chronické, zánětlivé, autoimunitní onemocnění, které postihuje kůži, axiální i periferní skelet kolem kloubní měkké struktury, ale má i mimoskeletální manifestace, jako je oční postižení a idiopatické střevní záněty. Kromě toho jsou časté i komorbidity, což jsou onemocnění, která přímo nesouvisí s mechanizmem nemoci, ale jsou častější nebo závažnější než v běžné populaci; řadíme sem metabolický syndrom, zvýšené kardiovaskulární riziko, obezitu, depresivní syndromy s častějším výskytem suicidálního chování (obrázek 1). Z výše uvedeného vyplývá, že PsA je velmi heterogenní onemocnění. Celkově je PsA nutno hodnotit jako onemocnění chronické a závažné, které vede potenciálně k destrukcím skeletu, snižuje funkci a kvalitu života a zkracuje dobu dožití.
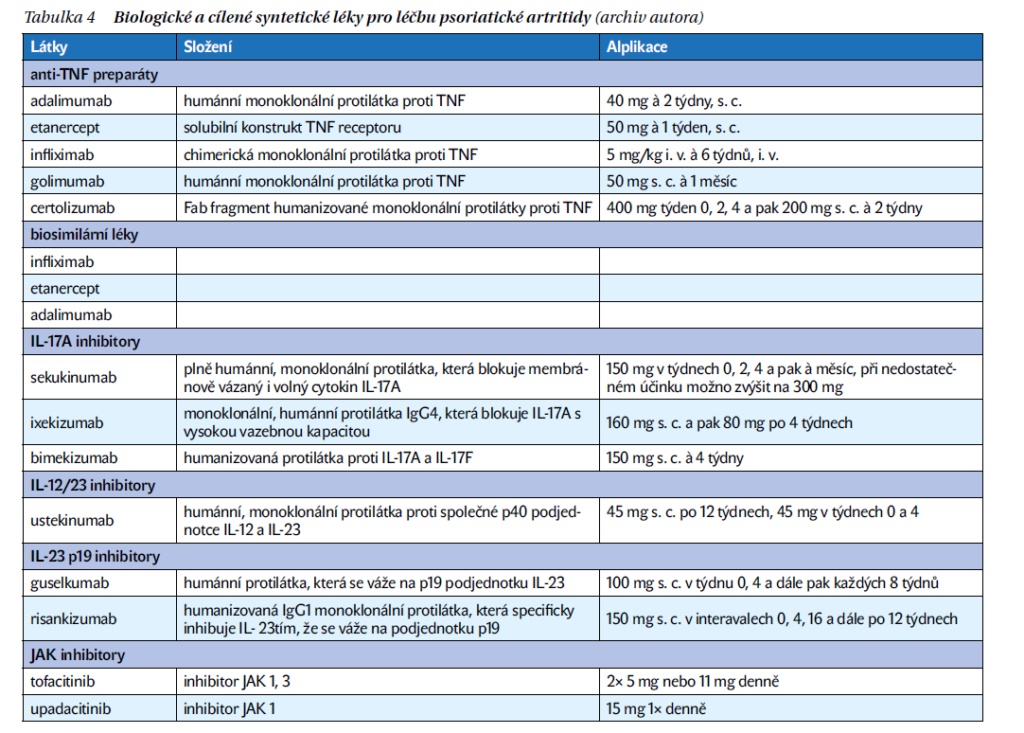
Důležité je časné a přesné určení diagnózy, vyhodnocení aktivity a postižení jednotlivých domén PsA. Vlastní algoritmus léčby je pak rozdělen do čtyř stupňů na principu step up. Spektrum léků pro PsA se značně rozšířilo. Nejdůležitější jsou tzv. chorobu modifikující léky, které jsme si zvykli nazývat podle anglického názvu DMARD (disease modifying antirheumatic drugs). DMARD dělíme na konvenční syntetické (csDMARD, methotrexát, sulfasazin a leflunomid), na biologické (bDMARD) a cílené syntetické (tsDMARD). Kromě anti-TNF léků jsou nyní dostupné anti-TNF preparáty, biosimilární léky, IL-17A inhibitory, IL-12 a IL-23 inhibitory, IL-23 p19 inhibitory, JAK inhibitory.
Etiopatogeneze
Etiopatogeneze PsA není jako u většiny autoimunitních onemocnění zcela známa. Uplatňují se zde jak faktory genetické, tak faktory zevního prostředí. Z genetických faktorů se uvádí nejčastěji výskyt antigenu HLA Cw 06, ale také HLA B 27, HLA 7, HLA B 38 a HLA B 39. Z environmentálních faktorů je jasně prokázán vliv kouření, a to na vznik jak psoriázy (PsO), tak PsA.
Prevalence a incidence PsA u pacientů s psoriázou
PsA vzniká v 85 % až po výskytu psoriázy (PsO), v 5 % vzniká PsA simultánně s psoriázou a v 5–10 % předchází vznik artritidy kožní psoriázu. V těchto případech hovoříme o PsA sine psoriasis a diagnózu je možné stanovit při dalších klasifikačních kritériích. Celkově ukazují novější epidemiologické studie výskyt PsA u PsO v 18–42 % s průměrem kolem 30 %. Některé studie ukazují zvyšující se incidenci PsA, ale to může být vyvoláno kvalitnější diagnózou a používáním nových diagnostických a klasifikačních kritérií.
Diagnóza a klasifikace
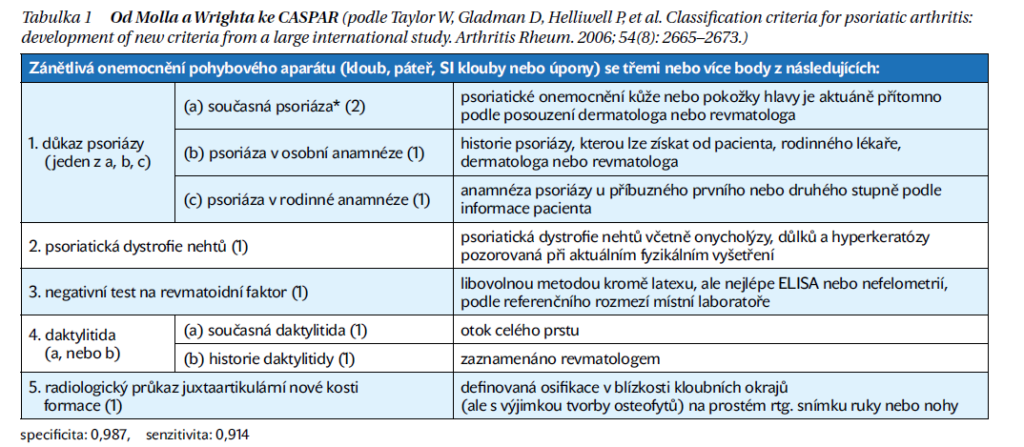
Protože jednoznačně patognomický test pro PsA není dostupný, bylo nutné vytvářet valorizovaná a široce akceptovaná klasifikační a diagnostická kritéria. Často se uvádí, že by měl být rozdíl mezi klasifikačními kritérii, která se používají především pro epidemiologické a další vědecké studie a mezi kritérii diagnostickými, která jsou vhodnější pro diagnostiku jednotlivých pacientů. Nicméně u PsA se ukázalo, že mezinárodní akademickou skupinou GRAPPA nověji navržená a validovaná kritéria CASPAR (tabulka 1) mají i v klinické praxi velmi dobrou senzitivitu a specificitu a je možné je doporučit pro běžnou klinickou praxi, čímž ale není řečeno, že musí být používána výhradně a je ponechán prostor pro stanovení individuální diagnózy lékařem. Tato kritéria jsou pozitivní, pokud jsou splněny 3/5 z nich (specificita 0,987, senzitivita 0,914). Je vhodné upozornit na některé důležité aspekty. Kritérium přítomnosti psoriázy je splněno jak při současné psoriáze, tak při anamnéze PsO nebo při přítomnosti rodinné anamnézy PsO. Postižení nehtů tvoří nezávislé kritérium a je jasným apelem na lékaře při podezření na PsA nehty vyšetřovat. Rtg. kritériem je pak přítomnost kolem kloubních kalcifikací na rukou a nohou při vyloučení osteofytů.
Klinické manifestace
Skeletální postižení je u PsA velmi variabilní a může postihovat jeden či více periferních kloubů nebo páteřní struktury. Původně navržené dělení PsA do 5 subtypů se dnes zvláště v akademické práci příliš nepoužívá, nicméně pro běžnou klinickou praxi je relativně vhodné (tabulka 2).
Postižení distálních interfalangeálních kloubů (DIP)
Postižení DIP kloubů bývá považováno za typický projev PsA, protože u jiných artritid (např. revmatoidní artritidy – RA) je vzácné. Ve skutečnosti je izolované či predominantní postižení DIP málo časté (kolem 10 %). Častěji bývá součástí postižení při polyartritidě. Postižení DIP bývá sdruženo s postižením nehtů a novější MRI studie ukázaly, že postižení DIP a přilehlého nehtu může tvořit jeden komplex, což by dále vysvětlovalo tuto asociaci.
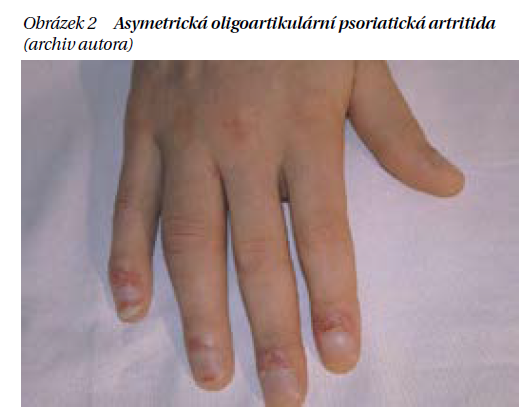
Asymetrická oligoartritida
Asymetrická oligoartritida je nejčastější manifestace PsA na začátku nemoci, nicméně její prevalence podle různých autorů kolísá od 20 do 70 %. Podle definice postihuje oligoartritida 4 a méně kloubů (obrázek 2). Převážně postihuje klouby dolních končetin (koleno, kotník, metatarzofalangeální klouby – MTP), ale někdy se rozšiřuje na DIP a PIP (oblast středního kloubu prstu) klouby na rukou a přechází do formy polyartikulární, a to častěji u mužů než u žen.
Symetrická polyartritida
Symetrická polyartritida postihuje 5 a více kloubů, často symetricky (např. 1 řada PIP kloubů), a proto se podobá revmatoidní artritidě a někdy se nazývá RA like. Většinou má závažnější průběh s výskytem erozivních změn. Diferenciální diagnóza proti RF a anti-CCP negat. RA může být obtížná, zvláště pokud jde o formy PsA sine psoriasis, kde jediným rozlišujícím kritériem jsou typické rtg. změny pro PsA (kolem kloubní osifikace, postižení DIP, změny na páteři).
Mutilující artritida
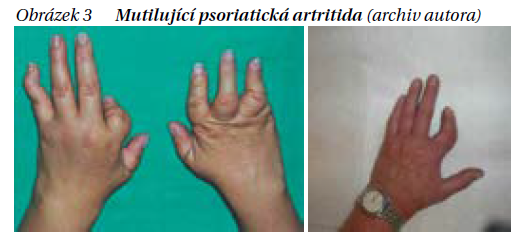
Jde spíše o subtyp PsA, do kterého se mohou vyvinout těžké erozivní změny, především původně polyartikulárních forem. Charakteristickým projevem jsou tzv. teleskopické prsty, kdy v důsledku osteolýzy falang dochází ke kolapsu falang prstů a jejich zkrácení s možností prodloužení do původní délky tahem shrnuté kůže (obrázek 3). U mutilující formy dochází k těžkému funkčnímu postižení rukou. Výskyt mutilující artritidy se uvádí 5–10 % a v poslední době i s nástupem biologické léčby klesá.
Axiální postižení
Axiální postižení tvoří asi jen 10 % pacientů s PsA, ale studie používající MRI k detenci sakroiliitidy prokazují, že výskyt může být i vyšší. Axiální postižení je způsobeno zánětem sakroiliakálních kloubů, zánětem kloubů a vazů na páteři. Klinicky se axiální PsA blíží axiální spondyloartritidě. Typickým projevem je zánětlivá bolest v dolních zádech. Nález sakroiliitidy je poněkud méně častý než u ankylozující spondylitidy. Pacienti s bilaterální sakroiliitidou mají častější výskyt HLA B 27. U části pacientů s axiální PsA se sakroiliitida neprokazuje. Část pacientů má mírně modifikovaný rtg. nález oproti primární AS, když sakroiliitida bývá např. jednostranná. Vyskytuje se také postižení krční páteře, které může vést k nestabilitě krční páteře a syndromu cervikální myelopatie. Jeden typ připomíná postižení C páteře u revmatoidní artritidy a druhý typ spíše u spondyloartritid. Může být klinicky němé a je nutné na ně myslet a provádět preventivní zobrazovací vyšetření a ev. zaujmout terapeutickou intervenci (režimová opatření, fixace límcem, spondylochirurgický zákrok).
Další muskoleskeletální manifestace
Entezitidy
Zánětlivé léze inzercí šlach ke kosti jsou typickým příznakem PsA a všech spondyloartritid. Vyskytují se ve 40 % případů pacientů s PsA, někdy jako iniciální příznak. Nejčastější jsou v oblasti paty, kde postihují jednak Achillovu šlachu, jednak plantární aponeurózu, dalšími častými lokalizacemi jsou koleno a ligamentózní inzerce na pánevní kosti, diagnóza entezitidy je klinická palpací, ale musí být odlišena od fibromyalgie. K jednoznačné diagnóze entezitidy mohou v určitých případech pomoci zobrazovací metody (sonografie, MRI).
Daktylitidy
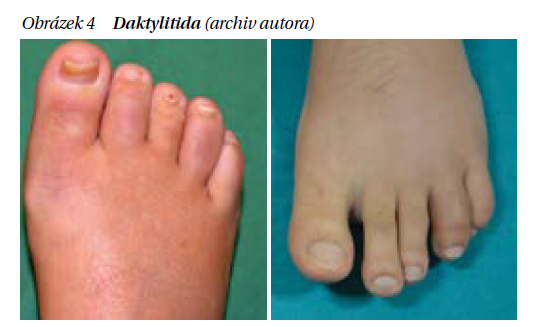
Daktylitida reprezentuje další typický příznak pro spondyloartritidy včetně PSA. Postihuje paprskovitě většinou jeden nebo více prstů, který má pak vzhled párku (párkovitý prst, sausage finger) (obrázek 4). Je vytvářen synovitidou kloubu, tenosynovitidou flexoru a otokem měkkých částí. Často se sdružuje s postižením nehtů. Celkově se vyskytuje až u 40 % pacientů s PsA a je častější na rukou než na nohou.
Extraskeletální manifestace
Nejčastější extraskeletální manifestací PsA je oční postižení. Typickým projevem PsA je akutní přední uveitida, která se kumulativně vyskytuje až u 25–30 % pacientů s PsA. Méně častými očními projevy PsA jsou suchá keratokunjunktivitida, konjunktivitida, episkleritida a skleritida.
Idiopatické střevní záněty (IBD)
Pacienti s psoriázou a PsA mají časté subklinické postižení střevní sliznice s rizikem vzniku Crohnovy nemoci. Ve studii Li a spol. bylo riziko Crohnovy nemoci 6× zvýšené u pacientů s PsA oproti psoriáze samotné. Riziko ulcerózní kolitidy zvýšené nebylo. Oproti běžné populaci však riziko IBD je zvýšené až 7×. Příčina může být genetická, a to zvýšený výskyt mutace pro gen kódující IL-23R.
Psoriáza
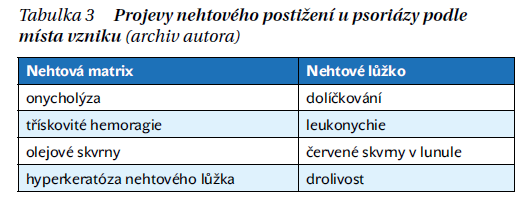
U většiny pacientů převládá plaková psoriáza (96 %), psoriasis guttata ve 2 %, oba typy současně pak v 15 % případů. Erytrodermie a palmoplantární pustulóza jsou vzácnější. Výskyt artritidy je vyšší při postižení kštice, intergluteální a perianální oblasti a postižení nehtů. Postižení nehtů se vyskytuje u pacientů s PsA až v 80 % oproti 40 % u pacientů s psoriázou. V obecné rovině závažnost psoriázy koreluje s rizikem vzniku PsA a při postižení lupénkou tří a více oblastí se riziko vzniku psoriázy zvyšuje 2,4×. Změny na nehtech jsou uvedeny v tabulce 3.
Komorbidity u PsA
Komorbidity jsou u PsA velmi časté a jsou uvedeny na obrázku 1, jejich epidemiologie pak v úvodu tohoto článku. Přítomnost komorbidit výrazně zhoršuje prognózu pacienta ve smyslu zhoršení funkčního stavu, horšího výsledku léčby a zkrácení dožití. Je nutné také zdůraznit význam interdisciplinárního charakteru léčby. Přítomnost komorbidit také zdůrazňuje nutnost interdisciplinární léčby.
Laboratorní vyšetření
Žádná laboratorní abnormalita není charakteristická pro PsA. Zvýšené reaktanty akutní fáze se nacházejí u 40–60 % pacientů s PsA. Větší vztah k reaktantům akutní fáze mají pacienti s polyartritidou než s axiální formou. Anémie se vyskytuje u 15 % pacientů a má charakter anémie chronických onemocnění. Hyperurikemie se vyskytuje asi u 20 % pacientů s PsA a souvisí se zvýšeným buněčným obratem při psoriáze. U části pacientů se vyskytuje v této souvislosti sekundární dna. Antigen HLA B 27 se vyskytuje u 40 % pacientů se sakroiliitidou, zatímco u pacientů bez sakroiliitidy se vyskytuje ve 20 %. Vzhledem k častým komorbiditám je vhodné také vyšetřit jaterní testy a lipidový profil.
Zobrazovací metody
Charakteristickým znakem PsA na periferních kloubech je současný výskyt proliferativních a destruktivních změn. Predilekčně jsou postižena distální a proximální skloubení na rukou a nohou. Distribuce změn je polyartikulární a asymetrická. Typické jsou akrosteolýzy distálních falang, lytické změny typu pencil in cup, ankylózy v oblasti falangeálních skloubení, diferenciálnědiagnosticky je nutné odlišit RA a erozivní osteoartrózu. Typickým znakem na axiálním skeletu je sakroiliitida jednostranná nebo oboustranná, klinicky často němá. Ankylóza není tak častá jako u ankylozující spondilitidy (AS). Typickým projevem na páteři u PsA jsou parasyndesmofyty, syndesmofyty a paraspinální osifikace. Parasyndesmofyty široce nasedají na tělo obratle a mají tzv. tvar býčího rohu. Stále důležitější místo v zobrazování pacientů s PsA má ultrasonografie. U pacientů s PsA lze na sonografii detekovat výpotek, hypertrofickou kloubní výstelku, tenosynovitidy (zánět šlachových obalů) a paratenonitidy (zánět šlachy, která nemá šlachový obal, a jejího okolí). V praxi se nejvíce sonografie používá při hodnocení entezitid v a v této indikaci také nejvíce pokročila standardizace hodnocení. Ve specifických situacích ať již periferních kloubů, nebo axiálního skeletu je vhodné použít magnetickou rezonanci.
Terapie
Před zahájením léčby PsA je nutné vzhledem k heterogenitě nemoci posoudit řadu aspektů. V prvním bodě je nutné posoudit typ a aktivitu artritidy, spondylitidy či dalšího skeletálního postižení, stupeň a typ postižení kůže, extraskeletální manifestace a přítomnost komorbidit. Toto komplexní zhodnocení je obzvláště důležité v současné době. Jednak proto, že více chápeme nemoc jako systémové onemocnění s mnoha klinickými doménami, a také máme k dispozici řadu nových biologických a cílených léků, které působí v různých doménách odlišně. Proto je důležitý výběr léku pro individuálního pacienta. Zásadním faktem při rozhodování o léčbě je určení aktivity PsA. Určení aktivity je vzhledem k heterogenitě choroby složité. Vhodné je posoudit množství oteklých kloubů, entezitidy, daktylitidy, ale i intenzitu bolestí v zádech, z laboratorních ukazatelů pak především reaktanty akutní fáze. Separátní numerické hodnocení jednotlivých domén je časově náročné a je určeno pro výzkum a terciární centra či registr. Z kompozitních indexů aktivity PsA se v revmatologické praxi nejvíce používá skoré DAPSA. Pro hodnocení spondylitidy lze použít skoré BASDAI.
Vzhledem k systémovému postižení organizmu při PsA je často nutná péče multidisciplinárního týmu složeného podle manifestace PsA. Při významnějším kožním postižení je nutná spolupráce dermatologa a revmatologa, a to včetně rozhodnutí o tom, kdo bude např. biologickou léčbu podávat. Rozhodnutí má být dále koncipováno jako sdílené rozhodnutí lékaře a pacienta. Cílem léčby je maximalizace kvality života prostřednictvím kontroly příznaků, prevence strukturálního postižení, normalizace funkce a sociálního zapojení. Zásadním cílem je potlačení zánětu. Doporučena je strategie léčby k cíli (T2T), kdy cílem léčby je stav remise či nízké aktivity.
Nefarmakologická léčba
Nefarmakologická léčba má být podobně jako u jiných revmatických onemocnění součástí komplexní léčby. Řadíme sem různé formy rehabilitace, LTV a fyzikální léčbu. Je vhodná u všech typů PsA. Z režimových opatření je vhodné přestat kouřit, korigovat váhu a dodržovat dietu navrženou kardiologem k redukci kardiovaskulárního rizika, dále omezit konzumaci alkoholu.
Farmakologická léčba
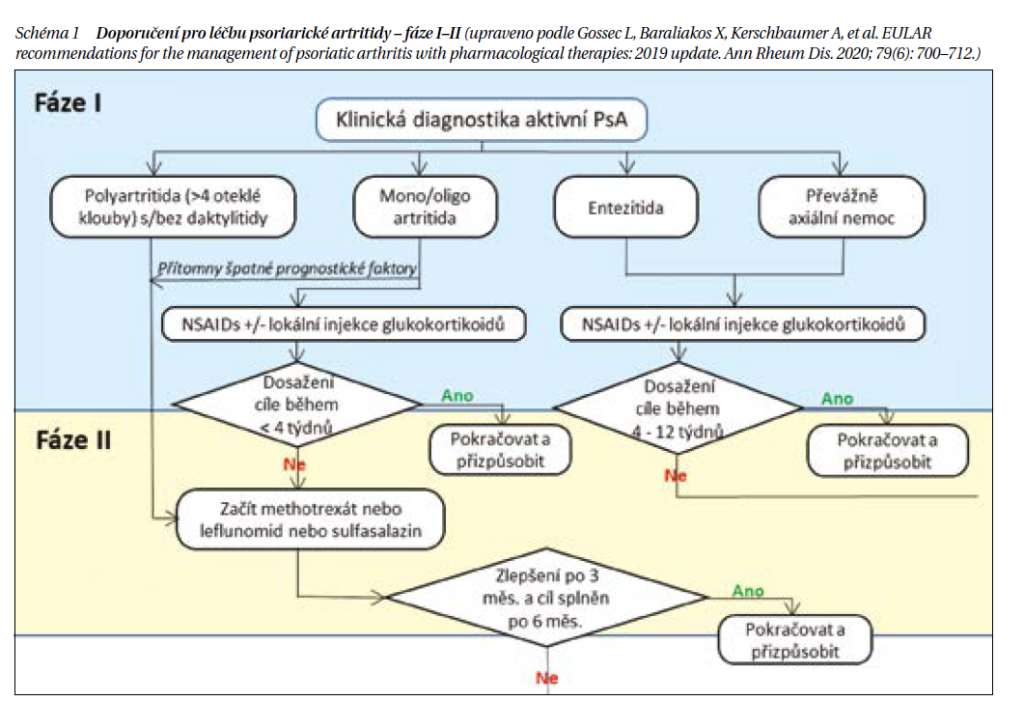
V roce 2023 byla publikována Doporučení České revmatologické společnosti pro léčbu PsA, která vycházejí z Doporučení Evropské ligy EULAR, publikovaných v inovované verzi rovněž v loňském roce. Zásadním rysem je strategie léčby v jednotlivých krocích či fázích I–IV jako step up (schéma 1, schéma 2). Spektrum léků pro PsA se značně rozšířilo (tabulka 4). Nejdůležitějším lékem PsA jsou tzv. chorobu modifikující léky, které jsme si zvykli nazývat z anglického názvu DMARD (disease modifying antirheumatic drugs). DMARD dělíme na konvenční syntetické (csDMARD, methotrexát, sulfasazin a leflunomid), dále na biologické (bDMARD) a cílené syntetické (tsDMARD). Systémově podávané glukokortikoidy se u PsA nedoporučují, snad s výjimkou poměrně vzácné polyartikulární aktivity nebo přítomného IBD. Jejich podávání by však mělo být po co nejkratší dobu a v nejnižší dávce. Detrakce léčby je pomalá, aby nedocházelo ke vzplanutí především kožního syndromu.
Fáze I: Ve fázi I. jsou doporučovány jednoduché postupy s cílem symptomatického potlačení především bolesti a ztuhlosti. Součástí I. fáze je aplikace nesteroidních antirevmatik (NSA) v kombinaci s lokální aplikací glukokortikoidů u forem s mono- či oligoatritidou či entezitidou. NSA mohou být dostatečným lékem u mírné synovitidy při PsA a při axiálních symptomech. NSA nejsou účinná na entezitidu, kožní syndrom a neovlivňují rtg. progresi. Při jejich aplikaci je nutné myslet na nežádoucí účinky NSA, především kardiovaskulární a gastrointestinální. Při artritidě by mělo být dosaženo cíle do 4 týdnů, při léčbě axiálního postižení do 8–12 týdnů. Pokud není cíle dosaženo, je vhodné přejít do fáze II.
Fáze II: Při selhávání fáze I je doporučeno rychlé zahájení fáze II. U pacientů s polyartritidou (4 a více oteklých kloubů) je doporučeno podat csDMARD, přičemž na prvním místě je doporučován methotrexát (MTX), ale při jeho kontraindikacích nebo časné nesnášenlivosti pak sulfasalazin nebo leflunomid. Stejný postup je doporučován u pacientů s mono- či oligoartritidou, kteří mají rizikové faktory špatného vývoje, kam řadíme vysoké reaktanty akutní fáze, strukturální progresi, daktylitidu a postižení nehtů. MTX je zvláště doporučován u pacientů s výrazným kožním postižením. Tolerance MTX je historicky považována u PsA za horší než např. u RA, především z hlediska hepatotoxicity, ale jasná klinická data toto nepotvrzují. Leflunomid a sulfasalazin mají menší účinnost na kůži. Cyklosporin dnes není k léčbě PsA doporučován. Jestliže nevede léčba csDMARD alespoň k 50% zlepšení po 3 měsících a cíle není dosaženo po 6 měsících, léčba by se neměla prodlužovat v této podobě a měla by přejít do fáze III. Nebyla prokázána účinnost csDMARD na axiální příznaky, proto fáze II není u těchto pacientů doporučována a po selhání NSA (ev. lokálních glukokortikoidů) je již indikována fáze III (bDMARD a tsDMARD).
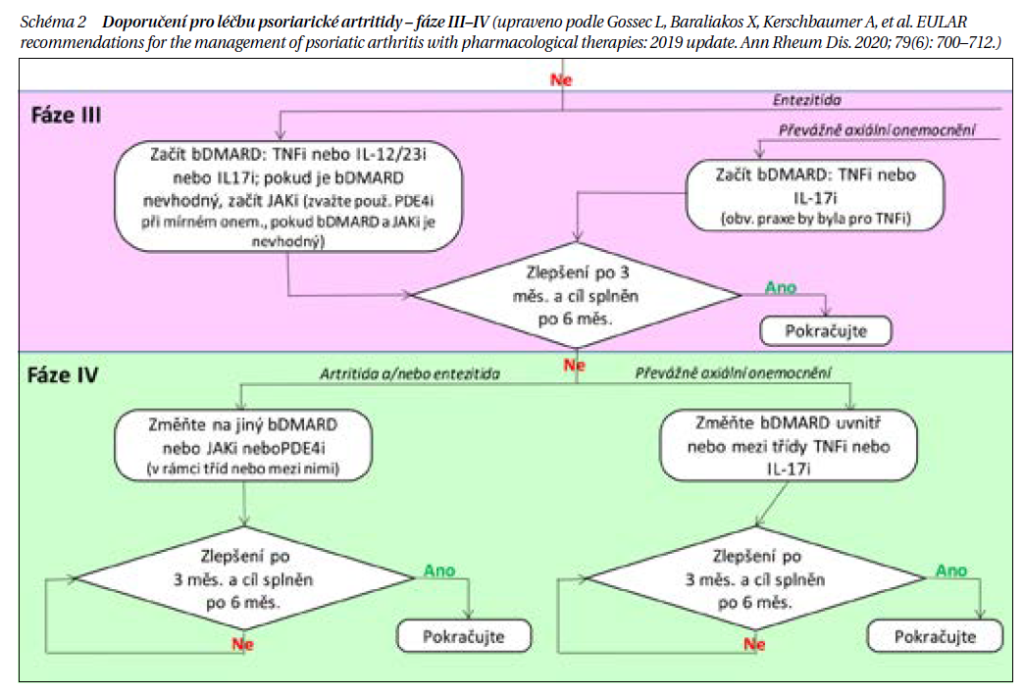
Fáze III: Pokud není dosaženo cíle ve fázi II, jsou indikovány bDMARD (inhibitory TNF alfa, anti-IL-17, anti-IL-12/23, anti-IL-23) nebo tsDMARD (inhibitor PDE 4, inhibitory JAK). V této fázi je vhodné specifikovat výběr léku podle převažující domény PsA. V současných Doporučeních jsou při výběru prvního léku této fáze kladeny do stejné roviny anti-TNF, anti-IL-17, anti-IL-23 nebo anti-IL-12/23. Při nevhodnosti bDMARD je možné podat v první linii léčby JAK inhibitor a u mírné formy inhibitor PDE4. Účinnost anti-TNF a IL-17 a anti-IL-23 je co se týče skeletálních příznaků považována za srovnatelnou, i když přímých srovnávacích studií je málo a evidence je získávána většinou metodou nepřímého srovnání různých studií, což má jistě metodologické problémy. IL-17 inhibitory prokázaly větší účinnost na psoriázu než anti-TNF preparáty, proto je u pacientů s výraznou psoriázou doporučován IL-17 inhibitor (sekukinumab, ixekizumab, bimekizumab). Naopak u pacientů s uveitidami jsou preferovány monoklonální protilátky, které jsou účinnější v prevenci uveitid, a zvláště u pacientů se současným ISZ, kde jsou IL-17 inhibitory neúčinné a mohou i riziko vzplanutí ISZ mírně zvyšovat (není doporučován ani etanercept). Účinnost inhibitoru IL-12/23 ustekinumabu je na kloubní syndrom nižší než u anti-TNF. U pacientů s mírnou aktivitou PsA je možné použít inhibitor PDE4, který patří do skupiny tsDMARD. Jeho účinnost je menší než bDMARD, výhodou může být relativní bezpečnost a jednodušší monitorování bezpečnosti léčby. Nově byly registrovány v indikaci psoriázy a PsA inhibitory IL-23 risankizumab a guselkumab ovlivňující příznivě většinu domén PsA. Nejsou zatím přesvědčivá data o ovlivnění axiálních příznaků. Komparativní výhodou IL-23 může být podávání v delších časových intervalech a dobrý bezpečnostní profil. Na základě úspěšných registračních studií byly schváleny pro léčbu PsA inhibitor JAK 1,3 tofacitinib a inhibitor JAK 1 upadacitinib. Většinou se doporučují ve druhé linii léčby po selhání bDMARD. Nicméně v případě nevhodnosti aplikace bDMARD je možné je použít již v první linii cílené léčby. Bezpečnost léčby JAK u starších pacientů se zvýšeným kardiovaskulárním rizikem je v současné době dále vyhodnocována. Důležitou strategickou otázkou při léčbě PsA je, zda podávat bDMARD či tsDMARD v monoterapii, či v kombinaci s MTX. Klinické studie srovnávající účinnost a setrvávání na léčbě přinášejí kontroverzní data. Konsensuální názor expertů ale říká, že pokud je MTX tolerován, ale nemá dostatečnou účinnost, je vhodné bDMARD či tsDMARD přidat (ad on strategie). U pacientů v dlouhodobé remisi PsA je možné uvažovat o detrakci léčby (snížení dávek bDMARD či prodloužení intervalů). U PsA je však nutné postupovat při detrakci léčby opatrně, protože je vyšší riziko vzplanutí kožního syndromu.
Fáze IV: Při aplikaci bDMARD dochází ve 30–40 % k primárnímu či sekundárnímu selhání léčby, tzv. není dosaženo cíle léčby (nedostatečná účinnost nebo nežádoucí účinky). Prakticky u všech bDMARD či tsDMARD byla prokázána účinnost i ve druhé linii léčby, i když je o něco menší než v linii první. Ve druhé linii léčby je možné použít bDMARD či tsDMARD s jiným mechanizmem účinku (tzv. switching) nebo se stejným mechanizmem účinku (tzv. cykling). Nebylo zatím jednoznačně prokázáno, který z postupů je účinnější a je doporučován individuální přístup.
Závěr
Důležitým nadřazeným principem léčby PsA je vhodná péče interdisciplinárního týmu. Dále je doporučován princip časné intenzivní léčby a používání zásad léčbay k cíli (T2T). Vlastní algoritmus léčby je pak definován ve 4 krocích na principu step up. Paleta registrovaných léků pro PsA se v posledních letech velmi rozšířila a umožňuje hledat pro individuálního pacienta lék optimálně ovlivňující převažující domény jeho jinak velmi heterogenního onemocnění psoriatické artritidy. Při výběru bDMARD či tsDMARD je také nutné mít na zřeteli bezpečnost léčby, která není předmětem této publikace. Důležité jsou i farmakoekonomické aspekty léčby a hledání levnějších variant, např. aplikováním biosimilárních léků.
Vypracováno za podpory MZ ČR 00023728.
prof. MUDr. Karel Pavelka, DrSc.
Revmatologický ústav Praha
