Bolest je v pokročilém stadiu onkologického onemocnění jeden z nejčastějších příznaků, které zhoršují kvalitu života. I když nemáme k dispozici mnoho nových preparátů, dochází k prohlubování našich vědomostí o léčbě bolesti. Abychom byli schopni nastavit pacientům léčbu bolesti správně, je třeba se s těmito novými poznatky průběžně seznamovat.
Bolest je jeden ze symptomů, se kterým se potýká většina onkologických pacientů. V pokročilém stadiu onkologického onemocnění má bolest až 90 % pacientů, proto je třeba se orientovat v možnostech, jak ji řešit. Dominantou léčby bolesti je farmakoterapie a hlavním pilířem jsou silné opioidy. Podle charakteru bolesti přidáváme a kombinujeme jednotlivá koanalgetika se silnými opioidy, s ohledem na celkový stav pacienta.
Přes veškeré naše možnosti je značná část pacientů (podle studií až 40 %), kteří nemají bolest dobře zmírněnou. Je však třeba doplnit, že někteří pacienti se obávají nežádoucích účinků medikace, popřípadě mají představu, že bolest k onkologickému onemocnění patří, tudíž se o bolesti před lékařem ani nezmíní. Proto bychom měli po bolesti aktivně pátrat, ale i adekvátně na ni umět zareagovat. Sice nám nepřibylo mnoho nových preparátů, ale na druhou stranu mnohdy neumíme využít potenciálu těch stávajících.
Bolest jako komplexní jev
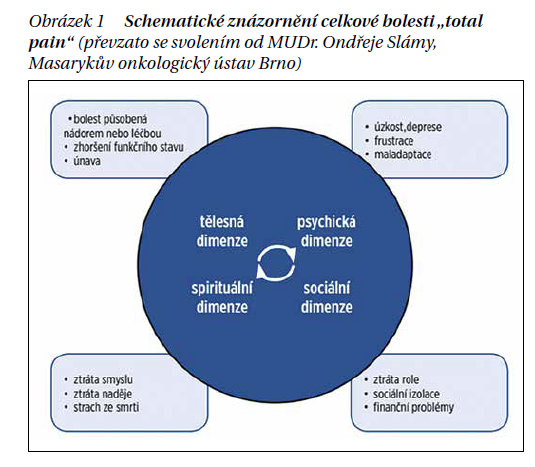
V současnosti již není bolest vnímána jen jako pouhá nocicepce, ale jedná se o komplexní jev, který označujeme jako „celková bolest“ (angl. total pain). Vnímání bolesti je ovlivněno jak psychologickými, sociálními, tak i spirituálními faktory (obrázek 1). Pro správné nastavení léčby bolesti je třeba vnímat tuto provázanost a intervenovat jednotlivé její složky (psychologické, sociální, spirituální). To často vyžaduje spolupráci v rámci multidisciplinárního paliativního týmu, ale v běžné praxi je o to důležitější, aby lékař s pacientem komunikoval a řešil nejen zmíněnou nocicepci.
Hodnocení bolesti
Ke správnému rozhodnutí je třeba dostatek informací. Proto potřebujeme vědět, jaká je:
- příčina bolesti (vyvolaná nádorem × protinádorovou léčbou × jiným chronickým onemocněním) – mohou se vyskytovat všechny složky souběžně v různém poměru,
- typ bolesti (somatická × viscerální × neuropatická) – mohou se vyskytovat všechny složky v různém poměru,
- časový průběh bolesti (trvalá stabilní × kolísavá nebo intermitentní),
- intenzita bolesti (mírná × střední × silná × nesnesitelná; vizuální analogová škála 0 = žádná bolest až 10 = nesnesitelná bolest),
- vliv somatických a psychosociálních faktorů (vliv úzkosti, deprese, deliria na vnímání a vyjadřování),
- stávající medikace a její efekt.
Je třeba zjistit nejen charakter, intenzitu a lokalizaci bolesti, ale i pacientovo očekávání. Na základě těchto informací je vhodné vytvořit s pacientem plán péče, vysvětlit kontext dané situace a samozřejmě i předestřít možné výsledky léčby. Poté zvolíme medikaci, přičemž postupujeme podle žebříčku WHO.
Terapie bolesti u onkologických pacientů
Pro volbu analgetika je stěžejní intenzita bolesti, kterou udává pacient. U onkologických pacientů se velmi často vyskytuje středně silná až silná bolest. V takovém případě, pokud využijeme neopioidní analgetika nebo slabé opioidy, je jejich efektivita malá a také zpravidla krátká. Následuje přechod na silné opioidy s výrazně vyšší spotřebou záchranné medikace. V případě silné bolesti je proto vhodnější postup zvolit ihned silné opioidy. Opioidy je třeba postupně titrovat a dávkovat v takových intervalech, aby byla zachována plazmatická hladina medikace. V případě úpravy medikace se vždy rozhodujeme o dávce jednotlivých preparátů, ale i zda nepřidáme koanalgetikum. Platí zásada, že není vhodné dělat více než dvě změny zároveň a je třeba ponechat medikaci beze změny do ustálení plazmatické hladiny, tedy většinou několik dní.
Slabé opioidy
Zde rozeznáváme dva preparáty, a to dihydrokodein a tramadol, které jsou využívány u středně silné a silné bolesti. Dominantně využíváme tramadol, který má široké možnosti aplikace (p. o., i. v., i. m., s. c.) s maximální denní dávkou 400 mg. Hojně jsou také využívány kombinované preparáty s antipyretiky (např. tramadol/paracetamol), kde je patrný synergický efekt. Díky tomu mohou být v přípravku nižší dávky jednotlivých preparátů, což vede k nižším nežádoucím účinkům. Proto jsou s výhodou využívány u opioid naivních pacientů a u starších pacientů. V případě, že nedojde ke zmírnění bolestí do několika dnů od nasazení maximální dávky, je indikován přechod na silné opioidy.
Silné opioidy
Je zde poměrně široké spektrum preparátů (tabulka 1), každý z nich má svá specifika. Zmínil bych jen některé s ohledem na možný rozsah tohoto textu.
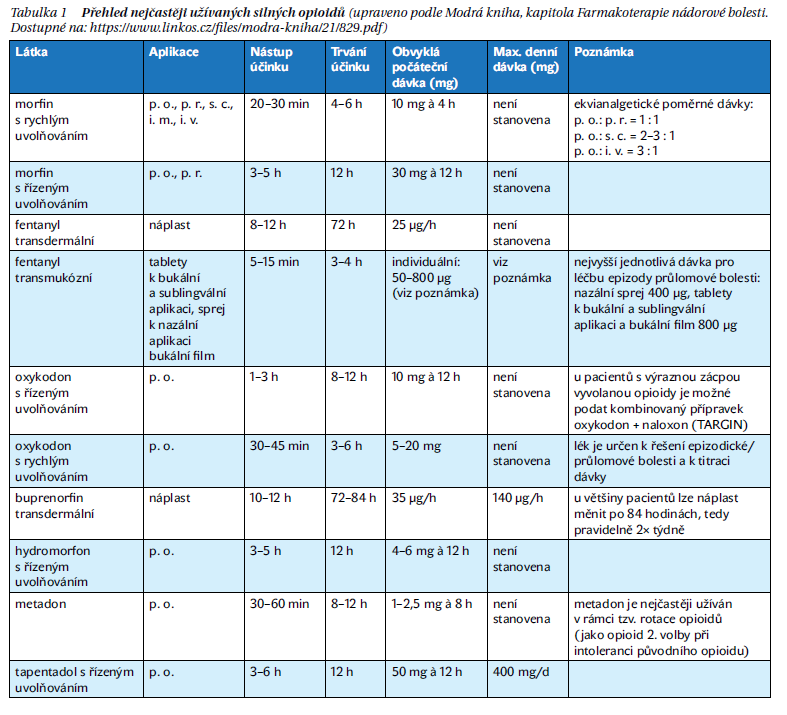
Fentanyl má různé formy aplikace, nejrozšířenější jeho formou je transdermální náplast, která patří k nejpoužívanějším preparátům celkově. Výhodou je výměna po 72 hodinách a dobrý profil nežádoucích účinků. Aplikace je na horní část trupu, nelepí se tedy na bolestivé místo. Počáteční dávka je zvykle 25 µg/h a po nalepení náplasti nastupuje efekt za 12–24 hodin. Plazmatická hladina se ustálí s odstupem cca 2–4 dní. Neaktivní metabolity vznikají v játrech, proto hepatální insuficience může zpozdit jejich eliminaci. Proto je třeba u pacientů se zhoršenou funkcí jater pečlivější monitorace, ale v běžné praxi není zpravidla nutná rotace opioidů ani snižování dávky. Taktéž je popsána interakce se selektivními inhibitory zpětného vychytávání serotoninu (SSRI) a inhibitory zpětného vychytávání serotoninu a noradrenalinu (SNRI) s rizikem rozvoje serotoninového syndromu. V případě rozvoje serotoninového syndromu by měl být fentanyl vysazen. V běžné praxi má však velká část pacientů antidepresiva (tedy SSRI či SNRI) zavedena a po přidání fentanylu k rozvoji tohoto syndromu nedochází. Nicméně nejen pro tyto nežádoucí účinky je třeba být s pacientem v opakovaném kontaktu a v případě rozvoje komplikací je promptně řešit.
Buprenorfin je dostupný pouze v transdermální náplasti. Výměna je možná po 84 hodinách, tedy 2× za týden. Jeho použití i nástup účinku jsou obdobné jako u fentanylu se zvyklou počáteční dávkou 35 µg/h. Metabolizován je v játrech, nicméně při renální a jaterní insuficienci není třeba redukovat jeho dávky. V porovnání s fentanylem se však u onkologických pacientů v běžné praxi toto nejeví jako výhoda, a navíc se prozatím udává stropová dávka 140 µg/h, což je u onkologických pacientů velkým hendikepem. Taktéž je třeba pečlivě monitorovat nežádoucí účinky, jelikož i zde při podání SSRI či SNRI může dojít k rozvoji serotoninového syndromu. Výhodou však je možnost podání na neonkologickou bolest, jako je bolest při revmatoidní artritidě či artróze vyššího stupně (např. před operační výměnou kloubu).
Oxykodon je v per os podobě s rychlým i řízeným uvolňováním. U řízeného uvolňování je počáteční dávka zvykle 20 mg po 12 hodinách. Výhodou je, pokud máme opioid naivního pacienta se silnou bolestí, kdy je možno přeskočit slabé opioidy a začít dávkou 10 mg. Protože nástup účinku je kolem 2 hodin, jsme schopni těsné monitorace a díky tomu i cílenější titrace dávky. K dispozici je také kombinovaný přípravek v podobě oxykodon + naloxon, který je výhodný pro pacienty s úpornou zácpou, nereagující na běžná osmotická laxativa.
Tapentadol je relativně nový preparát v per os formě, který je chemicky příbuzný tramadolu, ale patří mezi silné opioidy. Působí nejen na µ-opioidních receptorech, ale tlumí i zpětné vychytávání noradrenalinu. V rámci klinické praxe se osvědčil u pacientů, kteří netolerují ostatní silné a někdy i slabé opioidy. U těchto pacientů pomalá postupná titrace tohoto preparátu vede k úlevě od bolesti a zároveň ke snesitelným nežádoucím účinkům.
Metadon je silný opioid, který byl syntetizován již v roce 1937. Dosud jsme jej znali spíše v rámci léčby závislosti na opioidech, nicméně v některých zemích je dlouhodobě používán v rámci léčby bolesti. Jeho jedinečnost spočívá v jeho receptorovém profilu. Mimo jiné působí jako antagonista NMDA, dále blokuje zpětné vychytávání serotoninu a noradrenalinu, také však aktivuje inhibiční receptory GABA. Je zde několik strategií jeho využití – rotace za jiný opioid, ale i přidání jako adjuvantní opioid. V naší praxi spíše užíváme přidání metadonu jako druhý opioid při vysokých dávkách jiného opioidu. Nicméně tento preparát patří podle mého názoru již do rukou zkušeného algeziologa či paliatra pro jeho komplexnost a specifika titrace.
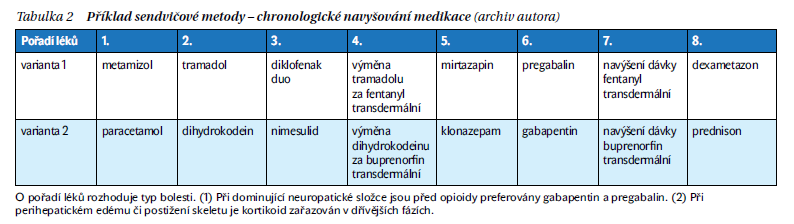
Sendvičová metoda a rotace opioidů
U pacienta s progredujícím onkologickým onemocněním nebo s vyčerpanou protinádorovou terapií je předpoklad opakovaného navyšování analgetik. Obdobná situace nastává i v případě dlouhodobé radioterapie, například u tumorů hlavy a krku. Pokud strategii analgetické terapie postavíme jen na opioidech, narazíme v krátkém časovém horizontu na komplikace v podobě obluzenosti, zmatenosti či předávkování spojeného až s útlumem dechového centra. Zejména při radioterapii jsou úpravy analgetik potřebné velmi často. Pokud však střídavě navyšujeme opioidy s přidáváním koanalgetik, vede to k synergickému efektu léků. Dalo by se to přirovnat k vytváření jakéhosi sendviče (tabulka 2). Synergický efekt preparátů má za následek nižší dávky léků, ale větší efektivitu. Nižší dávky znamenají zpravidla i nižší nežádoucí účinky.
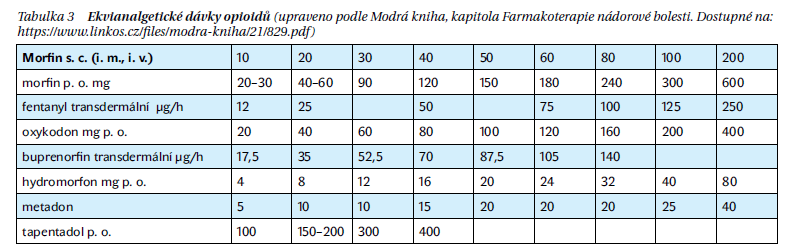
Rotaci opioidů využíváme při nedostatečném efektu stávajícího opioidu, resp. při vzniku tolerance, popřípadě pokud nežádoucí účinky převažují nad benefitem z daného opioidu. V rámci rotace vycházíme z ekvianalgetické dávky a zpravidla vypočítanou dávku redukujeme o 30–50 % (tabulka 3).
Koanalgetika
Jedná se o preparáty, které se podávají společně s opioidy v léčbě určitých druhů bolesti. U většiny pacientů se však nejedná o jeden konkrétní typ bolesti, ale jsou různě kombinovány. Proto v běžné praxi vidíme tato koanalgetika různě zkombinovaná, dalo by se říci, že pacientovi „šijeme medikaci na míru“.
V případě kostní nádorové bolesti k silným opioidům přidáváme bisfosfonáty, které však zařazujeme spíše z onkologické indikace. Významnou složkou jsoukortikoidy, které zařazujeme zejména u pacientů na symptomatické terapii nejen se záměrem analgetickým, ale i ke zlepšení chuti k jídlu. V úvodu volíme vyšší dávku a po dosažení efektu dávku postupně snižujeme, abychom minimalizovali nežádoucí účinky, jako je myopatie a mykotická mukozitida. V rámci kostní nádorové bolesti je vhodná i kombinace s analgetiky I. stupně podle žebříčku WHO, jako jsou NSA či antipyretika.
Neuropatická bolest je způsobena poškozením nervových struktur, proto je charakterizována pálením, bodáním, vystřelováním ze zad do končetin. Zde jsou dominantní antikonvulziva a antidepresiva, která mohou předcházet i silným opioidům. Nejvíce se v praxi využívají gabapentin a pregabalin. První volbou by měl být gabapentin, který je třeba postupně titrovat, abychom předešli rozvoji nežádoucích účinků. Při silných bolestech je třeba tyto preparáty kombinovat i s opioidy.
Z antidepresiv a anxiolytik dále využíváme mirtazapin či klonazepam. Tyto preparáty snižují míru bolesti spíše z pohledu „celkové bolesti“, kdy zmírňují frustraci a psychickou zátěž. Zajímavým koanalgetikem je konopí (Cannabis sativa či Cannabis Indica), s nímž bylo zprvu spojené velké očekávání ze strany pacientů. Postupem času se ukázalo, že spíše zlepšuje toleranci bolesti a také zkvalitňuje spánek. Když jsme se naučili s konopím pracovat, nalezli jsme pacienty, kteří z něj mají benefit. Patří však do rukou zkušeného lékaře, a toto je zajištěno nutností zvláštního certifikátu od SÚKL.
Rychlí metabolizéři
V klinické praxi se setkáváme s malou skupinou pacientů, u kterých opakovaně upravujeme analgetickou medikaci. Tito pacienti přicházejí do ambulance v krátkých časových intervalech s tím, že bolest po navýšení analgetik na krátkou dobu, zpravidla několika dní, polevila. Pokud použijí záchrannou medikaci, pak zaznamenají taktéž krátkou úlevu. Jedná se o pacienty, kteří rychleji metabolizují analgetika. Sice je popisováno, že těchto pacientů je až 10 %, ale z běžné praxe je jejich počet nižší a o to složitější je jejich odhalení. Jednoduchou pomůckou je dotaz, zda se bolesti zhoršují před aplikací další dávky analgetika (u fentanylu: zda třetí den je již „bolavější“, u oxykodonu: zda se bolest zhoršuje cca 2–3 hodiny před další dávkou). V takovém případě je správný postup zkrácení intervalu mezi jednotlivými dávkami (např. výměna fentanylové náplasti po 48 hodinách místo po 72 hodinách, oxykodon podáváme po 8 hodinách místo zvyklých 12 hodin). Dávkové intervaly poté zohledňujeme i u některých koanalgetik.
Průlomová bolest
U pacientů se střední, ale hlavně se silnou bolestí je kromě pravidelné dlouhodobé medikace vhodné pacienta vybavit i takzvaně záchrannou medikací (také se označuje jako SOS medikace). Tuto medikaci pacient využije, pokud nastoupí náhlá silná bolest. Podle spotřeby záchranné medikace a podle charakteru bolesti se rozhodujeme o úpravě dlouhodobé medikace. Pokud je tedy třeba záchranná medikace 1–2× za den, pak není nutná úprava dlouhodobé medikace. Naopak pokud je spotřeba 3–4× za den, a to opakovaně, pak je nezbytné dlouhodobou medikaci navýšit.
Nicméně je třeba zohlednit i délku průlomové bolesti. Podle délky se odvíjí, zda je smysluplné navýšit základní medikaci, nebo jaký preparát podat jako záchrannou medikaci. Definice průlomové bolesti se vyvíjela a z toho plyne, že i její řešení se vyvíjí. V poslední době hojně využíváme sublingvální fentanyl či intranazální sprej fentanylu, ale není to jediné řešení. V některých zemích, jako je Německo, převažují na průlomovou bolest preparáty, jako je metamizol či paracetamol. Pokud je pacient na nižších dávkách dlouhodobých opioidů, pak jako záchrannou medikaci lze použít i slabý opioid (tramadol).
Nežádoucí účinky
Nejčastěji se setkáváme s nevolností, zvracením a zácpou. Ostatní nežádoucí účinky jsou spíše zřídkavé.
V případě opioid naivního pacienta je vhodné jej upozornit, že se může dostavit nevolnost až zvracení. Proto je vhodné u rizikových pacientů při prvním podání opioidů přidat do základní medikace i základní antiemetika, jako je metoklopramid či thiethylperazin. Vhodné je souběžně užívání cca 4–7 dní.
Zácpa nastává takřka u všech pacientů s opioidy a její intenzita je spojena i s dávkou medikace. Ne vždy je naplněna definice zácpy, mnohdy je stolice jen tuhá, nepříjemná, bolavá, ale i přesto je vhodné podávání laxativ. V takových případech je třeba použít osmotická laxativa (laktulóza či makrogol), a ta užívat pravidelně. Jejich efektivita nastupuje se zpožděním 1–2 dní, což je způsobeno jejich mechanizmem účinku, protože udrží více tekutin ve stolici, čímž dochází ke zmírnění zácpy. Pokud ani přidání těchto léků nevede k efektivitě, je třeba přidat ještě klasická laxativa k nastartování peristaltiky. Pokud ani nyní není dosaženo úlevy, je možné použít kombinovaný preparát oxykodon + naloxon, který může obstipaci zmírnit. Novějším preparátem je naloxegol, což je o pegylovaná forma naloxonu, tudíž pokud se vstřebá, pak rozhodně neproniká hematoencefalickou bariérou. Preparát naloxegol umožňuje opioidy kombinovat podle našeho uvážení a je možné jej rozpustit ve vodě a aplikovat i do PEG, což je velkou výhodou u nemalé skupiny pacientů.
Závěr
Vzhledem k narůstajícímu počtu onkologických pacientů je znalost farmakologie základní podmínkou léčby bolesti. Rozšiřující se znalosti umožnují efektivnější terapii bolesti, zde je však třeba zohlednit i ostatní faktory v rámci konceptu „celkové bolesti“. Proto je neméně důležité s pacientem komunikovat o cílech léčby, aby porozuměl kontextu situace. Platí stejně jako v jiných oborech, že je třeba „ušít“ léčbu bolesti pacientovi na míru, přičemž u onkologických pacientů je při silné bolesti dominantním pilířem silný opioid.
MUDr. Lukáš Pochop
Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno
