Malobuněčný karcinom plic (small cell lung cancer – SCLC) je jedním ze skupiny plicních nádorů. Jde o agresivní neuroendokrinní nádor charakterizovaný časnými a četnými metastázami, které vyžadují rychlou léčbu, jinak přežití nemocných je v řádu týdnů až měsíců. I přes pokrok v oblasti klinické onkologie v posledních 20 letech se však léčba SCLC nijak zvlášt neposouvala. V posledních letech nám daly jistou naději probíhající studie s imunoterapií a rok 2022 se stal zlomovým i po stránce úhrady imunoterapie. Naděje se upíná tedy i tímto směrem, nicméně SCLC zůstává chorobou se špatnou prognózou.
Histologicky se v případě SCLC jedná o jistou formu neuroendokrinního tumoru (NET). Výskyt je udáván cca 20 % všech plicních nádorů, nicméně poslední léta v praxi vídáme spíše nárůst tohoto onemocnění. Aktivní kuřáctví či bohatá kuřácká minulost představují hlavní rizikový faktor a typicky se nádor objevuje ve věku 65–75 let. U nemocných jsou anamnesticky často přidruženy i další choroby typu CHOPN, ischemická choroba srdeční, hypertenze a další. Potíže, které nemocné vedou k lékaři, bývají obvykle kratšího intervalu a rychle se zhoršují (dušnost, rychle progredující kašel, hemoptýza, bolesti, otoky a další).
Tumor má vysokou mitotickou aktivitu, proto je povahově rychle rostoucí, agresivní a brzy zakládá metastázy, i vzdáleně. Z těchto důvodů není indikován k operačnímu výkonu. Je však citlivý na chemoterapii a radioterapii, tudíž tyto dvě léčebné modality představují základní pilíř léčby. Bohužel i přes léčebné odpovědi velmi často dochází k relapsům a s každou další linií léčby klesá i úspěšnost terapie.
Rozdíl v přístupu limitovaného a extenzivního stadia choroby
V případě malobuněčného karcinomu plic se stále kromě TMN klasifikace v praxi užívá limitované stadium nemoci (limited disease – LD) a extenzivní stadium (extensive disease – ED). Má to velkou praktickou souvislost především k radioterapii.
Jen cca jedna třetina nemocných je v době diagnózy v limitovaném stadiu, u většiny nemocných (dvě třetiny) jsou vstupně zjištěny vzdálené metastázy.
Velkým pokrokem v diagnostice je v současné době PET/CT vyšetření. Troufnu si říci, že kde je toto vyšetření dostupné, stává se součástí vstupní diagnostiky.
Klasická, lety ověřená léčba
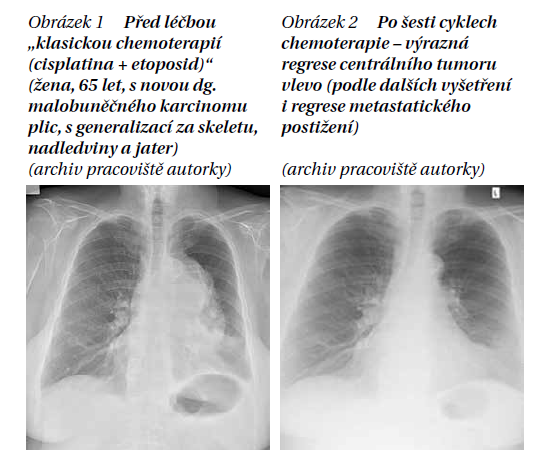
U obou stadií choroby se používá „klasická chemoterapie“, a to v kombinaci platinového derivátu (cisplatina či karboplatina) a etoposid. Zatímco u extenzivní formy nemoci bývají cytostatika často jedinou léčebnou modalitou, neboť pacient má vzdálené metastázy, u limitované formy se chemoterapie kombinuje s radioterapií.
Cílem je kurabilní forma léčby, tedy pokud je nemocný v dobré kondici, největší terapeutický profit má z konkomitantního režimu, kdy se snažíme s chemoterapií současně i ozářit tumor či přilehlé uzlinové postižení. U křehčích nemocných s LD pak volíme šetrnější, sekvenční podání léčby. To sice má statisticky horší výsledky stran trvání odpovědi a celkového přežití, nicméně kombinovaná současná chemoterapie s radioterapií je velice náročná na kondici nemocného, a je tedy nutné multidisciplinárně uvážlivě indikovat intenzivnější formy léčby.
Radioterapii indikujeme velmi často i samostatně s paliativním záměrem, například s analgetickým záměrem při kostním postižení, ozáření mozkových metastáz, s hemostyptickým záměrem u protrahovaných či silnějších hemoptýz atd.
Po selhání cytostatické léčby bývá volen tentýž režim, pokud došlo k relapsu v delším časovém odstupu. Pokud onemocnění progreguje i na léčbě nebo záhy po ukončení režimu, mluvíme spíše o refrakterním onemocnění, a přestože se indikují jiná cytostatika, úspěšnost léčby bývá minimální.
Změny v indikacích profylaktického ozáření neurokrania
V minulosti bylo nemocným s LD nabízeno často profylaktické ozáření neurokrania (PCI), které mělo docílit snížení rizika generalizace do mozku a zvýšení celkového přežití (OS). Indikováni k tomu byli především nemocní v dobrém klinickém stavu a s delším předpokladem života. Data dlouhodobého sledování těchto nemocných ale ukázala, že zároveň u této skupiny nemocných docházelo k výraznému poklesu kognitivních funkcí, a to až trojnásobně, což mělo vliv na kvalitu života nemocných.
Na základě toho je po kurabilní onkologické léčbě voleno aktivní sledování, ideálně pomocí magnetické rezonance (MR) v pravidelných intervalech. Tomu nahrává i skutečnost, že dostupnost MR se v České republice zvyšuje a je standardem užívaným v rámci sledování.
Novinka léčby: imunoterapie pro nemocné s ED
V posledních letech se intenzivně zapojovala k paliativní chemoterapie i imunoterapie. Cílem kombinování protinádorové imunoterapie je maximalizace aktivace imunitního systému nemocného, tedy konkrétněji vlastních lymfocytů, aby se probraly z jakési „paralýzy“ a aktivně se podílely na likvidaci tumoru.
Všechny dostupné léky, které se v léčbě karcinomu plic doposud používaly, působily přímo na nádorovou buňku, snažily se zablokovat její další dělení. Pro tyto preparáty bylo charakteristické, že po jejich vysazení protinádorový efekt pominul. Imunoterapie je mechanizmem účinku úplně jiná. Zablokujeme-li osu PD‑1/PD‑L1, dojde k posílení protinádorové imunitní T buněčné odpovědi. Díky paměťovým funkcím imunitního systému tyto léky mohou účinkovat i po ukončení imunoterapie, čímž docílíme dlouhodobého efektu. To je situace, která byla dosud v onkologii „sci-fi“.
První vlaštovky – atezolizumab a durvalumab
První jmenovaný lék, atezolizumab, prokázal svoji účinnost ve studii IMpower133. Pacienti s extenzivním stadiem choroby podstupovali buď klasické schéma chemoterapie (karboplatina/cisplatina + etoposid), nebo s chemoterapií aplikovaný i atezolizumab. Po ukončení indukční fáze (4 cykly à 3 týdny) následovala udržovací léčba atezolizumabem nebo placebem. Studie prokázala zlepšení celkového přežití s 24% redukcí rizika smrti u pacientů léčených v experimentálním rameni (medián OS 12,3 měsíce v rameni s atezolizumabem + ET/CP vs. 10,3 měsíce v kontrolním rameni). Medián doby do progrese byl taky signifikantně delší v rameni atezolizumab + ET/CP [5,2 vs. 4,3 měsíce; HR: 0,77 (95% CI: 0,62–0,96; p = 0,017)]. U pacientů s atezolizumabem byl hlášen nežádoucí účinek (NÚ) léčby stupně 3–4 u 56,6 %, v rameni s placebem u 56,1 % pacientů, závažné NÚ spojené s léčbou se vyskytly u 22,7 vs. 18,9 % pacientů. Nejčastějšími nežádoucími účinky stupně 3 a 4 byly v obou ramenech neutropenie, anémie a pokles počtu neutrofilů.
Druhým favoritem je durvalumab – selektivní, vysoce afinitní upravená lidská IgG1 monoklonální protilátka, která blokuje vazbu ligandu PD-L1 na receptor PD-1 a molekulu CD80. Účinnost imunoterapie u pacientů s ES-SCLC byla hodnocena ve studii CASPIAN. Studie byla randomizovaná, otevřená, multicentrická, klinická dosud neléčených pacientů s ES-SCLC, kteří byli vhodní k léčbě chemoterapií na bázi platiny jako léčby první linie pro SCLC. Do studie byli rovněž zařazeni pacienti s asymptomatickými nebo léčenými mozkovými metastázami. Pacienti byli randomizováni (v poměru 1 : 1 : 1) do skupiny durvalumab plus platina-etoposid; durvalumab plus tremelimumab plus platina-etoposid; nebo samotný platina-etoposid. Pacienti dostávali až čtyři cykly platina-etoposid plus durvalumab 1 500 mg s tremelimumabem 75 mg, nebo bez něj každé 3 týdny, po nichž následovala udržovací léčba durvalumabem 1 500 mg každé 4 týdny do progrese onemocnění nebo do nepřijatelné toxicity ve skupinách s imunoterapií a až 6 cyklů platina-etoposid každé 3 týdny plus profylaktické ozařování lebky (PCI, podle uvážení zkoušejícího) ve skupině se standardní chemoterapií – platinou a etoposidem. Primární cílový ukazatel bylo celkové přežití (OS).
Analýza studie říká, že přidáním durvalumabu k chemoterapii se významně zlepšilo OS nemocných, riziko úmrtí se snížilo o 25 % ve srovnání se samotnou platinou-etoposidem (HR = 0,75 [95% CI: 0,62–0,91], p = 0,0032). Po 12 měsících od zahájení léčby žil vyšší podíl pacientů léčených durvalumabem plus platinou-etoposidem ve srovnání se samotnou chemoterapií (52,8 vs. 39,3 %). Stejně tomu bylo po 18 měsících (32 vs. 24,8 %), resp. 24 měsících (22,2 vs. 14,4 %) a 36 měsících (17,6 vs. 5,8 %).
Kombinovaná léčba durvalumabem plus platinou-etoposidem je v současné době jediná imunoterapie hrazená zdravotními pojišťovnami a její podání je vázáno na komplexní onkologická centra.
Otázky do budoucna: Rozdělení „jednotného“ malobuněčného karcinomu?
Molekulární klasifikace čím dál tím více rozděluje SCLC na různé subtypy s různým chováním a citlivostí na léčbu. Rozdílná exprese proteinů ASCL1, NEUROD1, YAP1 a POU2F3 v nádorové tkáni definuje biologicky odlišné typy. I v praxi vídáme rozdílné chování a agresivitu tohoto do nynějška „jednoho“ malobuněčného nádoru. Dosavadní data ukazují, že ASCL1 je nezávislým negativním prognostickým markerem, zatímco např. POU2F3 je spojen s příznivějšími výsledky přežití.
Jak ale s těmito informacemi naložíme v praxi? Pomohou nám vybrat pro dané jedince léčbu lépe?
Závěr
Největším pokrokem (po desítkách let) v léčbě malobuněčného karcinomu plic je přidání imunoterapie k chemoterapii u nemocných s extenzivní, pokročilou formou nemoci. Aby vše nebylo tak jednoduché, poznáváme i negativní stránku imunoterapie, čímž je myšlena toxicita. Je mnohdy nepředvídatelná, bouřlivá a my se musíme učit imunoterapii citlivě využívat. Nelze opomenout ani pokroky v radioterapii, podpůrné léčbě a dalších oblastech. To vše, ruku v ruce, pomalu, ale jistě posunuje přežití nemocných s již tak infaustní prognózou.
Tato práce byla podpořena výzkumným programem Univerzity Karlovy, Cooperatio 34.
MUDr. Jana Krejčí
MUDr. Petr Opálka, CSc., MBA
doc. MUDr. Norbert Pauk, Ph.D.
Klinika pneumologie 3. LF UK a FN Bulovka, Praha
