Uroteliální karcinom nejčastěji postihuje močový měchýř, jeho výskyt v horních cestách močových je relativně vzácný. Po absolvování radikální terapie zůstává riziko rekurence uroteliálního karcinomu vysoké. Výsledky operačního zákroku a perioperační terapie jsou omezené, navíc u řady nemocných není možné podat neoadjuvantní chemoterapii a alternativní léčba v současné době neexistuje.
Cílem terapie je optimalizace léčebného postupu se snížením rizika návratu onemocnění a zlepšení prognózy lokalizovaného nádoru.
Současné možnosti neoadjuvantní léčby
Neoadjuvantní chemoterapie (NAC) na bázi cisplatiny následovaná radikální cystektomií (RACE) představuje v současné době léčebný standard u svalovinu invadujícího karcinomu močového měchýře (muscle invasive bladder cancer – MIBC) (schéma 1). NAC je indikována u pacientů v klinickém stadiu T2–T4 nebo N1 MIBC, kteří jsou vhodní k léčbě cisplatinou. Dvě randomizované klinické studie a metaanalýza prokázaly benefit v celkovém přežití (overall survival – OS) ve srovnání se samotnou RACE. Neoadjuvantní studie s chemoterapií jsou shrnuty v tabulce 1. Faktem zůstává, že dostatečně fit na chemoterapeutický režim s cisplatinou je méně než polovina nemocných, zbývající část nemocných, které nemůžeme považovat za vhodné kandidáty kombinovaného přístupu, podstupuje rovnou RACE. Navzdory radikálnímu přístupu zhruba 50 % pacientů bude mít do 2 let systémovou rekurenci onemocnění. Pokud nebyla podána NAC, je možné chemoterapii zvážit v adjuvantním podání u vhodných pacientů.
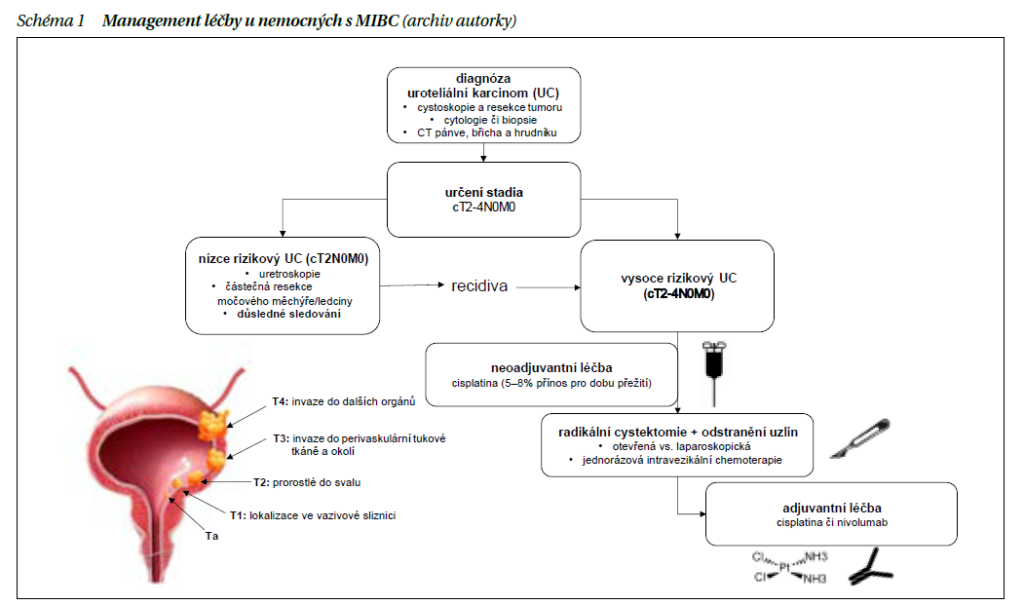
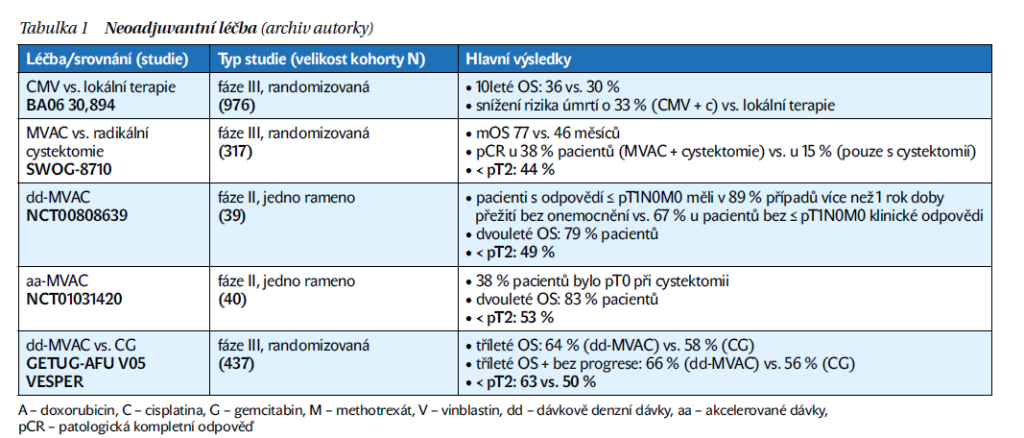
Dvě randomizované studie fáze III prokázaly prodloužení OS při podání chemoterapie na bázi cisplatiny při neoadjuvantním podání. Ve studii SWOG-8710 bylo randomizováno 317 nemocných s MIBC stadia T2–T4aN0 ke 3 cyklům chemoterapie ve složení methotrexát, vinblastin, doxorubicin a cisplatina (MVAC) následovaných RACE, nebo k samotné RACE. Studie prokázala benefit OS v rameni s NAC + RACE (77 vs. 46 měsíců; p < 0,06), současně vzestup patologických kompletních odpovědí (pCR) v rameni s NAC + RACE (38 vs. 15 %; p < 0,001). Výskyt pCR je považován za významný účinnostní parametr, jelikož tito nemocní dosahují excelentních výsledků. Studie BA06 30,894 srovnávala podání 3 cyklů předoperační chemoterapie (cisplatina, methotrexát, vinblastin) vs. lokální léčba samotná (RACE nebo radioterapie) u 900 léčených pacientů. V rámci primární analýzy nebyl mezi léčebnými rameny statisticky významný rozdíl v OS, nicméně při delším sledování bylo prokázáno statisticky významné snížení rizika úmrtí o 16 % ve prospěch ramene s NAC a lokální terapie a 10leté OS 30 vs. 36 % ve prospěch kombinovaného přístupu.
Dvě klinické studie fáze II testovaly modifikovaný režim MVAC, tzv. dávkově denzní MVAC (dd-MVAC). V jedné ze studií bylo léčeno 39 pacientů, kteří dostali 4 cykly dd-MVAC v neoadjuvantním podání. Primárním cílem studie byla patologická odpověď definovaná jako „downstaging“ tumoru na ≤ pT1N0. Výsledkem byla patologická odpověď 49 % a pCR 26 %. V jiné jednoramenné studii bylo režimem dd-MVAC (3 cykly) léčeno 44 pacientů a patologické odpovědi dosáhlo 52 % nemocných a pCR 38 %. V současné době se využívá pouze dd-MVAC díky lepší toleranci, kratšímu trvání a vyššímu počtu pCR ve srovnání s klasickým režimem MVAC.
Chemoterapeutický režim kombinující cisplatinu s gemcitabinem (CG) je standardem v 1. linii léčby metastatického uroteliálního karcinomu (UC) na základě výsledků studie fáze III, která prokázala srovnatelné výsledky přežití bez progrese (PFS) i OS režimu CG ve srovnání s MVAC, navíc s lepším bezpečnostním profilem. Navzdory nedostatku randomizovaných klinických studií s CG v perioperačním podání byla účinnostní data režimu CG v metastatickém podání extrapolována do neoadjuvantní indikace a režim CG je dnes běžně používaným režimem i v této indikaci.
Studie GETUG-AFU V05 VESPER je randomizovaná studie fáze III, která srovnávala dd-MVAC s CG u pacientů s MIBC v perioperačním podání. Celkově 88 % pacientů obdrželo v rámci studie NAC. Studie prokázala, že tříleté PFS bylo výrazně prodloužené v rameni s dd-MVAC (66 vs. 56 %, HR 0,7 [95% CI 0,51–0,96], p = 0,025). V rameni s dd-MVAC bylo také dosaženo vyššího počtu pCR 63 vs. 50 % (p = 0,021). Navzdory lepší účinnosti se však režim v běžné klinické praxi příliš nevyužívá z obavy z toxicity.
Metaanalýzy studií rovněž prokázaly benefit OS ve prospěch NAC na bázi cisplatiny vs. samotná RACE u nemocných s MIBC. NAC má jednoznačně své místo v léčebném algoritmu, přesto ji velká část nemocných nepodstoupí. Častým důvodem bývá zejména renální insuficience, respektive neschopnost absolvovat chemoterapii s cisplatinou.
Nádory horních močových cest (upper urinary tract carcinoma – UTUC) jsou vzácné a obecně mívají agresivnější průběh. Vzhledem k absenci dat u této indikace je řada doporučení čistě extrapolována ze studií pro karcinom močového měchýře, nevyjímaje podání NAC na bázi platinového derivátu. Po NAC následuje radikální nefroureterektomie.
Výsledky velkých randomizovaných studií s imunoterapií v neoadjuvantním podání nebyly zatím publikovány, nicméně nástupem imunoterapie se očekávají velké změny v léčebných doporučeních.
Současné možnosti adjuvantní léčby
Role adjuvantní chemoterapie (AC) u pacientů s MIBC byla testována v několika randomizovaných klinických studiích. Výsledky nejsou jednoznačné, jelikož studie nezahrnovaly dostatečný počet pacientů, byly předčasně uzavřeny nebo nebyly výsledky publikovány. Přehled studií je shrnut v tabulce 2.
Ve studii EORTC 3099 bylo léčeno 284 pacientů s MIBC stadia pT3–pT4 nebo N+ M0. Srovnávala se účinnost AC (ve složení 4 cykly chemoterapie CG, high-dose MVAC nebo konvenční MVAC) vs. odložená chemoterapie po operaci. OS jako primární cíl studie nebyl naplněn, nicméně podání AC významně zlepšilo přežití bez nemoci (disease free interval – DFS). Díky poměrně kontroverznímu designu zůstávají i výsledky studie kontroverzní. Ve Španělsku probíhala klinická studie, která analyzovala léčebné výsledky mezi pacienty léčenými v rameni s AC (cisplatina, gemcitabin a paklitaxel) vs. observace u pacientů po resekci high-risk MIBC. Do studie se podařilo randomizovat pouze 200 nemocných z původně plánovaných 600 a výsledkem nebyl statisticky signifikantní benefit v OS ani DFS.
V rámci populace pacientů s UTUC byla publikována randomizovaná studie fáze III POUT, která zaznamenala v adjuvantním podání výrazný benefit adjuvantní chemoterapie na bázi platiny ve srovnání s observací 70 vs. 51 % při dvouletém sledování.
Bylo publikováno několik systematických přehledových článků a metaanalýz se zaměřením na AC u MIBC. Metaanalýza 10 klinických studií (1 183 pacientů) prokázala benefit v OS u pacientů léčených AC na bázi cisplatiny (HR 0,79, 95% CI 0,7–0,96, p = 0,02). Při pětiletém sledování bylo prokázáno absolutní zlepšení OS o 6 %. Chemoterapie na bázi cisplatiny navíc zlepšila parametry přežití bez recidivy onemocnění (disease free survival – DFS) (HR 0,71, 95% CI 0,60–0,83, p < 0,001), přežití bez lokální recidivy (HR 0,68, 95% CI 0,55–0,85, p < 0,001) a přežití bez metastáz (HR 0,79, 95% CI 0,65–0,95, p = 0,01).
Jednoznačnou nevýhodou AC je snížení schopnosti absolvovat AC, především z důvodu zhoršení renálních funkcí nebo celkového výkonnostního stavu. AC může mít několik teoretických výhod, jako časné ukončení definitivní léčby včetně RACE, přesnější patologické stadium a prognostické faktory; navíc u některých pacientů omezení zbytečného podání chemoterapie (overtreatment).
Co se imunoterapie v adjuvantním podání týče, tak dosud byly publikovány data ze 2 klinických studií hodnotících adjuvantní imunoterapii u MIBC. Jedná se o studii IMvigor010 a CheckMate 274. Výsledky studií jsou shrnuty v tabulce 2.
V rámci studie Imvigor010 byla srovnávána adjuvantní terapie atezolizumab vs. observace u high-risk MIBC v otevřené jednoramenné studii. Do studie bylo zařazeno 807 pacientů v klinickém stadiu ypT2-4a nebo ypN+ po předchozí NAC nebo pT3-4a nebo N+ tumory, pokud nebyla NAC podána. U pacientů nepředléčených NAC bylo podmínkou, že odmítají nebo nejsou kandidáti pro AC. Atezolizumab byl podáván v dávce 1 200 mg každé 3 týdny po dobu 1 roku. Primárního cíle studie DFS nebylo dosaženo, 19,4 měsíce pro rameno s atezolizumabem vs. 16,6 měsíce pro rameno s observací nebyl statisticky signifikantní (HR 0,89, 95% CI 0,74–1,08; p = 0,24).
CheckMate 274 byla randomizovaná dvojitě zaslepená studie fáze III, ve které bylo hodnoceno 709 pacientů s high-risk MIBC v klinickém stadiu ypT2-4a/ypN+ po NAC nebo v případě pacientů bez NAC klinického stádia pT3-4a/pN+. Pacienti bez předchozí NAC nemohli býti kandidáty AC. V rámci studie byli pacienti léčeni nivolumabem v dávce 240 mg nebo placebem každé dva týdny po dobu maximálně 1 roku. Studie měla 2 primární cíle: DFS dosáhlo 20,8 měsíce versus 10,8 měsíce ve prospěch ramene s nivolumabem, a DFS po 6 měsících sledování činil 74,9 vs. 60,9 % (HR 0,70; 98,22% CI 055–0,90). U pacientů s PD-L1 expresí ≥ 1 % byl DFS v 6 měsících 74,5 vs. 55,7 % ve prospěch ramene s nivolumabem (HR 0,55; 98,72% CI 0,35–0,85; p ≤ 0,001).
Přímé srovnání dvou klinických studií se nedoporučuje. Obě studie mají obdobný design, nicméně jsou mezi nimi určité odlišnosti. Ve studii CheckMate 274 byly pacienti léčeni placebem, ale ve studii Imvigor010 byla v kontrolním rameni pouze observace. Studie CheckMate 274 na rozdíl od studie Imvigor010 zahrnovala rovněž pacienty s UTUC. Výsledek ramene s imunoterapií byl v obou studiích srovnatelný (19,4 m v rameni s atezolizumabem versus 20,8 m v rameni s nivolumabem), zatímco DFS v kontrolním rameni byl rozdílný (16,6 m v rameni s observací v rámci studie Imvigor010 vs. 10,8 m v rameni s placebem ve studii CheckMate 274). Otázkou zůstává, proč jsou výsledky studií s podobnou populací takto rozdílné. Určitou roli jistě hraje rozdíl v mechanizmu účinku, kdy blokáda PD-1 se jeví účinnější než blokáda PD-L1.
V současné době probíhá studie AMBASSADOR (NCT03244384), která testuje pembrolizumab v adjuvantním podání. Výsledky studie nebyly dosud publikovány.
Výhled do budoucnosti
V blízké době lze očekávat významné změny, které ovlivní přístup k perioperační léčbě pacientů s MIBC. Inhibitory kontrolních bodů imunitní reakce (immune checkpoint inhibitors – ICI) cílící PD-1 a PD-L1 zaznamenaly úspěchy v léčbě pokročilého UC, v brzké době lze očekávat jejich implementaci v časnějších stadiích MIBC. ICI mají příznivý bezpečnostní profil a možnost jejich kombinace s chemoterapií je zkoumána v perioperačním podání jak u pacientů vhodných, tak i nevhodných k cisplatině. V současné době běží celá řada klinických studií, na jejichž výsledky si však budeme muset ještě chvíli počkat. Dále jsou to výsledky léčby v podobě konjugátu protilátky a cytostatika (antibody-drug conjugate – ADC), kam patří enfortumab vedotin (EV) nebo sacituzumab govitekan, nebo inhibitorů receptoru pro fibroblastový růstový faktor (FGFR), kam spadá erdafitinib. I tyto molekuly se jeví jako klinicky velmi významné a aktuálně představují léčebnou alternativu v pokročilé fázi onemocnění. Díky jejich účinnosti lze očekávat změny v léčebném algoritmu i v časnějších fázích choroby. V současné době probíhají klinické studie, které testují tyto molekuly v monoterapii či v kombinaci s chemoterapií v neoadjuvantním či adjuvantním podání s velmi slibnými výsledky. Vysoce účinné kombinace imunoterapie s ADC jsou potencionálně novým standardem léčby, který jednoho dne vystřídá chemoterapii na bázi cisplatiny.
Výzkum je také soustředěn na prediktivní biomarkery, které by měly význam v predikci léčebné odpovědi především v neoadjuvantní indikaci. Velmi zajímavou otázkou je zachování močového měchýře po absolvování neoadjuvantní terapie u nemocných, kteří díky léčbě dosáhnou pCR. RACE je komplexní procedura zatížená významnými pooperačními komplikacemi, morbiditou, mortalitou, výrazným poklesem kvality života, i přes pokroky v miniinvazní chirurgii. Možnost zachování močového měchýře tedy představuje velkou šanci pro pacienty podstoupit radikální léčbu při zachování dobré kvality života.
Závěr
Léčebné schéma uroteliálního karcinomu odvisí od celé řady parametrů, počínaje klinickým stadiem nemoci, specifickými parametry onemocnění a celkovým výkonnostním stavem pacienta. Optimální terapeutický postup by měl být diskutován v rámci multidisciplinárního týmu a následně otevřeně komunikován s pacientem tak, aby se dokázal informovaně rozhodnout o léčebném postupu, který podstoupí. Současným standardem v perioperačním přístupu MIBC zůstává NAC na bázi cisplatiny následovaná RACE, nicméně riziko rekurence onemocnění je vysoké. Velmi problematickým zůstává téma nemocných nevhodných pro chemoterapii s cisplatinou.
Výsledky klinických studií fáze II testujících imunoterapii či ADC v perioperačním období vypadají velmi slibně. V současné době probíhající klinické studie fáze III se zaměřují především na slibné molekuly a jejich kombinace v neoadjuvantní či adjuvantní aplikaci. Tyto nové režimy mohou významně ovlivnit léčebné schéma MIBC, zlepšit výsledky onkologické léčby a také přinést nové alternativní možnosti v terapii pacientů nevhodných pro chemoterapii s cisplatinou.
doc. MUDr. Hana Študentová, Ph.D.
Onkologická klinika, FN Olomouc
