Nemetastatický kastračně rezistentní karcinom prostaty je definovaný stoupající koncentrací PSA (biochemická progrese – tři následné vzestupy PSA v odstupu minimálně jednoho týdne; výsledné zvýšení PSA je 2x o 50 % nad nadir, minimální koncentrace >2ng/ml) při nepřítomnosti metastáz u pacientů s kastrační koncentrací testosteronu (<50 ng/ml nebo 1,7 nmol/l). Do roku 2018 bylo možností volby u takových pacientů pokračovat v androgenní deprivaci s cílem dále udržovat kastrační koncentrace testosteronu a zahájit dostupnou specifickou léčbu indikovanou pro metastatické stadium onemocnění v případě, kdy bylo metastatické postižení detekovatelné.
Současná dostupnost moderních inhibitorů androgenního receptoru nové generace (enzalutamid, apalutamid a nově také darolutamid) zásadně změnila možnosti postupu s cílem významně prodloužit přežívání bez metastáz u pacientů s kastračně rezistentním nemetastatickým karcinomem prostaty. Uvažování o bezpečnostním profilu léčby a rizikovosti pacienta ze strany karcinomu i možných nežádoucích účinků léčby je v případě tohoto onemocnění velmi důležité.
Postižení kastračně rezistentním nemetastatickým karcinomem prostaty (nmCRPC – non-metastatic castration-resistant prostate cancer, M0 CRPC) přináší pacientovi riziko přechodu, dříve či později, do metastatické fáze onemocnění, především s postižením skeletu, které je pak doprovázeno nástupem symptomů spojených se zásadním ovlivněním kvality života. Prodloužení přežití bez metastatického postižení při minimální zátěži nežádoucími účinky onkologické léčby je jistě důležitým zájmem v péči o pacienty s karcinomem prostaty. Darolutamid je v současnosti třetím moderním inhibitorem androgenního receptoru (ARi) vedle enzalutamidu a apalutamidu (pozn.: v literatuře se různě tyto léky zahrnují spolu nebo darolutamid zvlášť do druhé nebo třetí generace ARi).
Výsledky studie ARAMIS
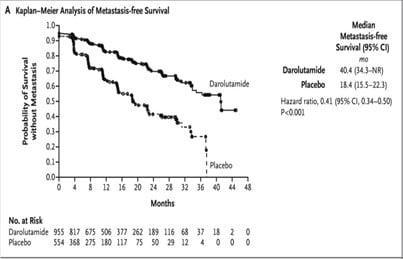
V rámci fáze-3 studie ARAMIS (Androgen Receptor Antagonist Agent for Metastasis-free Survival) s populací pacientů s nmCRPC a zdvojovacím časem vzestupu PSA (doubling time) ≤10 měsíců (minimální koncentrace PSA >2ng/ml) prodloužil darolutamid v dávkování 600 mg 2x denně v kombinaci s androgen deprivační léčbou medián přežití bez metastáz o 22 měsíců proti skupině pacientů s placebem (40,4 vs. 18,4 měsíce, P <0,001), čemuž odpovídaly i další dosažené důležité výstupy uvedené níže, a také zlepšení celkového přežití po 3 letech (83 % [95% CI: 80 – 86] vs. 77 % [95% CI: 72 – 81] ve skupině s placebem). Viz graf 1 a 2.
Graf 1 Kaplan-Meierova analýza doby přežívání bez metastáz
Kaplan-Meierovy křivky přežití bez metastáz při léčbě darolutamidem proti placebu ve studii ARAMIS ( Fizazi K, et al. N Engl J Med. 2019).
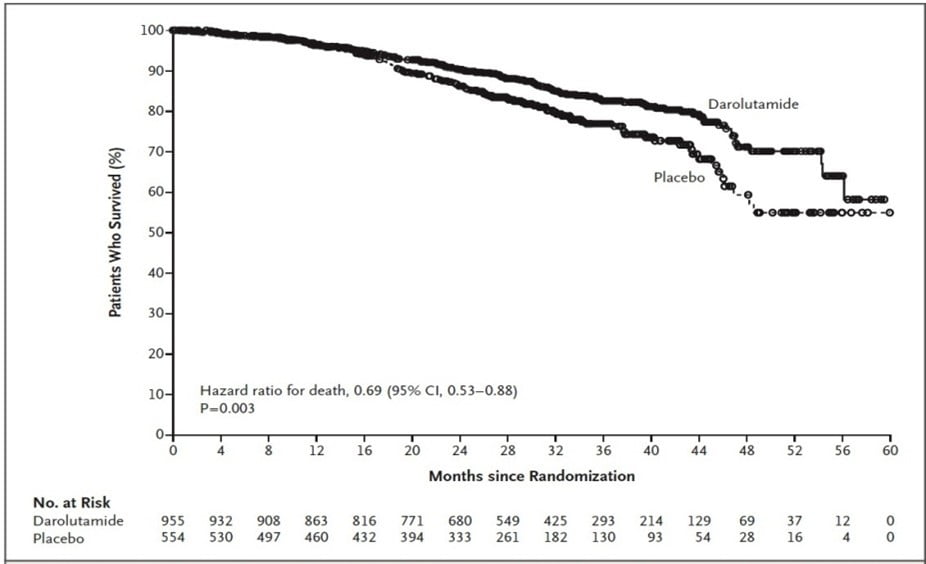
V této dvojitě zaslepené studii bylo zařazeno 1 509 mužů v poměru 2 : 1 k užívání darolutamidu (n = 955) nebo placeba (n = 554), zatímco léčba androgenní deprivací dále pokračovala. Poté, co bylo potvrzeno, že výsledky analýzy primárního sledovaného ukazatele (doby přežívání bez metastáz) byly pozitivní, došlo k odslepení přiřazené léčby a pacientům ve skupině s placebem bylo umožněno přejít na léčbu darolutamidem v otevřené studii. V době odslepení přešlo všech 170 pacientů, kteří stále ještě dostávali placebo, na léčbu darolutamidem (137 pacientů, kteří před odslepením vysadili placebo, dostalo alespoň jednu další terapii prodlužující život). Celkové přežití po 3 letech bylo tedy 83 % ve skupině s darolutamidem (95% CI: 80 – 86) a 77 % ve skupině s placebem (95% CI: 72 – 81) s významně nižším rizikem úmrtí při léčbě inhibitorem o 31 % (poměr rizika úmrtí: 0,69; 95% CI: 0,53 – 0,88; P = 0,003). Toto prodloužení přežití bylo tedy pozorováno i přesto, že více než polovina pacientů přiřazených původně do skupiny s placebem (55 %, 307 z 554) obdržela následnou léčbu s darolutamidem nebo jinou účinnou léčbu (docetaxel, abirateron, enzalutamid). Ve skupině s darolutamidem pouze 15 % (141 z 955) mělo následnou jinou účinnou léčbu.
Graf 2 Kaplan-Meierova analýza celkového přežití
Kaplan-Meierovy křivky celkového přežití při léčbě darolutamidem proti placebu ve studii ARAMIS. (Fizazi K, et al. N Engl J Med. 2020).
Darolutamid proti placebu byl také přínosem, pokud jde o všechny ostatní sekundární sledované ukazatele, včetně doby do první symptomatické kostní příhody (ve třech letech bez příhody: 96 % vs. 92 % s delší dobou do rozvoje – HR 0,48; 95% CI: 0,29 – 0,82; P = 0,005), doby do prvního použití chemoterapie (ve třech letech bez chemoterapie: 83 % vs. 75 %, delší doba do první chemoterapie – HR 0,58; 95% CI: 0,44 – 0,76; P <0,001) a rozvoje bolesti (medián doby do progrese bolesti: 40,3 vs. 25,4 měsíců, HR 0,65; 95% CI: 0,53 – 0,79; P <0,001).
S ohledem na výskyt nežádoucích účinků byly výsledky u obou skupin prakticky obdobné a rovněž byl srovnatelný i podíl pacientů, kteří ukončili předepsanou léčbu z důvodu nežádoucích účinků v obou hodnocených skupinách (8,9 % a 8,7 % při placebu). Při úpravě a přepočtu s ohledem na délku expozici léčivu vykazovala incidence specifických nežádoucích účinků (events of interest – pády, křeče, hypertenze, mentální dysfunkce, depresivní poruchy) jen minimální nebo žádné rozdíly mezi sledovanými skupinami. Incidence kardiologických komplikací (arytmie, srdeční selhání, poruchy koronárních cév) byla mírně vyšší u darolutamidu (7,3, 1,9 a 4,0 % vs. 4,3, 0,9 a 2,7 %), ovšem v této skupině již při zařazení bylo vyšší zastoupení pacientů s arytmií nebo EKG abnormalitami. Zajímavý byl relativně nízký výskyt únavy, která byla hlášena u 13,2 % pacientů léčených darolutamidem a jednalo se tak o vůbec o jediný nežádoucí účinek s výskytem nad 10 % v průběhu zaslepené fáze studie (výskyt ve skupině s placebem 8,3 %).
Samostatně zpracovávaným tématem bylo ověřování vlivu přidružených chorob a současných medikací, analýza nežádoucích účinků v podskupině pacientů užívajících statiny a farmakokinetická analýza v podskupině 388 pacientů léčených darolutamidem. Prakticky 98 – 99 % pacientů v obou větvích mělo při mediánu věku 74 let minimálně jednu přidruženou chorobu a užívali minimálně jednu současnou medikaci. I přes časté současné užívání léčiv s potenciálem lékových interakcí nebyly prokázány významné vlivy na farmakokinetiku darolutamidu, když současná medikace zahrnovala hypolipidemika (34,5 %), betablokátory (29,7 %), antitrombotika (42,8 %) a systémová antibiotika (26,9 %). Ačkoliv farmakokinetické údaje ukazovaly, že darolutamid má potenciál interakce s rosuvastatinem, nebylo zřejmé, že by tento fakt měl reálný praktický dopad na vzestup incidence nežádoucích účinků z důvodu užívání statinů v rámci studie. Zatímco metabolismus enzalutamidu a apalutamidu významně souvisí s aktivitou cytochromu CYP3A4, v případě darolutamidu nebyl významný dopad pozorován a ani u dalších případů CYP1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1. Tento fakt pak může pomoci vysvětlit nepřítomnost významných rozdílů toxicit mezi darolutamidem a placebem ve studii ARAMIS. Minimální schopnost darolutamidu procházet hematoencefalickou bariérou, jak bylo pozorováno v preklinických a jiných studiích, pak nejspíše vysvětluje i poznatek menšího výskytu nežádoucích účinků ve vztahu k centrálnímu nervovému systému (únava, pády, křečové stavy: 13,2 a 5,2 a 0,2 %) u pacientů s darolutamidem.
Role moderních inhibitorů androgenního receptoru
V rámci skupiny moderních nesteroidních ARi je darolutamid unikátní tím, že zahrnuje v sobě dvě farmakologicky aktivní diastereomery [S,R]-darolutamid a [S,S]-darolutamid) a vykazuje i rezistenci na známé mutace androgenního receptoru (AR). Darolutamid a jeho aktivní metabolit (keto-darolutamid) mají schopnost inhibovat testosteronem navozenou translokaci AR do buněčného jádra, a tak snižovat aktivaci genů nutných pro růst a přežívání buněk prostatického karcinomu. Darolutamid a jeho metabolit rovněž vykazují pevnější vazbu na receptor než enzalutamid a apalutamid, jsou plnými antagonisty se zachováním aktivity i proti známým mutacím, které navozují rezistenci AR na androgen deprivační léčbu a/nebo mohou dokonce revertovat androgenní inhibitory na agonisty podporující aktivaci/nukleární translokaci AR (např. mutace F877L v případě enzalutamidu a apalutamidu, mutace W742L a T878A u bicalutamidu).
Na základě dostupných údajů je tedy možno shrnout, že u mužů s nmCRPC s vysokým rizikem (tedy s dobou do zdvojnásobení hodnoty PSA ≤10 měsíců) je možno při současně dále zajištěné androgenní deprivaci významně ovlivnit a prodloužit přežití bez rozvoje metastáz i celkové přežití díky moderním inhibitorům androgenního receptoru, ať už se jedná o enzalutamid (studie PROSPER), apalutamid (studie SPARTAN) nebo nyní nověji „služebně“ nejmladší darolutamid (studie ARAMIS). Darolutamid nese nízké riziko klinicky významných lékových interakcí se současně užívanou medikací běžně užívanou v populaci nemocných pacientů, včetně hypolipidemik, má snížený přechod přes hematoencefalickou bariéru, čímž je vysvětlován nižší potenciál jeho nežádoucích účinků proti jiným ARi.
Přínos zobrazovacích hybridních metod
Dalším, jistě velmi zajímavým tématem diskusí o nejvhodnější péči o pacienty s karcinomem prostaty, je v kontextu biochemických relapsů a progresí jistě také význam a praktický dopad využívání velmi moderních a citlivých zobrazovacích hybridních metod (PET/CT a PET/MR, především s ligandem Galium-PSMA) v porovnání s konvenční scintigrafií kostí, CT a MR.
Literatura u autora.
Prof. MUDr. Samuel Vokurka, Ph.D.
Onkologická a radioterapeutická klinika, LF UK a FN Plzeň