Povědomí o onemocnění zhoubnými nádory kolorekta mezi lékaři a zdravotníky je u nás sice na poměrně dobré úrovni a ani osvěta ve veřejnosti a médiích není špatná, účinnost získaných poznatků pro praxi je však zatím neuspokojivá a leckde ještě chybí novější informace pro praxi již nezbytné, máme-li nabízet onkologickou péči a prevenci na úrovni současného poznání, jak nám velí zákon. Pojednejme tedy o kolorektálním karcinomu z novějšího pohledu, než jak bylo již dříve leckde probíráno, a věnujme se spíše aktuálním poznatkům v poznámkách k epidemiologii, diagnostice a terapii.
Kolorektální karcinom (KRK) je u nás dlouhodobě nejčastějším nádorovým onemocněním společně u mužů a žen. Samostatně u mužů dominují nádory prostaty, u žen nádory prsu. KRK je nicméně jejich nejčastější společný onkologický problém. V uplynulých dekádách výskyt KRK dramaticky stoupal, nyní se už trend zpomaluje a mírně klesá (graf 1).
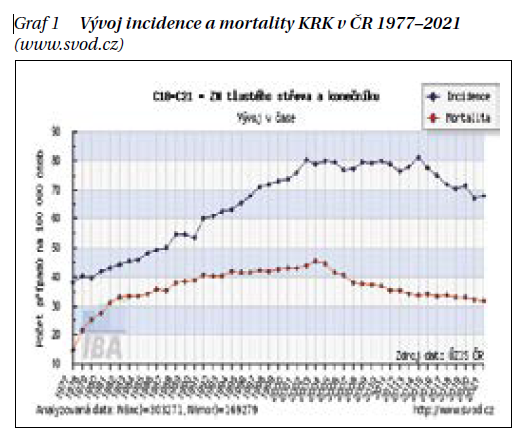
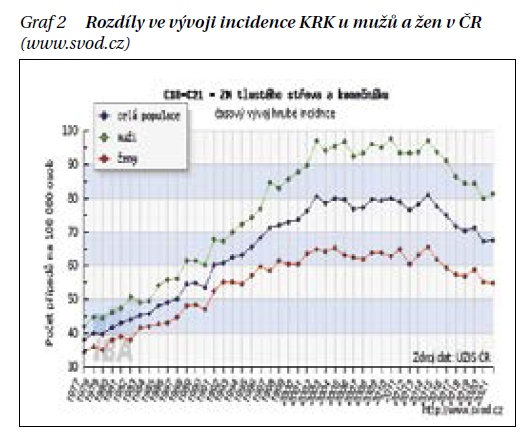
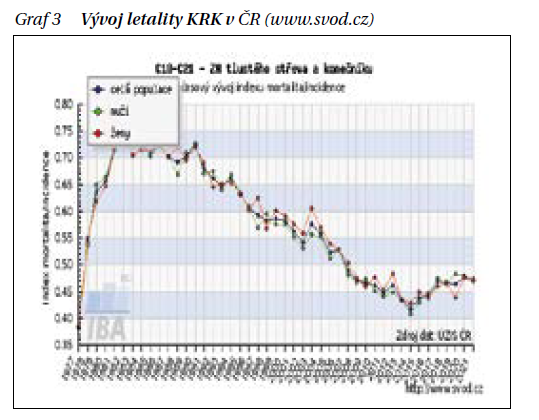
Výskyt KRK se liší při srovnání pohlaví významně vyšší incidencí u mužů, trendy jsou však velmi podobné (graf 2). Postupně významně klesá poměr mezi mortalitou a incidencí, tedy M/I index neboli letalita čili smrtnost KRK (graf 3).
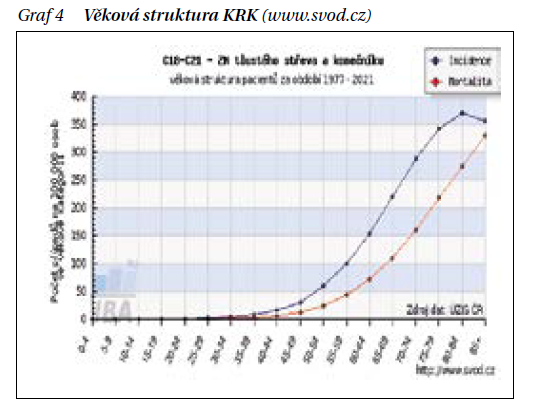
Věkové rozložení incidence je důležité hlavně pro správné a cílené nastavení screeningového programu. Výskyt KRK v populaci vykazuje kontinuální strmý nárůst KRK s věkem od zhruba 50 let.
Preventivní program se bohužel v ČR zatím příliš nepromítá do proporcí zachycovaných klinických stadií (graf 5). Zřejmě také proto, že účast mužů i žen v kolorektálním screeningu je u nás stále nízká, celkově jen kolem 20–30 %, podle regionů však leckde i nižší. Klesající letalita jde tedy zatím patrně jen na vrub bezpečnější operativy či intenzivnější komplexní léčby v pokročilejších stadiích. Potenciál k dalšímu zlepšování výsledků incidence a mortality má však do budoucna především širší systematické preventivní vyšetřování populace od 50 let věku záchytem časných stadií KRK. Podíl časných prvních stadií i dobře kurabilních druhých stadií je zatím stále neuspokojivě nízký a zatím se nijak nezvyšuje.
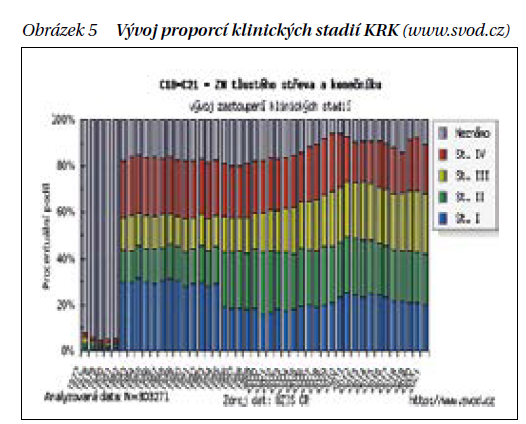
Screeningový záchyt KRK je sice postaven především na testech na okultní krvácení ve stolici (TOKS), preferovat je ovšem třeba preventivní kolonoskopii, protože časné polypózní a adenomatózní léze nemusí vůbec mikroskopicky krvácet a TOKS nemusí tyto nejčasnější fáze nádorových změn odhalit. V uvedené realitě čísel tedy v ČR pracujeme a je mimořádně důležité uvedené trendy nejen sledovat a znát, ale také se snažit o jejich pozitivní ovlivnění již prevencí nebo léčbou. Srovnávání se zahraničními výsledky tam či onde je jistě zajímavé, ale pouhým jejich popisem naši realitu nezměníme.
Epidemiologická zjištění i dohady
O ústupu kancerogenů v prostředí a zejména v potravě nemožno mít v bující civilizaci, při stravovacích zvyklostech a životním stylu v době povšechného dostatku až blahobytu iluze. Stabilizace až pokles incidence mohou být v případě KRK působeny už i zásluhou samotného preventivního vyšetřování, zejména pak kolonoskopie, při níž jsou často také odstraňovány polypy či adenomy, tedy velmi časné nádory už v samém zárodku vzniku.
Preventivní kolonoskopické vyšetření má zjevně dvojí dopad. Může se příznivě odrazit včasným záchytem karcinomů na mortalitě, ovšem včasnou eliminací potenciálních prekanceróz také na incidenci. Ony „polypy“ jistě nejsou homogenní skupinou, patří sem jak nerizikové polypy zánětlivé, tak polypy dysplastické nebo pravé adenomy, případně již s mikroskopickými strukturami karcinomu in situ. Proto je také vhodné upravovat intervaly mezi následnými kolonoskopickými kontrolami podle jejich histologicky určené povahy a predikce rizik dalšího výskytu z již odstraněných lézí, a to na 3–5 let u těch málo rizikových až třeba po roční nebo dokonce půlroční intervaly při vysokém riziku maligní transformace.
Samostatně je nutno hodnotit a vyhledávat podskupinu asi 10 % pacientů s KRK, u nichž lze vysledovat dědičnost a hereditární zátěž v rodině a také už definovat příčiny v genových alteracích. Týká se to obvykle mladších pacientů. Patří sem syndrom familiární polypózy, rozvíjející se plně už od třetí dekády života, Lynchův syndrom s mutacemi v genech opravujících DNA (MLH1, MSH2 aj.) od dekády čtvrté, ale také u nosiček mutací v genech BRCA1/BRCA2, případně p53 a dalších. Nepochybně nalezneme v lidském genomu také další poruchy, které se mohou na vzniku KRK podílet, i když je dosud označujeme jako spontánní či sporadické, byť představují většinu případů. Pacienti s vícečetným výskytem nádorů v rodině, případně ve velmi mladém věku by určitě měli mít přístup k onkogenetické konzultaci i genetickému testování, pokud je indikováno a pacient s ním souhlasí. Nelze však akceptovat účelová a komerčně nabízená vyšetřování genomu s pochybnými interpretacemi budícími jen nejistotu, obavy i strach, jak se s přístupem k molekulárním technologiím také místy i děje.
Zatím jen bádáme nad potenciálním kancerogenním či naopak ochranným vlivem mikrobiomu tlustého střeva. Je už prokázáno, že převaha kvasných bakterií ve střevním mikrobiomu přináší daleko menší riziko vzniku střevních nádorů než prevalence bakterií hnilobných a proteolytických. Nemalý vliv na vznik nádoru mohou mít také autoimunitní mechanizmy, udržující ve střevě chronický zánět, ovšem i chronické poruchy střevního vyprazdňování.
Neumíme dosud vysvětlit onen dramatický rozdíl v incidenci nádorů mezi tenkým a tlustým střevem s ostrou hranicí při bauhinské chlopni, byť epiteliální výstelka obou typů střeva se zjevně liší strukturálně i funkčně.
Je nicméně alarmující, že v ČR po léta zcela chybí obor nebo podobor nádorová epidemiologie s rolí vzdělávací, výzkumnou a interpretační, přestože celoživotní riziko výskytu zhoubného nádoru v populaci je 1 : 3 a riziko úmrtí na nádorové onemocnění 1 : 4. Často tak platí, že máme sice k dispozici dostatek dat, ale jen málo shrnujících informací a interpretací.
Klasifikace kolorektálních nádorů
Anatomicky KRK spadají podle Mezinárodní klasifikace nádorů (MKN) pod kódy C18 – nádory v různých úsecích tlustého střeva od appendixu a céka, ascendens, transversa, descendens až po esovitou kličku, C19 – nádory rektosigmatu na přechodu intra- a extraperitoneálního úseku tlustého střeva, C20 – nádory konečníku v extraperitoneálním úseku a C21 – terminální nádory anální.
Histopatologicky jde v tlustém střevě i konečníku v drtivé většině o adenokarcinomy, raritní jsou karcinoidy, v análním převládají plochobuněčné karcinomy s odlišnými vlastnostmi, třeba také vyšší citlivostí k léčbě zářením. Celkově však naprosto dominují adenokarcinomy a liší se stupněm diferenciace čili zralosti buněk, počínaje nádory dobře diferencovanými (G1), přes středně diferencované (G2) až po nediferencované (G3) a zcela nezralé anaplastické (G4). Liší se také makroskopicky typem exofytického nebo spíše invazivního až ulcerózního růstu. Tomu pak zpravidla odpovídá i různý proliferační a metastatický potenciál těchto nádorových podtypů.
Podle invaze stěnou střevní kategorizujeme nádory symboly T1–T4, podle výskytu uzlinových metastáz N0–N3 a podle výskytu orgánových metastáz M0 a M1, též doplněné údajem o místě metastazování M1(hep), M1(pulm) a podobně.
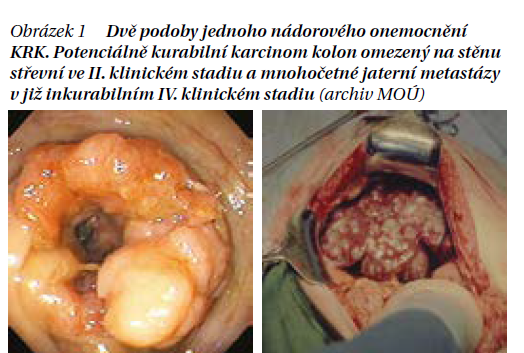
Údaj o klinickém stadiu onemocnění založený na TNM systému je bez ohledu na pokrok v detailnější onkologické diagnostice stále základní, trvalou a nepodkročitelnou součástí diagnózy KRK v každém jednotlivém případě a hlavním východiskem pro stanovení příslušného léčebného postupu. Základem předléčebné diagnózy je tedy schematicky řečeno typing, grading a zejména staging, tedy endoskopie s histologickou verifikací nádoru a upřesněním jeho vlastností a dále pak hlavně stanovení rozsahu nádoru na základě sonografie, CT, případně MR a PET/CT pro upřesnění lokoregionálního rozsahu i zjišťování orgánových metastáz. Stanovení sérových markerů CEA a CA19-9 již na počátku může být dobrým vodítkem pro monitoring efektu léčby i rekurencí v budoucnu. Část karcinomů patří do podskupiny non-sekretorů a tyto markery neprodukují, nebo jen velmi málo. Primární diagnostika by měla být organizována a provedena tak, aby se s léčbou mohlo začít do 3–4 týdnů od začátku vyšetřování. Výjimkou jsou jen akutní ileózní a subileózní stavy střevní neprůchodnosti nebo hrozícího zánětu pobřišnice z perforace, kdy je po rychlém orientačním vyšetření nutná neodkladná resekční či derivační operace a důkladná diagnostika dokončena až poté před zahájením další, zpravidla již kombinovaná terapie (obrázek 1).
Molekulární diagnostika jako východisko pro precizovanou léčbu
U sporadických, tedy těch nejběžnějších kolorektálních karcinomů lze vyčlenit tři velké okruhy změn v transformaci epiteliálních buněk. Lze hovořit o třech cestách kolorektální kancerogeneze, cestě chromozomální nestability, mikrosatelitové nestability a hypermethylace CpG ostrůvků. Z molekulárního hlediska představuje tedy kolorektální karcinom spíše skupinu několika různých onemocnění, u kterých dochází i k překryvu.
Podle Vogelsteinovy hypotézy může dojít k malignímu zvratu již v důsledku mutací jen několika supresorových genů APC, SMAD4 a TP53 a onkogenu RAS.
Chromozomální nestabilita je nejčastějším průvodním znakem kolorektálních karcinomů a lze ji prokázat u dvou třetin všech případů. Zahrnuje širokou změnu chromozomálních změn, jejichž důsledkem může být jak amplifikace některých genů, tak i ztráta heterozygozity jiných genů. Nejčastěji se vyskytují na chromozomech tyto změny:
- rozsáhlý zisk: 7, 8q, 13q, 20, X;
- rozsáhlá ztráta: 1, 4, 5, 8p, 14q, 15q, 17p, 18, 20p, 22q;
- fokální zisk nebo ztráta v oblasti genů: VEGF, MYC, MET, LYN, PTEN;
- vícečetné ztráty alel: 1, 5, 8, 17, 18;
- ztráta celého chromozomu: 18;
- nejvýznamnější změny na úrovni jednoho genu jsou mutace APC, MCC a K-ras, na úrovni rozsáhlejších regionů ztráta na 5q, 8p, 17p a 18q.
Na základě podrobnějších molekulárních charakteristik a podle cest kancerogeneze serátního nebo adenomového typu lze rozlišit pět typů KRK. Jednotlivé typy se rozlišují podle hypermetylace CpG ostrůvků (CIMP), mikrosatelitové nestability (MSI instabilní, MSS stabilní), chromozomálních aberací a charakteristických mutací.
Typ 1 – CIMP-H, MSI-H, s mutací BRAF, chromozomálně stabilní. Těchto asi 12 % kolorektálních karcinomů se označuje též jako sporadické MSI-H kolorektální karcinomy a vznikají z takzvaných serátních lézí.
Typ 2 – CIMP-H, MSI-L nebo MSS, s mutací BRAF, chromozomy stabilní, představuje asi 8 % KRK. Typy 1 a 2 vznikají na podkladě serátních lézí.
Typ 3 – CIMP-L, MSI-L nebo MSS, s mutací KRAS a chromozomální nestabilitou představuje asi 20 % KRK, vzniká na podkladě serátních lézí i klasických adenomů.
Typ 4 – CIMP-negativní, MSS, chromozomy nestabilní, vzniká na podkladě vrozené či získané mutace APC nebo MUTYH z klasických adenomů, představuje majoritu asi 57 % KRK.
Typ 5 – CIMP-negativní, MSI-H, chromozomy jsou stabilní, vzniká na podkladě Lynchova syndromu, tedy defektu v genech opravujících DNA. Označuje se jako familiární MSI-H karcinom a představuje asi 3 % KRK.
Pro receptorově specifickou cílenou léčbu (méně správně nazývanou léčba biologická) jsou klíčové především růstové faktory EGF (epidermal growth factor) a VEGF (vascular endotelial growth factor) a jejich receptory. EGF je cytokin, který se uplatňuje v prorůstové signalizaci. Blokáda receptoru EGFR je jednou z možných terapeutických modalit pokročilého kolorektálního karcinomu. Blokáda je neúčinná u nádorů s aktivující mutací v dráze EGFR, zejména mutací KRAS, BRAF. VEGF je cytokin, který stimuluje neovaskularizaci během růstu nádoru. Také jeho blokáda je jednou z možných terapeutických modalit pokročilého kolorektálního karcinomu, zejména při mutovaném KRAS a BRAF. Pro volbu správné receptorově cílené léčby i zpřesnění prognózy se nyní již mutace genů RAS a BRAF mají testovat u všech KRK v rámci běžné histopatologické diagnostiky.
Operační léčba kolorektálních nádorů
Chirurgická léčba KRK se standardně odvíjí v pěti okruzích – operace nádorů tlustého střeva, operace konečníku, operace nádorů anu, operace jaterních metastáz a paliativní výkony. K dispozici jsou podle rozsahu nádorového onemocnění a anatomické lokalizace operační postupy klasické otevřené, laparoskopické nebo robotické (obrázek 2).
V oblasti kolon patří ke standardním radikálním výkonům pravostranná nebo levostranná hemikolektomie, resekce sigmatu a rektosigmatu, přední resekce rekta s anastomózou nebo abdominoperineální amputace rekta s trvalou stomií, to vše s příslušnými regionálními lymfadenektomiemi. U povrchových (T1) nebo výrazně po záření regredovaných nádorů v oblasti distálního rekta a anu lze někdy zvolit i pouhou kompletní excizi, u spinocelulárních nádorů anu je s ohledem na lymfatickou drenáž třeba věnovat pozornost také inguinálním uzlinám. Paliativními derivačními operacemi jsou stomie, případně bypassy.
Kombinovaná léčba kolorektálního karcinomu s kurativním záměrem
Protože i pouhý centimetrový karcinom obsahuje již asi miliardu maligních buněk vybavených metastatickým potenciálem, vždy je nutno počítat s diseminací nádorových buněk v organizmu, byť zatím jen subklinickou, nebo pak později již klinicky zřejmou. Nedílnou součástí primární léčby nádorů III. stadia s uzlinovými metastázami, u agresivnějších nádorů již také ve II. stadiu, patří ke standardům léčby adjuvantní čili zajišťovací chemoterapie, která má pomoci likvidovat cirkulující nebo někde již usazené mikrometastázy.
Používány jsou různé kombinace klasických cytostatik, jako 5-flurouracil, kapecitabin, oxaliplatina a irinotekan. Podle rizika rekurence, molekulární typizace a u všech lokoregionálně pokročilejších případů je zařazována také receptorově specifická léčba
(známá pod nepřesným označením léčba biologická) preparáty směřovanými proti receptoru EGF, jako jsou cetuximab či panitumumab, nebo proti podpoře neoangioneze VEGF, jako je bevacizumab.
Na adjuvantní léčbu musí vždy navazovat pečlivá dispenzarizace nejméně po dobu pěti let, která má odhalit případný návrat onemocnění v ještě léčitelné fázi. Součástí zajišťovací léčby u karcinomu rekta je radioterapie. Doporučuje se nejen pooperačně, ale standardně i předoperačně k redukci nádoru i jeho šíření do periproktálního tuku a v něm uložených lymfatických uzlin. Provádí se také formou konkomitantní předoperační chemoradioterapie v kombinaci s kapecitabinem. Redukce výskytu lokálních recidiv tímto postupem je zřejmá a v řadě klinických studií dokladovaná. V oblasti kolon, tedy v intraperitoneálním úseku střeva, se radioterapie neprovádí, nově se objevují pokusy o předoperační redukci nádoru neoadjuvantní chemoterapií, pokud však nehrozí obstrukce střeva a je možné operaci odkládat.
Paliativní léčba kolorektálního karcinomu a role multidisciplinárního týmu
Za paliativní pokládáme takovou léčbu KRK, kdy již nelze nádorová ložiska odstranit
i je-li vysoce pravděpodobná progrese nádorového onemocnění subklinicky rozesetého již v organizmu. Nečastější je progrese metastáz v játrech, případně v plicích, nebo pak také v dutině břišní ať již lokálně nebo difuzně po celé pobřišnici, v případě karcinomu rekta pak rozsáhlejší infiltrace v pánvi. Více než o naději na vyléčení onemocnění pak můžeme uvažovat jen o zpomalení progrese a prodloužení života a samozřejmě dbát na minimalizaci útrap. Na rozdíl od dřívější doby, kdy se zbytek života ve IV. stadiu počítal spíše jen na měsíce, můžeme nyní dosahovat prodloužení života až na několik let, a někdy, třeba při solitárních jaterních metastáz nebo omezené lokální recidivě se dokonce snažit o vyléčení.
Je třeba zdůraznit, že IV. klinické stadium má mnoho podob a jednotlivé nádory se dynamikou růstu a svými vlastnostmi dosti liší, takže standardem už má být velmi individuální projednání každého jednotlivého případu v multidisciplinárním týmu (MDT), který doladí a posoudí diagnostiku, probere možnosti operační léčby, radioterapie i chemoterapie, navrhne podpůrnou léčbu a doporučí optimální linii celého postupu. Finálně pak jistě záleží na rozhodnutí samotného pacienta, jemuž jsou důvody pro navrhovaný postup podrobně vysvětleny, nicméně odborný vhled musí vnést MDT, protože jediný odborník a subjektivní pohled zpravidla nepostačuje. MDT je standardem doby a pracoviště, které v tomto módu nepracuje, by vůbec nemělo KRK léčit. Naléhavější než u časných stadií karcinomu kolon je tento požadavek u karcinomu rekta a společně pak u všech pokročilejších stadií III a IV. Kombinatorika léčby je hlavně ve IV. stadiích velmi různá a vyvíjí se také podle léčebné odpovědi nádoru a stavu pacienta, takže posouzení v MDT je zapotřebí i opakovaně. Tento princip projednání v MDT je vlastně důležitější než ta či ona dílčí novinka v chemoterapii nebo biologické léčbě, protože v MDT je zároveň jistota, že nic z klasických nebo nejmodernějších postupů nebude při hledání optimálního postupu, a to včetně zohlednění dostupných klinických studií hodnotících právě nejnovější, pojišťovnami ještě nehrazené preparáty. V onkologii se hojně hovoří o operativě, radioterapii a zejména chemoterapii, důraz je však třeba klást i na organizaci, provázanost a optimalizaci léčebných postupů.
Centralizace a integrace péče
Po vcelku úspěšné organizaci sítě komplexních onkologických center (KOC) u nás od roku 2007 dochází nyní také k návrhům na další soustřeďování péče do center určených pro řešení specifické problematiky některých náročnějších onkologických diagnóz. Pro okruh KRK je takto nyní navržena centralizace operativy a kombinované léčby u karcinomu konečníku. Jsou pro to důvody hlavně ve vyšších nárocích na kvalitu lokoregionálních výkonů, než je tomu u nádorů tlustého střeva.
Podobně se úsilí o centralizaci týká také léčby solitárních a máločetných jaterních metastáz, ať už jde o jaterní resekce anatomické či extraanatomické, ošetření radiofrekvenční ablací, radiochirurgicky, kryochirurgicky, embolizacemi nebo kombinovanými postupy s návazností na chemobioterapii. Pro přísně zvažované a indikované případy je už reálná i varianta transplantace jater, jak navrhuje zcela nový program v IKEM.
Samostatnou kategorií pro centralizaci léčby jsou ascitické formy karcinomů s rozsevem metastáz po peritoneu v dutině břišní a ascitem. V ČR je přiznán statut vysoce specializovaných center pěti pracovištím pro HIPEC čili hypertermickou intraperitoneální extrakorporální chemoterapii, která sestává z pečlivého několikahodinového odstranění celé pobřišnice s metastázami a následné nitrobřišní aplikace cytostatik v roztoku ohřátém pro zvýšení jejich účinnosti. Nově se zavádí i PIPAC, tedy aplikace cytostatik do břišní dutiny v aerosolu při kapnoperitoneu. Při respektování správných indikačních kritérií jsou tyto metody obvykle poslední možností, jak účinně zasáhnout u ascitických forem rozsevu KRK v dutině břišní a nezřídka přinášejí dobré přechodné a někdy i trvalé výsledky.
Řádné fungování MDT, a to především v komplexních onkologických centrech, je velmi důležité hlavně pro pacienty, také však pro udržování odbornosti a úzké spolupráce lékařů a v neposlední řadě i pro objektivizaci a zdůvodnění úhrad nákladné léčby ve zdravotní pojišťovně.
Poděkování patří Ústavu zdravotnických informací a statistiky za grafy, veřejně dostupné na www.svod.cz, a Masarykovu onkologickému ústavu za fotodokumentaci z onkologické praxe.
prof. MUDr. Jan Žaloudík, CSc.
Masarykův onkologický ústav v Brně
